Слайд 2

План лекции
Химические элементы
Типы связей
Вопросы
Список литературы
Слайд 3

Слайд 4
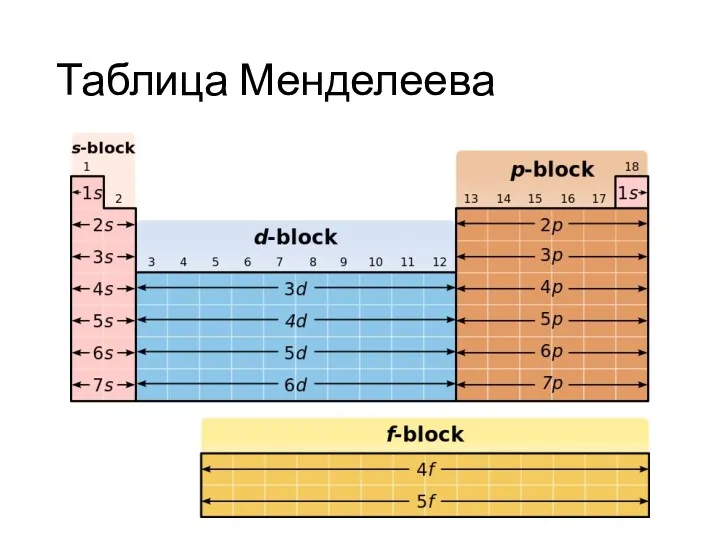
Слайд 5
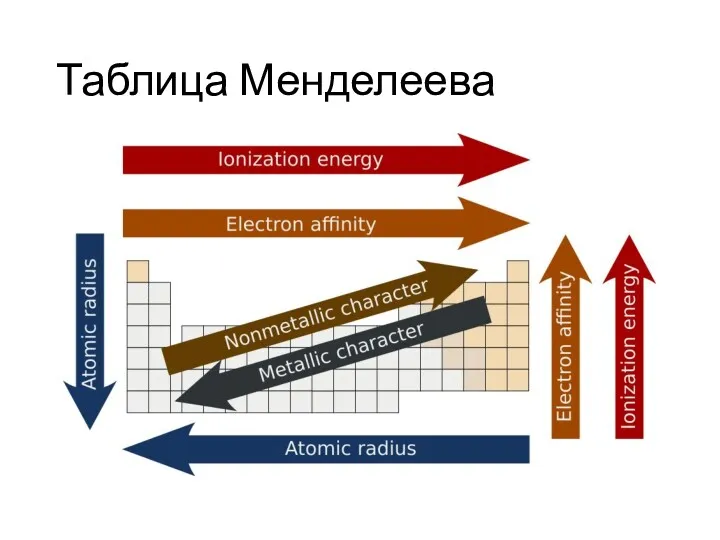
Слайд 6
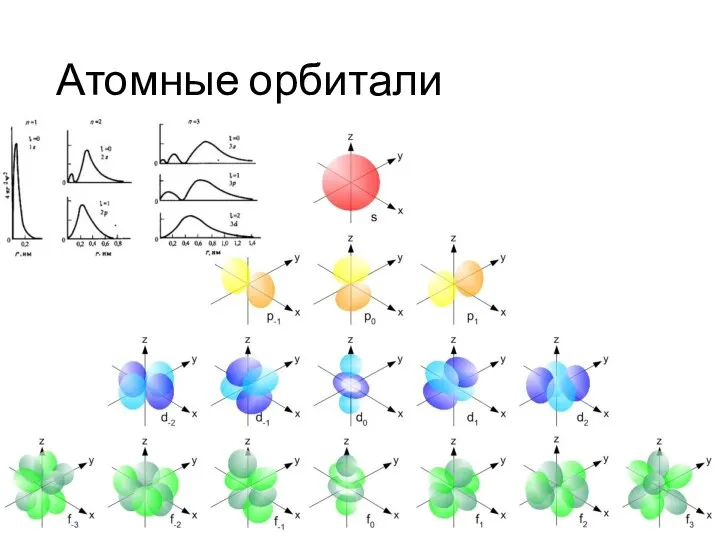
Слайд 7
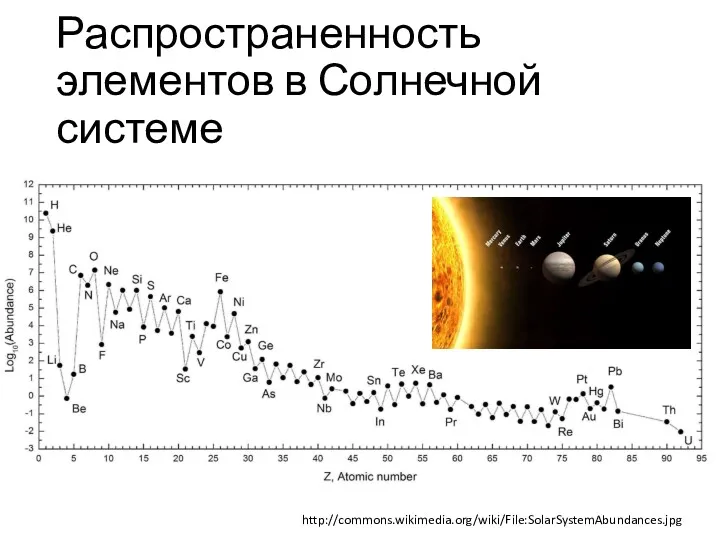
Распространенность элементов в Солнечной системе
http://commons.wikimedia.org/wiki/File:SolarSystemAbundances.jpg
Слайд 8
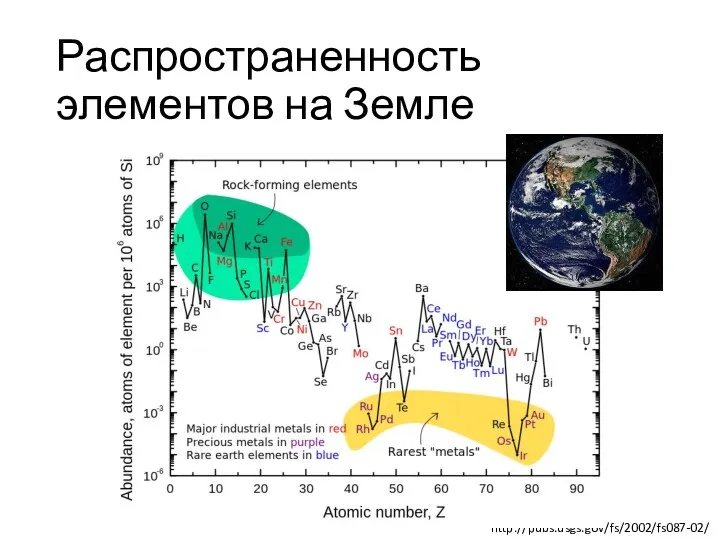
Распространенность элементов на Земле
http://pubs.usgs.gov/fs/2002/fs087-02/
Слайд 9

Химическая связь
Химическая связь – взаимное притяжение атомов, приводящее к образованию молекул,
кристаллов, конденсированной фазы.
Слайд 10

Химическая связь
Тип связи определяет электронные свойства
Тип связи определяет колебательные свойства
Энергия связи
определяет характерную величину взаимодействия, необходимую для воздействия на связь (температура плавления, энергия сублимации и т.д.)
Слайд 11

Типы химических связей
Силы Ван-дер-Ваальса
Ионная связь
Ковалентная связь
Металлическая связь
Водородная связь
Слайд 12

Силы Ван-дер-Ваальса
Силы межатомного (межмолекулярного взаимодействия) с энергией 10-20 кДж/моль.
Классификация ван-дер-ваальсовых
сил
Ориентационные силы, диполь-дипольное притяжение. Энергия такого взаимодействия обратно пропорциональна кубу расстояния между диполями.
Дисперсионное притяжение (лондоновские силы). Взаимодействием между мгновенным и наведенным диполем. Энергия такого взаимодействия обратно пропорциональна шестой степени расстояния между диполями.
Индукционное притяжение. Взаимодействие между постоянным диполем и наведенным (индуцированным)
Слайд 13

Силы Ван-дер-Ваальса-Лондона: кристаллы инертных газов
Слайд 14

Силы Ван-дер-Ваальса-Лондона: кристаллы инертных газов
Слайд 15
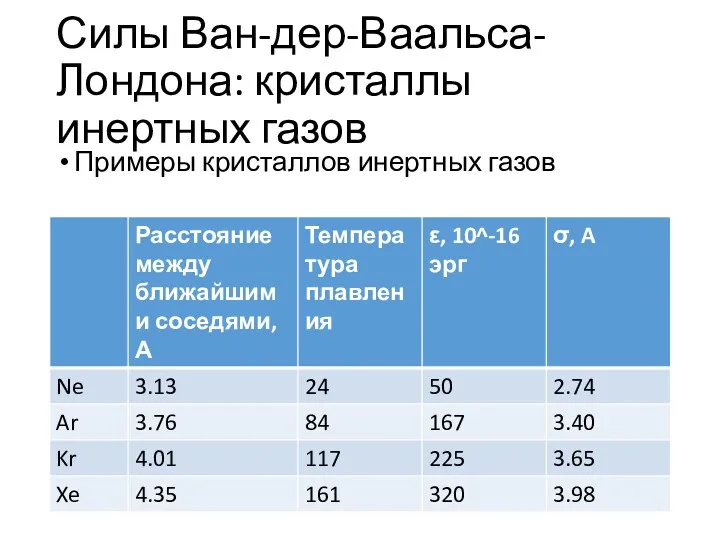
Силы Ван-дер-Ваальса-Лондона: кристаллы инертных газов
Примеры кристаллов инертных газов
Слайд 16

Ионная связь
Ионная связь - очень прочная химическая связь, образующаяся между атомами
с большой разностью электроотрицательностью, при которой общая электронная пара переходит преимущественно к атому с большей электроотрицательностью.
Слайд 17

Электростатическая энергия или энергия Маделунга
Слайд 18

Слайд 19

Объемный модуль упругости
Слайд 20
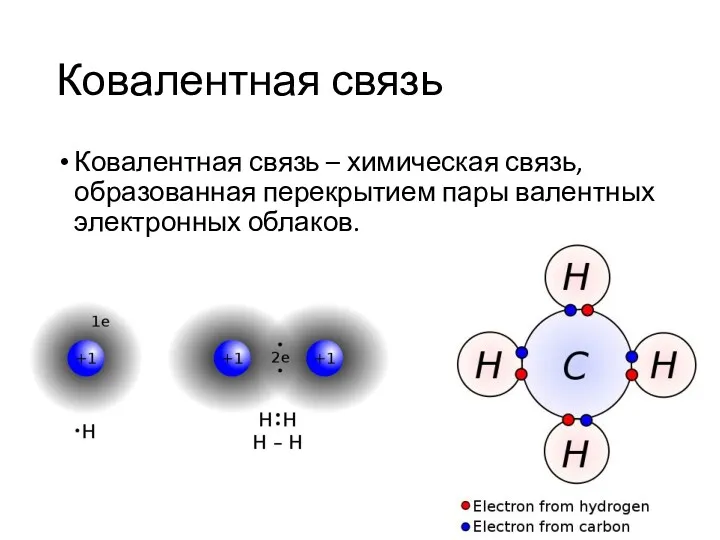
Ковалентная связь
Ковалентная связь – химическая связь, образованная перекрытием пары валентных электронных
облаков.
Слайд 21

Ковалентная связь
Характерные свойства - направленность, насыщаемость, полярность, поляризуемость.
Насыщенность - способность атомов
образовывать ограниченное число ковалентных связей.
Полярность связи связи обусловлена неравномерным распределением электронной плотности.
Валентность – число химических связей.
Слайд 22

Металлическая связь
Химическая связь между атомами, возникающая за счёт обобществления их валентных
электронов.
Характерна для атомов с близкой электроотрицательностью и со слабосвязанными электронами
Слайд 23
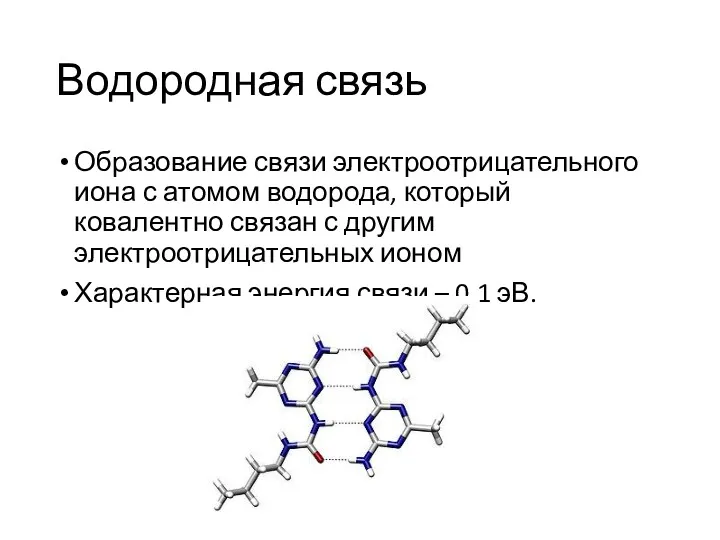
Водородная связь
Образование связи электроотрицательного иона с атомом водорода, который ковалентно связан
с другим электроотрицательных ионом
Характерная энергия связи – 0.1 эВ.
Слайд 24

Вопросы
Получить постоянную Маделунга для первых трех координационных сфер кристалла NaCl.
Оценить объемный
модуль для кристалла Xe























 Влияние состава вещества на эффективность таяния льда и замерзания водных растворов
Влияние состава вещества на эффективность таяния льда и замерзания водных растворов Степень окисления – Условный заряд атомов химического элемента в соединении
Степень окисления – Условный заряд атомов химического элемента в соединении Основные понятия и законы химии
Основные понятия и законы химии Фазовые превращения в стали при охлаждении
Фазовые превращения в стали при охлаждении Смоги и их влияние на человека
Смоги и их влияние на человека Изомерия. Виды изомерии
Изомерия. Виды изомерии Углерод
Углерод Спирты. Определение. Классификация
Спирты. Определение. Классификация Гидролиз солей
Гидролиз солей Игра - викторина
Игра - викторина Кислородсодержащие органические вещества. Фенолы
Кислородсодержащие органические вещества. Фенолы Аналитическая химия. Качественный анализ
Аналитическая химия. Качественный анализ Crystal defects
Crystal defects Оксиды. Классификация. Получение. Свойства
Оксиды. Классификация. Получение. Свойства Химические свойства металлов
Химические свойства металлов В чём соль соли
В чём соль соли Спирты. Классификация спиртов
Спирты. Классификация спиртов Химические свойства металлов. Коррозия металлов
Химические свойства металлов. Коррозия металлов Химические уравнения
Химические уравнения Алюминий. Сплавы алюминия
Алюминий. Сплавы алюминия Водород. Получение и свойства водорода
Водород. Получение и свойства водорода Мытье головы
Мытье головы Аналітична хімія. Лекція 1
Аналітична хімія. Лекція 1 Геохимия. Геохимическая система элементов
Геохимия. Геохимическая система элементов Циклические углеводороды
Циклические углеводороды Физико-химические свойства аммиака. Производство аммиака
Физико-химические свойства аммиака. Производство аммиака Окислительные свойства серной и азотной кислот
Окислительные свойства серной и азотной кислот Эмульсии. Классификация эмульсий. Механизм образования и стабилизации эмульсий. Эмульгаторы
Эмульсии. Классификация эмульсий. Механизм образования и стабилизации эмульсий. Эмульгаторы