Содержание
- 2. Предмет та завдання аналітичної хімії Аналітична хімія – це наука про принципи, методи та засоби визначення
- 3. Завдання аналітичної хімії: Створення та удосконалення методів аналізу Визначення меж їх застосування Оцінка метрологічних та інших
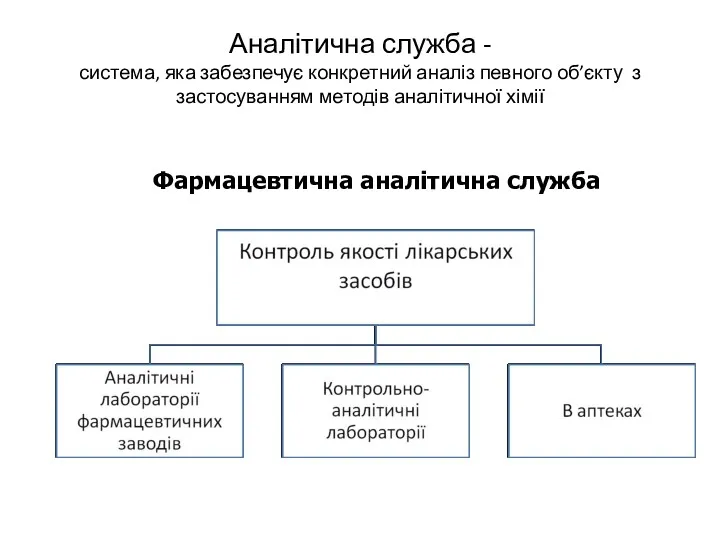
- 4. Аналітична служба - система, яка забезпечує конкретний аналіз певного об’єкту з застосуванням методів аналітичної хімії Фармацевтична
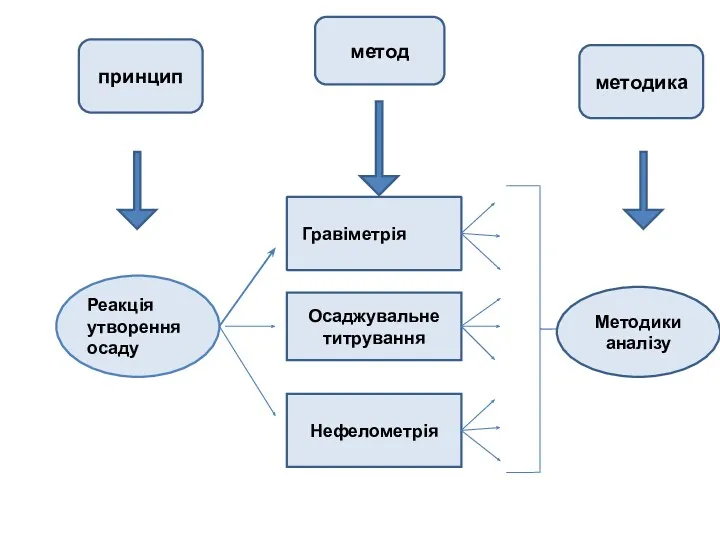
- 5. Принцип, метод та методика аналізу
- 6. Реакція утворення осаду Гравіметрія Осаджувальне титрування Нефелометрія Методики аналізу принцип метод методика
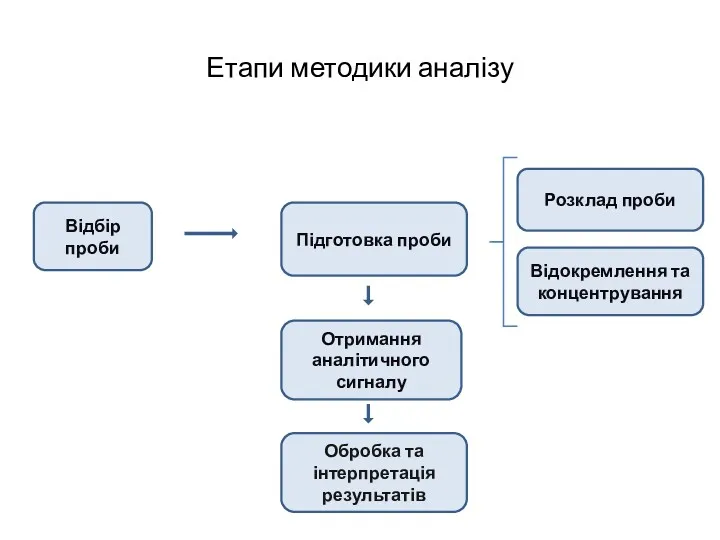
- 7. Етапи методики аналізу Відбір проби Підготовка проби Розклад проби Відокремлення та концентрування Отримання аналітичного сигналу Обробка
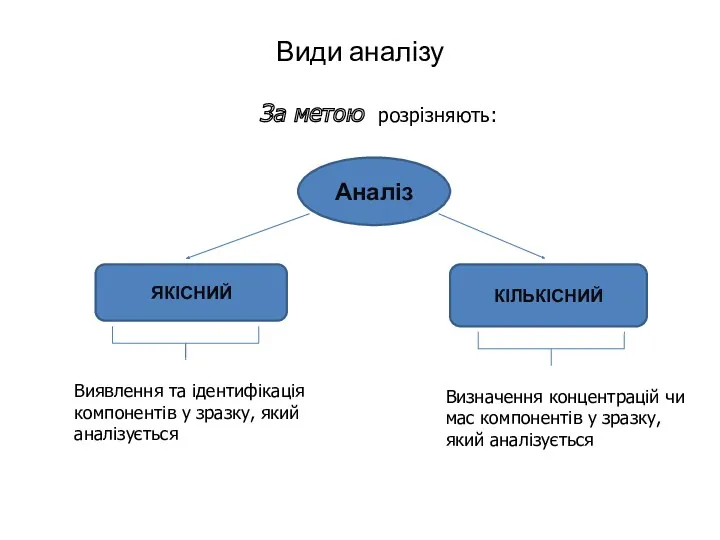
- 8. Види аналізу За метою розрізняють: Аналіз ЯКІСНИЙ КІЛЬКІСНИЙ Виявлення та ідентифікація компонентів у зразку, який аналізується
- 9. Види аналізу За компонентами: Ізотопний Елементний Функціональний Молекулярний Фазовий За масою чи об'ємом проби, що аналізують:
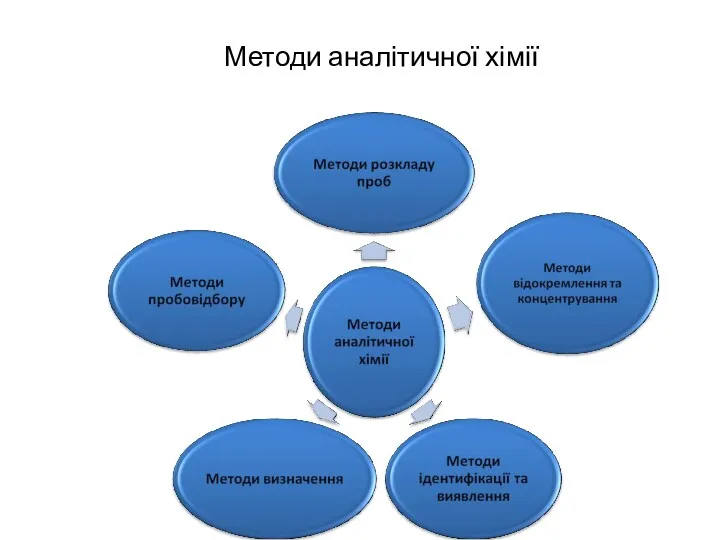
- 10. Методи аналітичної хімії
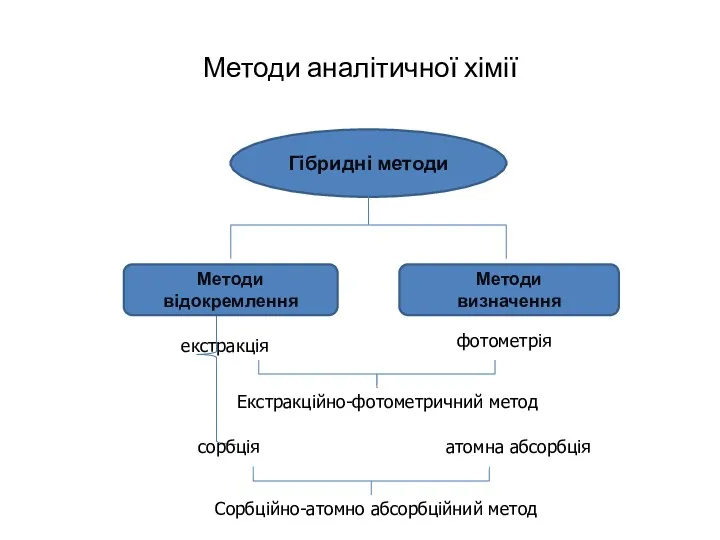
- 11. Методи аналітичної хімії Гібридні методи Методи відокремлення Методи визначення екстракція фотометрія Екстракційно-фотометричний метод сорбція атомна абсорбція
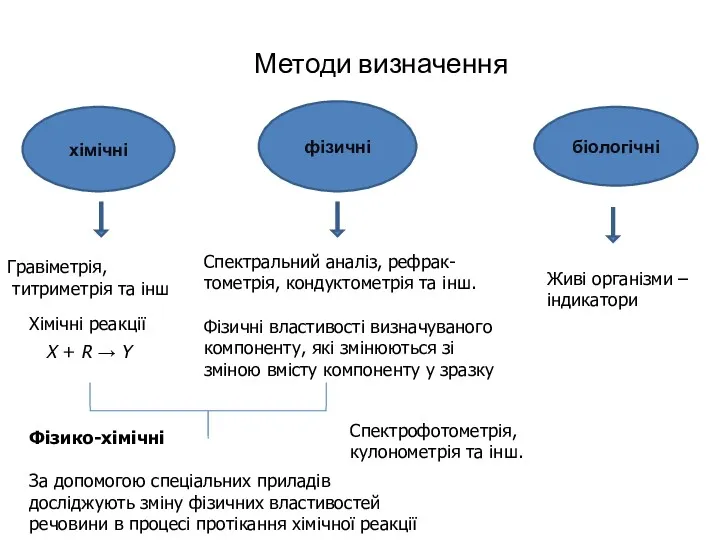
- 12. Методи визначення хімічні фізичні біологічні Хімічні реакції Спектральний аналіз, рефрак-тометрія, кондуктометрія та інш. Фізичні властивості визначуваного
- 13. «аналітичні властивості речовин» - певні хімічні властивості, або фізичні властивості, або фізико-хімічні властивості, що використовуються в
- 14. Аналітична реакція – це хімічне перетворення аналізованої речовини при дії аналітичного реагенту з утворенням продуктів з
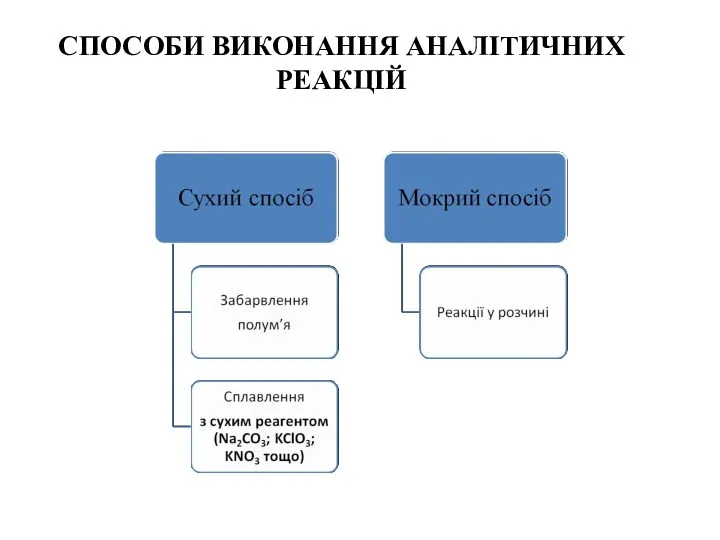
- 15. СПОСОБИ ВИКОНАННЯ АНАЛІТИЧНИХ РЕАКЦІЙ
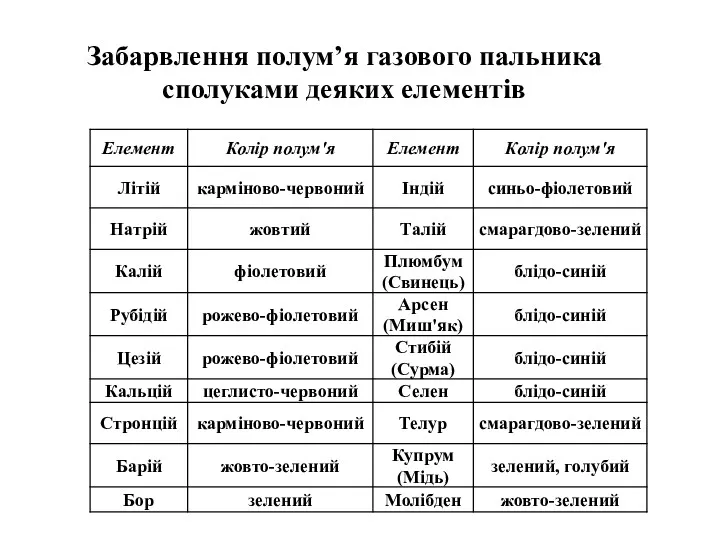
- 16. Забарвлення полум’я газового пальника сполуками деяких елементів
- 17. Групові реакції та характерні реакції. Специфічні та неспецифічні (селективні) реакції. Групові -аналітичні реакції певного реактиву з
- 18. Чутливість аналітичних реакцій: межа визначення, граничне розведення, відкриваний мінімум (мінімум, що відкривається), Межа визначення ― найменший
- 19. Реакції і процеси, які використовують в аналізі Аналітичні реакції Х + R → Y вимоги до
- 20. Реакції і процеси, які використовують в аналізі В хімічних методах аналізу переважно застосовують реакції трьох типів:
- 21. Систематичний та дробний аналіз Систематичним аналізом називають аналіз досліджуваної суміші іонів невизначеного складу шляхом розділення їх
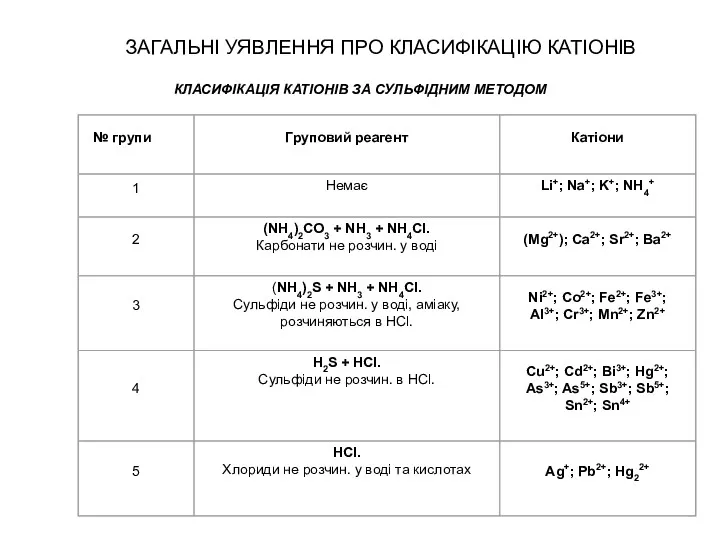
- 22. ЗАГАЛЬНІ УЯВЛЕННЯ ПРО КЛАСИФІКАЦІЮ КАТІОНІВ КЛАСИФІКАЦІЯ КАТІОНІВ ЗА СУЛЬФІДНИМ МЕТОДОМ
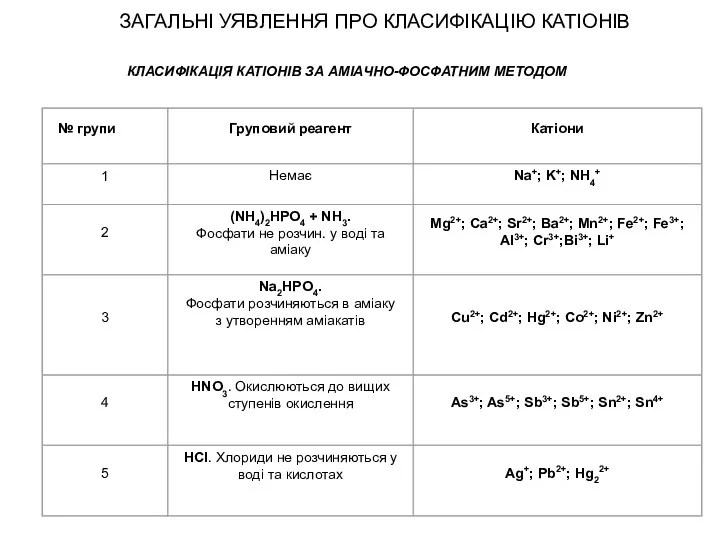
- 23. ЗАГАЛЬНІ УЯВЛЕННЯ ПРО КЛАСИФІКАЦІЮ КАТІОНІВ КЛАСИФІКАЦІЯ КАТІОНІВ ЗА АМІАЧНО-ФОСФАТНИМ МЕТОДОМ
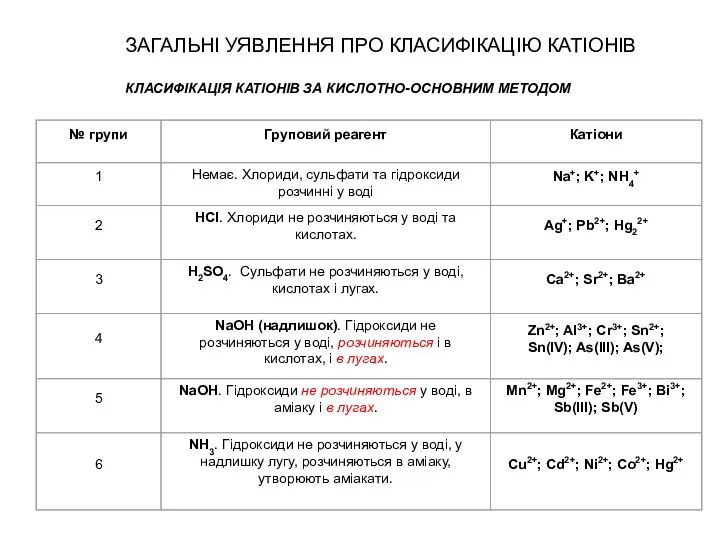
- 24. ЗАГАЛЬНІ УЯВЛЕННЯ ПРО КЛАСИФІКАЦІЮ КАТІОНІВ КЛАСИФІКАЦІЯ КАТІОНІВ ЗА КИСЛОТНО-ОСНОВНИМ МЕТОДОМ
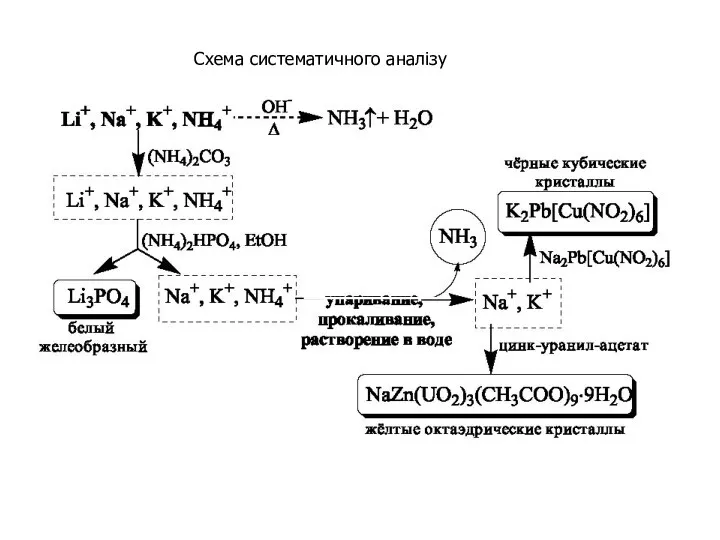
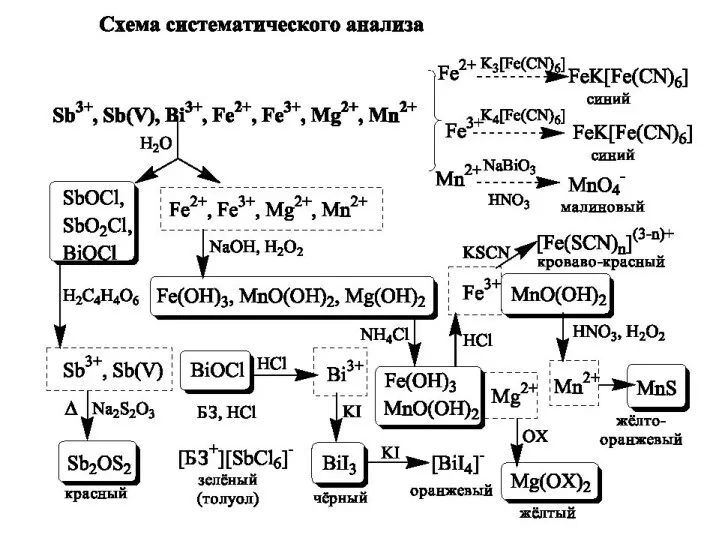
- 25. Схема систематичного аналізу
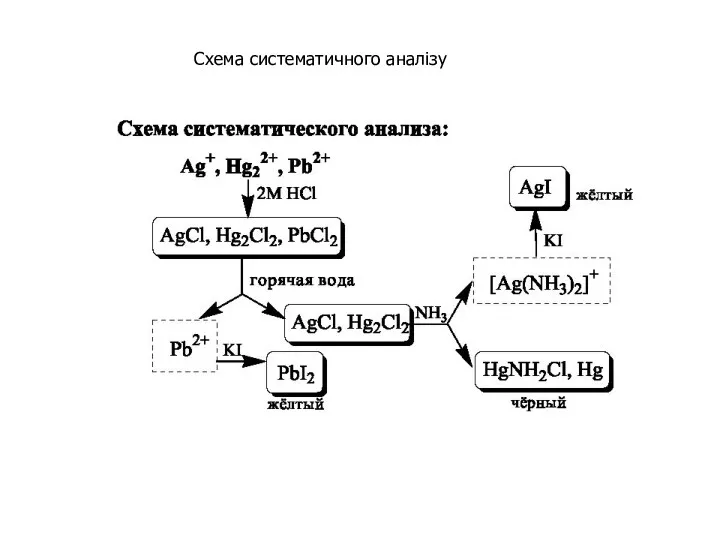
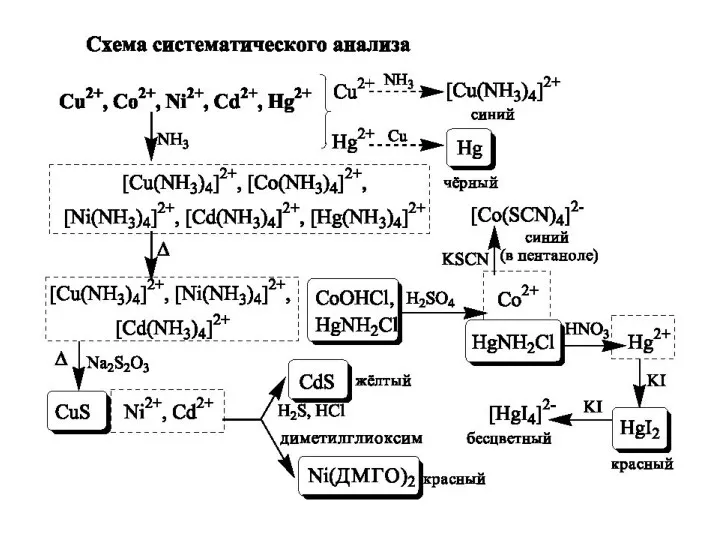
- 26. Схема систематичного аналізу
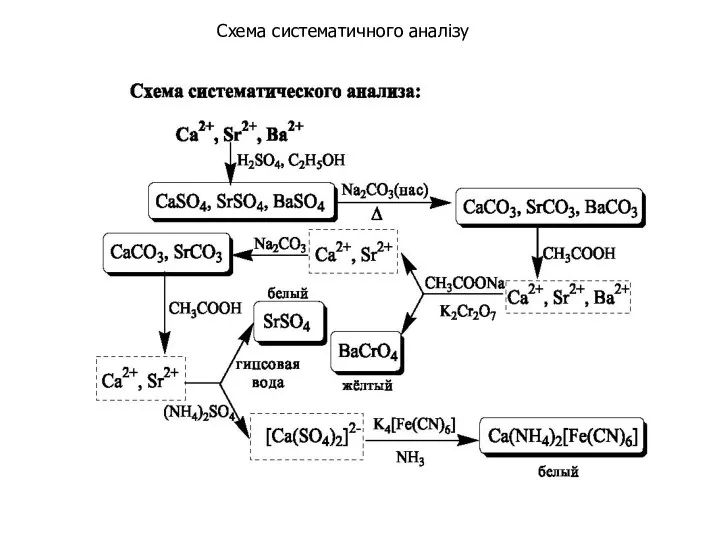
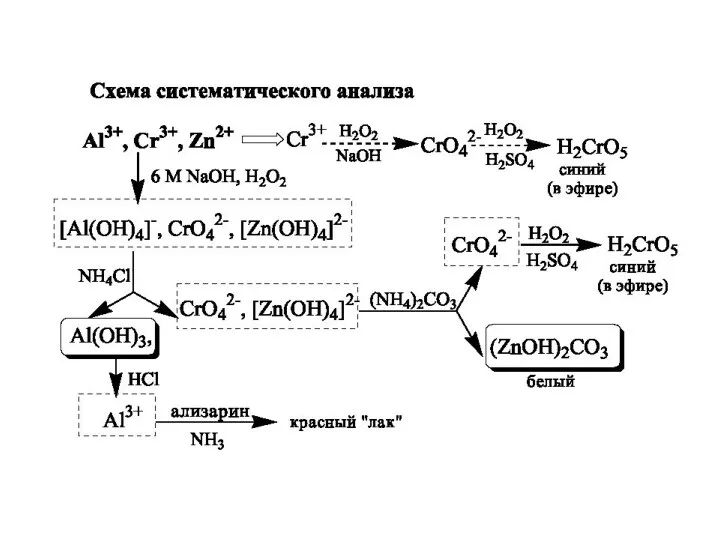
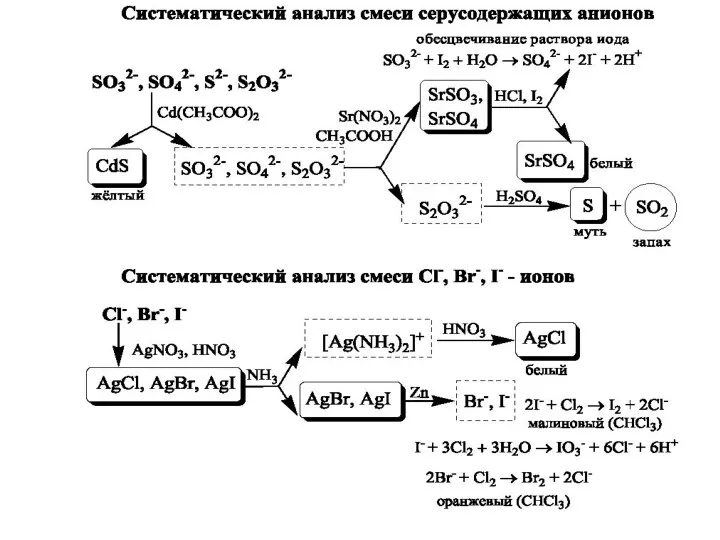
- 27. Схема систематичного аналізу
- 31. Класифікація аніонів За окисно-відновними властивостями - аніони-окисники, що проявляють окислювальні властивості, (у них елемент має вищий
- 32. Класифікація аніонів 2. За здатністю утворювати не розчинні у воді солі барію та срібла : Перша
- 35. Скачать презентацию













 Биогенді (s.p.d) элементтермен олардың қосылыстарының медициналық және биологиялық маңызы
Биогенді (s.p.d) элементтермен олардың қосылыстарының медициналық және биологиялық маңызы Кислоты, их состав и названия
Кислоты, их состав и названия Карбоновые кислоты и их функциональные производные
Карбоновые кислоты и их функциональные производные Ароматические углеводороды
Ароматические углеводороды Гетерофазный катализ. (Лекция 20)
Гетерофазный катализ. (Лекция 20) Горение топлива
Горение топлива Використання радіоактивних ізотопів, як індикаторів у тваринництві і археології
Використання радіоактивних ізотопів, як індикаторів у тваринництві і археології Основные классы неорганических соединений
Основные классы неорганических соединений Соли, их классификация и свойства
Соли, их классификация и свойства Органічна хімія
Органічна хімія Розв’язування задач за рівняннями реакцій з використанням розчинів із певною масовою часткою розчиненої речовини. Урок 13-14
Розв’язування задач за рівняннями реакцій з використанням розчинів із певною масовою часткою розчиненої речовини. Урок 13-14 Жёсткость воды
Жёсткость воды Полисахариды: крахмал и целлюлоза
Полисахариды: крахмал и целлюлоза Растворы. Часть 2. Лекция №7
Растворы. Часть 2. Лекция №7 Химия атмосферы. Химические процессы в тропосфере
Химия атмосферы. Химические процессы в тропосфере Буферные системы
Буферные системы Белки. Строение
Белки. Строение Классификация химических элементов. Составитель. 8 класс
Классификация химических элементов. Составитель. 8 класс Минералы для ИЗБ
Минералы для ИЗБ Концентрация растворов. Массовая доля растворенного вещества. Урок 1
Концентрация растворов. Массовая доля растворенного вещества. Урок 1 Химический элемент медь
Химический элемент медь Кинетика химических реакций
Кинетика химических реакций Кремний и его соединения
Кремний и его соединения Галогены. Расположите галогены в порядке их открытия
Галогены. Расположите галогены в порядке их открытия Важнейшие реакции в органической химии
Важнейшие реакции в органической химии Технология производства аминоальдегидных смол
Технология производства аминоальдегидных смол Углерод. Физические и химические свойства
Углерод. Физические и химические свойства Гидролиз солей
Гидролиз солей