Содержание
- 2. Физические свойства: дымится на воздухе с едким запахом кипит при температуре 860С, а при -410С превращается
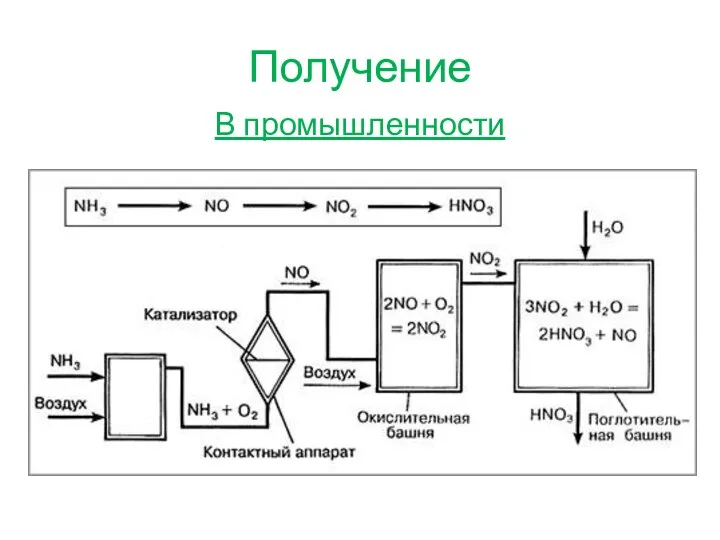
- 3. Получение В промышленности
- 4. В лаборатории Из калийной или натриевой селитры KNO3(тв.) + H2SO4(kонц.) → HNO3 + KHSO4 2KNO3(тв.) +
- 5. Специфические химические свойства 1) Разложение (при комнатной температуре). 4HNO3 → 2H2O + 4NO2 + O2↑ 2)
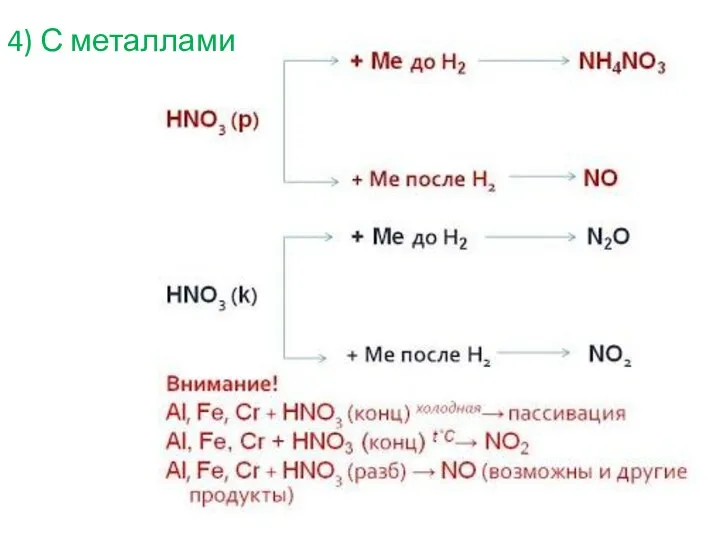
- 6. 4) С металлами
- 8. Соли азотной кислоты в природе: KNO3 – нитрат калия (индийская селитра) NаNО3 – нитрат натрия (чилийская
- 9. Специфическое химическое свойство – термическое разложение 1) Нитраты металлов левее Mg (исключение - нитрат лития) до
- 11. Скачать презентацию






 Химические свойства металлов
Химические свойства металлов Молекулярно-кинетические свойства дисперсных систем
Молекулярно-кинетические свойства дисперсных систем Теория строения органических веществ. Предельные углеводороды. 9 класс
Теория строения органических веществ. Предельные углеводороды. 9 класс Межмолекулярные силы (силы Ван дер Ваальса)
Межмолекулярные силы (силы Ван дер Ваальса) Заттардың агрегаттық күйі
Заттардың агрегаттық күйі Objectives and background. Apply for an unknown mixture
Objectives and background. Apply for an unknown mixture Классификация органических реакций
Классификация органических реакций Арени. Бензен: молекулярна і структурна формули, фізичні властивості
Арени. Бензен: молекулярна і структурна формули, фізичні властивості Історія хімії
Історія хімії F элементы
F элементы Аммиак: состав вещества, получение, применение, строение, свойства
Аммиак: состав вещества, получение, применение, строение, свойства Обобщающий урок по теме Металлы
Обобщающий урок по теме Металлы Изучение состава чая
Изучение состава чая Содержание кислорода и углекислого газа в помещениях школы
Содержание кислорода и углекислого газа в помещениях школы Ковалентний зв’язок. Донорно - акцепторний механізм утворення ковалентного зв'язку
Ковалентний зв’язок. Донорно - акцепторний механізм утворення ковалентного зв'язку Реакции ионного обмена между растворами электролитов
Реакции ионного обмена между растворами электролитов Химическое загрязнение атмосферы
Химическое загрязнение атмосферы Разработка проектных решений по переводу паровых котлов электростанций в конденсационный режим с целью увеличения кпд котла
Разработка проектных решений по переводу паровых котлов электростанций в конденсационный режим с целью увеличения кпд котла Физико-химия дисперсных систем. Физико-химия поверхностных явлений
Физико-химия дисперсных систем. Физико-химия поверхностных явлений Золото и серебро
Золото и серебро Карбоновые кислоты и их функциональные производные
Карбоновые кислоты и их функциональные производные Бензол. Физические и химические свойства
Бензол. Физические и химические свойства Металлы – простые вещества
Металлы – простые вещества 20230416_urok_na_20.02.2023
20230416_urok_na_20.02.2023 Химические реакции. (8 класс)
Химические реакции. (8 класс) Основания. Состав, классификация, свойства, получение
Основания. Состав, классификация, свойства, получение Виды присадок к моторным топливам. Бензин
Виды присадок к моторным топливам. Бензин Теоретические основы и технология первичной переработки нефти. Тема 4
Теоретические основы и технология первичной переработки нефти. Тема 4