Содержание
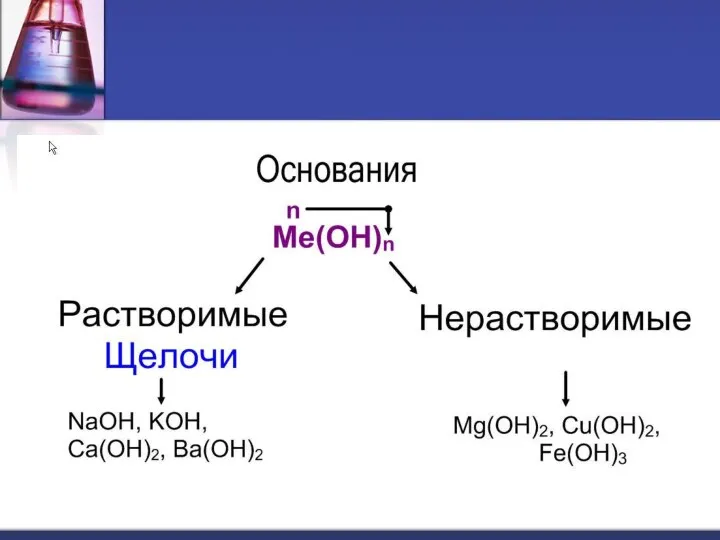
- 3. Основания – сложные вещества, состоящие из атомов металла, соединенных с одной или несколькими гидроксогруппами. ОН –
- 5. Щелочи образуют металлы, стоящие в IA и IIA группах (кроме Be и Mg) Периодической таблицы химических
- 6. Нерастворимые в воде основания образованы остальными металлами, которым соответствуют основные и амфотерные оксиды. Это твердые вещества,
- 7. Получение оснований Растворимых (щелочей) 1. Активный металл + вода = щелочь + водород 2Na + 2H2O
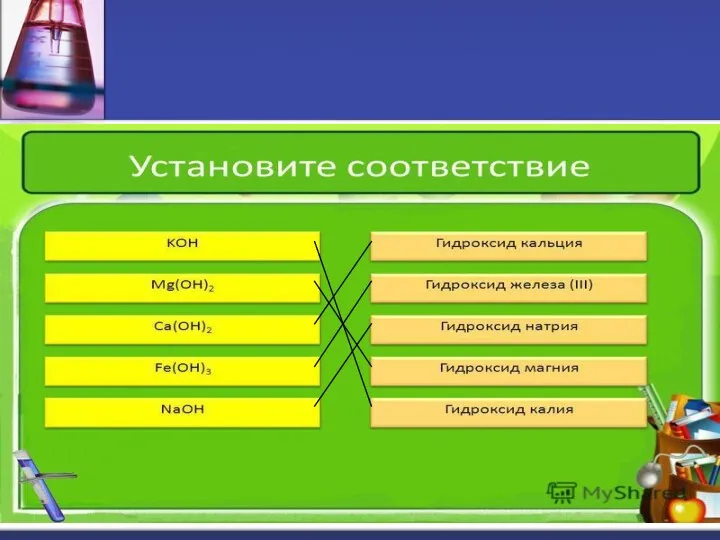
- 9. Напишите формулы оснований: а) гидроксид калия б) гидроксид марганца(II) в) гидроксид кальция г) гидроксид алюминия д)
- 10. Химические свойства
- 11. Реакция между двумя сложными веществами при которой они обмениваются своими составными частями называется реакцией обмена. Реакция
- 12. Химические свойства
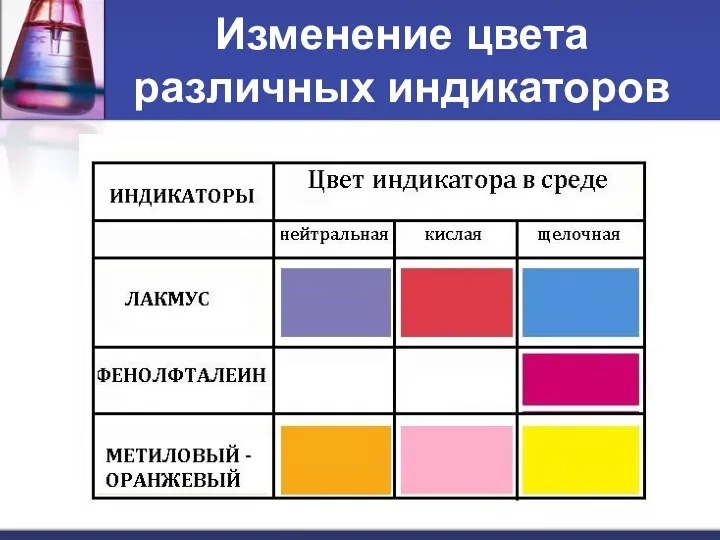
- 13. Изменение цвета различных индикаторов
- 14. Задание 1. Напишите уравнения реакций оснований с кислотами LiOH + H3PO4 → Ba(OH)2 + HNO3 →
- 15. Задача Напишите уравнение реакции разложения гидроксида меди (II). Определите: а) массу оксида меди (II), который образуется
- 17. Скачать презентацию










 Дослідження якісного складу солей. Практична робота №1
Дослідження якісного складу солей. Практична робота №1 Арены. Бензол. Урок химии. 10 класс
Арены. Бензол. Урок химии. 10 класс Зелёная химия
Зелёная химия Кислородсодержащие органические соединения. Спирты
Кислородсодержащие органические соединения. Спирты Көпатомды спирттер. Химиялық қасиеттері
Көпатомды спирттер. Химиялық қасиеттері Свойства органических соединений
Свойства органических соединений Коллигативные свойства растворов
Коллигативные свойства растворов Драгоценные камни
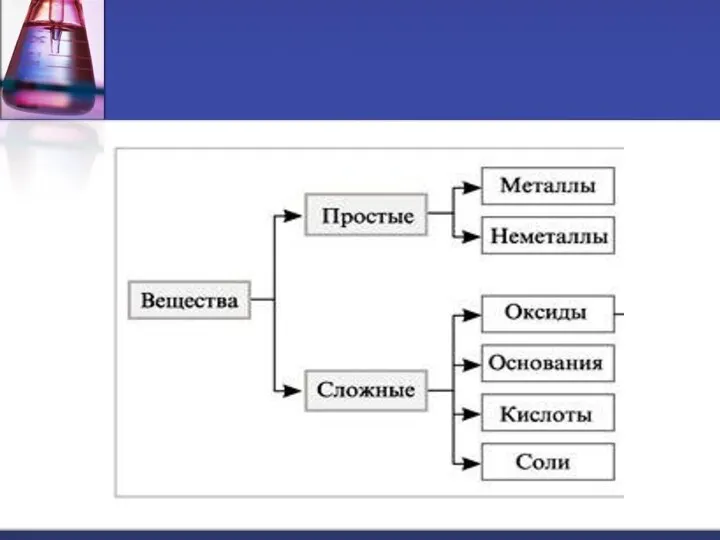
Драгоценные камни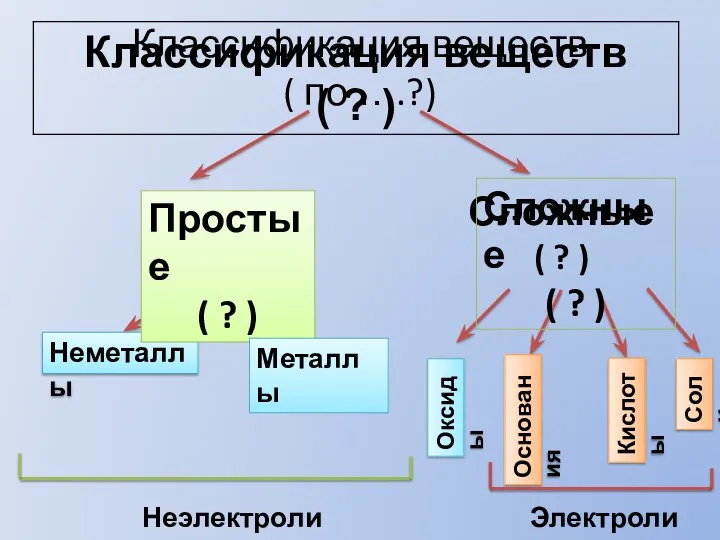 Классификация веществ
Классификация веществ Титриметрический анализ
Титриметрический анализ Минералды тыңайтқыштар өндірісі
Минералды тыңайтқыштар өндірісі Білки як високомолекулярні сполуки
Білки як високомолекулярні сполуки Аминокилоты. Свойства
Аминокилоты. Свойства Синтетические моющие средства
Синтетические моющие средства Закономерности химических реакций. (Лекция 3)
Закономерности химических реакций. (Лекция 3) Вода на Земле. Строение молекулы воды
Вода на Земле. Строение молекулы воды Адсорбция. Механизм адсорбции
Адсорбция. Механизм адсорбции Относительная молекулярная масса вещества. Задачи
Относительная молекулярная масса вещества. Задачи Основные понятия и законы химии
Основные понятия и законы химии Оксиды. Классификация. Химические и физические свойства
Оксиды. Классификация. Химические и физические свойства Амины. Понятие об аминах. Анилин как органическое основание
Амины. Понятие об аминах. Анилин как органическое основание Кислородсодержащие соединения азота
Кислородсодержащие соединения азота Арены
Арены Липиды (Жиры)
Липиды (Жиры) Водород. Общая характеристика, получение, свойства
Водород. Общая характеристика, получение, свойства Ұшқыш уларды оқшаулауды теориялық негіздеу
Ұшқыш уларды оқшаулауды теориялық негіздеу Капиллярная конденсация
Капиллярная конденсация Количественное определение лекарственных веществ
Количественное определение лекарственных веществ