Содержание
- 2. Что изучает химия? Химия – это наука о веществах, их составе, строении, свойствах и превращениях. Вещество
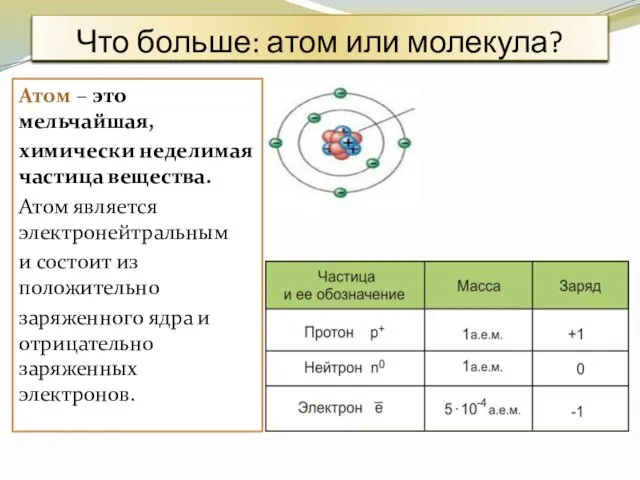
- 3. Что больше: атом или молекула? Атом – это мельчайшая, химически неделимая частица вещества. Атом является электронейтральным
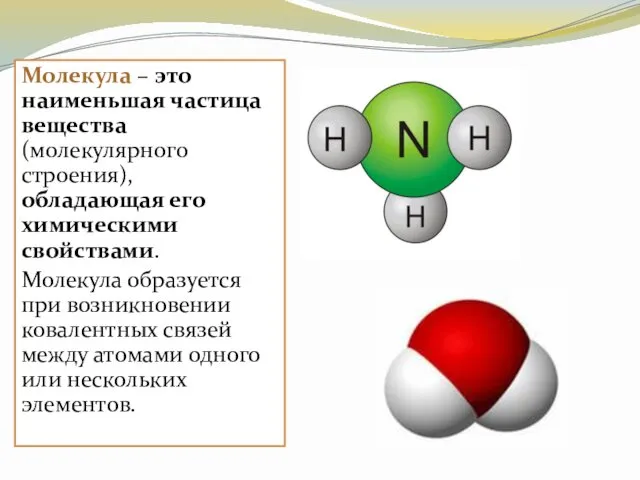
- 4. Молекула – это наименьшая частица вещества (молекулярного строения), обладающая его химическими свойствами. Молекула образуется при возникновении
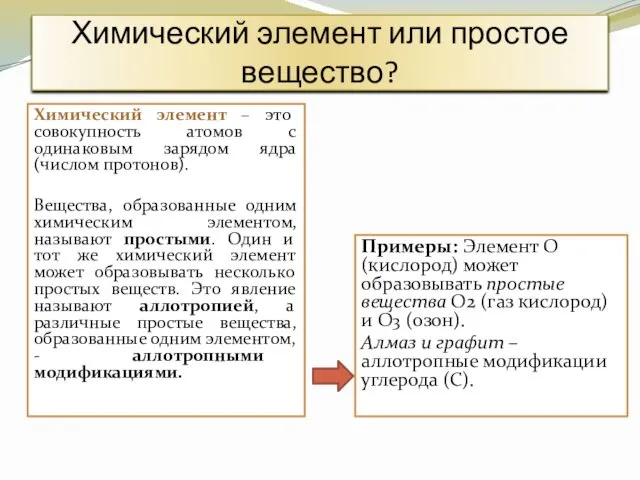
- 5. Химический элемент или простое вещество? Химический элемент – это совокупность атомов с одинаковым зарядом ядра (числом
- 6. Для измерения атомных масс применяют атомную единицу массы (а. е. м.). Атомная единица массы – это
- 7. Почему атомная масса – не целое число? Изотопы - разновидности атомов определенного химического элемента, имеющие одинаковый
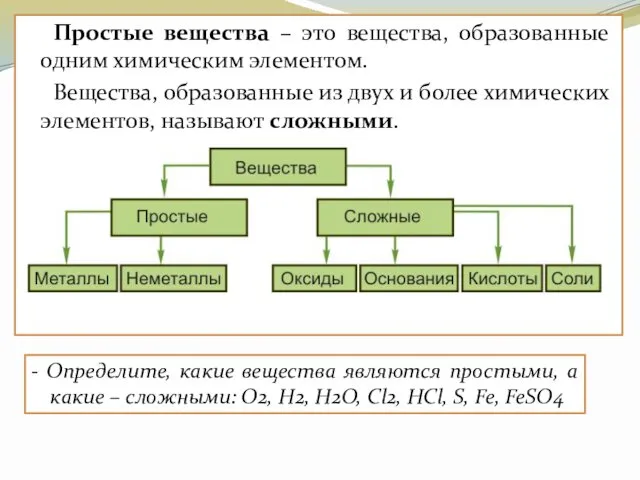
- 8. Простые вещества – это вещества, образованные одним химическим элементом. Вещества, образованные из двух и более химических
- 10. Пример: Al2O3 индексы, показывающие количество атомов алюминия и кислорода Качественный состав – это совокупность химических элементов
- 11. Закон постоянства состава вещества Сформулирован Ж.-Л. Прустом в 1799 г.: Всякое чистое вещество независимо от способа
- 12. Состав веществ отображают посредством химической символики. По предложению Й. Я. Берцелиуса элементы принято обозначать первой или
- 13. Химические формулы Химическая формула – это способ отображения химического состава вещества. Она обозначает название вещества, одну
- 14. Формулы вещества составляют на основании важнейшего понятия в химии – валентности. Валентность – это способность атомов
- 15. Составьте формулы веществ: Оксида натрия Хлорида железа (III) Оксида углерода (IV) I II NaO → Na2O
- 16. Как определить массу молекулы? Относительная молекулярная масса ( ) равна сумме относительных атомных масс всех атомов,
- 17. Сколько кислорода в молекуле воды? Массовая доля элемента в веществе - ώ (омега) – это отношение
- 18. Химические реакции - Это явления, в результате которых из одних веществ образуются другие. Происходят ли изменения
- 19. Химическим уравнением называют запись химической реакции посредством химических знаков и формул. Уравнение реакции составляют на основе
- 20. Типы химических реакций 1) Соединение: Н2 + О2 → Н2О 2Н2 + О2 → 2Н2О 2)
- 21. Что такое количество вещества? По химическим уравнениям можно вести расчеты. Для этого нужно знать такие понятия
- 23. Один моль любого газа при одинаковых условиях занимает один и тот же объем. Этот объем, называемый
- 25. Был сформулирован в 1811 году итальянским физиком Амедео Авогадро (1776—1856) Закон основан на том факте, что
- 26. 1.Какое количество вещества (моль) содержит 12,04·10²³ атомов натрия? ν(Na) = N/NА = 12,04·10²³ / 6,02·10²³ =
- 28. Скачать презентацию





















 СОҢҒЫ СТ ДАЙЫНДЫҚ!
СОҢҒЫ СТ ДАЙЫНДЫҚ! Тепловий ефект хімічних реакцій. Екзотермічні і ендотермічні реакції. Термохімічні рівняння
Тепловий ефект хімічних реакцій. Екзотермічні і ендотермічні реакції. Термохімічні рівняння Алюминий и его соединения
Алюминий и его соединения Строение атома. Тема 2
Строение атома. Тема 2 Бензол молекуласында байланыстардың түзілу сызбанұсқасы
Бензол молекуласында байланыстардың түзілу сызбанұсқасы Классификация органических соединений. Тема 8
Классификация органических соединений. Тема 8 Химия и обмен углеводов. Функции углеводов
Химия и обмен углеводов. Функции углеводов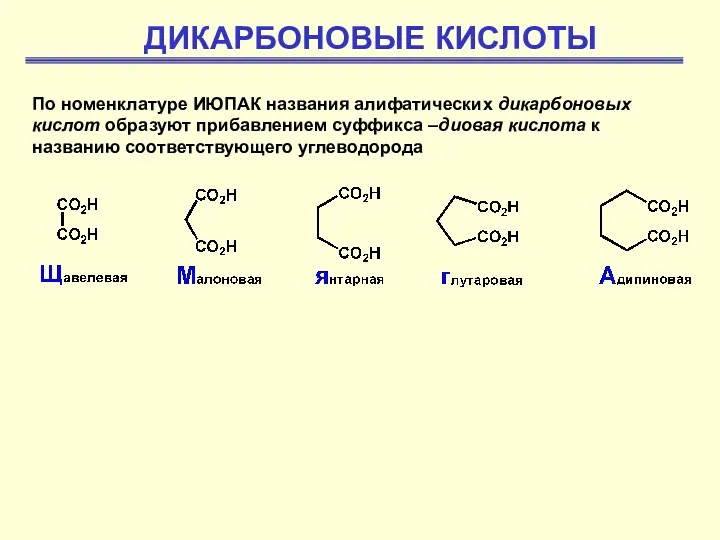 Дикарбоновые кислоты
Дикарбоновые кислоты Функціональні похідні аліфатичних вуглеводнів галогенопохідні вуглеводнів
Функціональні похідні аліфатичних вуглеводнів галогенопохідні вуглеводнів Қоспаларды бөлу әдістері
Қоспаларды бөлу әдістері Углерод
Углерод Органическая химия
Органическая химия Амины. Номенклатура аминов
Амины. Номенклатура аминов Химическая промышленность Донецкой области
Химическая промышленность Донецкой области Основные понятия, классификация, структура и свойства полимеров. (Лекция 1)
Основные понятия, классификация, структура и свойства полимеров. (Лекция 1) Установка изомеризации пентан гексановой фракции
Установка изомеризации пентан гексановой фракции Химия нефти и газа
Химия нефти и газа Галогенопроизводные углеводородов (3)
Галогенопроизводные углеводородов (3) Методические рекомендации по изучению курса Коррозия и защита металлов
Методические рекомендации по изучению курса Коррозия и защита металлов Основные физико-химические свойства нефтей и нефтепродуктов
Основные физико-химические свойства нефтей и нефтепродуктов Соли, их классификация и свойства
Соли, их классификация и свойства Теория электролитической диссоциации
Теория электролитической диссоциации 5511c750430548bfa1da4ba840324bb2
5511c750430548bfa1da4ba840324bb2 Основные понятия органической химии
Основные понятия органической химии Химия и пища». «Белок – основа жизни
Химия и пища». «Белок – основа жизни Массовая доля элемента в сложном веществе
Массовая доля элемента в сложном веществе Органикалық қосылыстар құрылысының теориялық негіздері және олардың реакцияға қабілеттілігін анықтаушы факторлар
Органикалық қосылыстар құрылысының теориялық негіздері және олардың реакцияға қабілеттілігін анықтаушы факторлар Галогены. Историческая справка
Галогены. Историческая справка