Слайд 2

Металл + кислота = «горючий воздух»
1766 г. Генри Кавендиш (Англия)
1784 г.
А. Лавуазье
(Франция)
Hedrogenium
водород
рождающий воду
Слайд 3

Положение в ПС
Химический знак – Н
Порядковый № 1
Изотопы
протий 11Н
дейтерий 12Н =
D
тритий 13Н = Т
Малая электроотрицательность – сходство со ЩМ
Простое вещество Н2 – сходство с галогенами
Слайд 4

Водород в природе
Содержание в земной коре 0,15% по массе (с учетом
гидросферы 1%) – девятый по распространенности
Доля атомов 17% второй после кислорода (52%)
Основной элемент Вселенной – половина массы Солнца
Простое вещество в атмосфере Земли не встречается
Слайд 5

Получение
Н2О = Н2 + О2
Zn + HCl = ZnCl2 + H2
Mg
+ H2SO4 = MgSO4 + H2
Na + H2O = NaOH + H2
Ca + H2O = Ca(OH)2 + H2
СН4 = С + Н2 (10000С)
Слайд 6

Свойства водорода
Физические свойства
газ без цвета, без запаха, без вкуса
в 14,5 раз
легче воздуха
Тк = - 252,8 0С
мало растворим в воде
Слайд 7

Химические свойства
Окислитель
Взаимодействует с металлами (щелочными и щелочноземельными)
Н2 + Na = NaH
H2
+ Ca = CaH2 (гидриды)
Восстановитель
Взаимодействует в неметаллами (кроме As, Р, Si, В)
Н2 + О2 = Н2О "Гремучий газ» : V(H2):V(O2) = 2:1
Н2 + Cl2 = HCl
H2 + N2 = NH3
Взаимодействует с оксидами металлов
H2 + CuO = Cu + H2O
H2 + WO3 = W + H2O






 СОҢҒЫ СТ ДАЙЫНДЫҚ!
СОҢҒЫ СТ ДАЙЫНДЫҚ! Тепловий ефект хімічних реакцій. Екзотермічні і ендотермічні реакції. Термохімічні рівняння
Тепловий ефект хімічних реакцій. Екзотермічні і ендотермічні реакції. Термохімічні рівняння Алюминий и его соединения
Алюминий и его соединения Строение атома. Тема 2
Строение атома. Тема 2 Бензол молекуласында байланыстардың түзілу сызбанұсқасы
Бензол молекуласында байланыстардың түзілу сызбанұсқасы Классификация органических соединений. Тема 8
Классификация органических соединений. Тема 8 Химия и обмен углеводов. Функции углеводов
Химия и обмен углеводов. Функции углеводов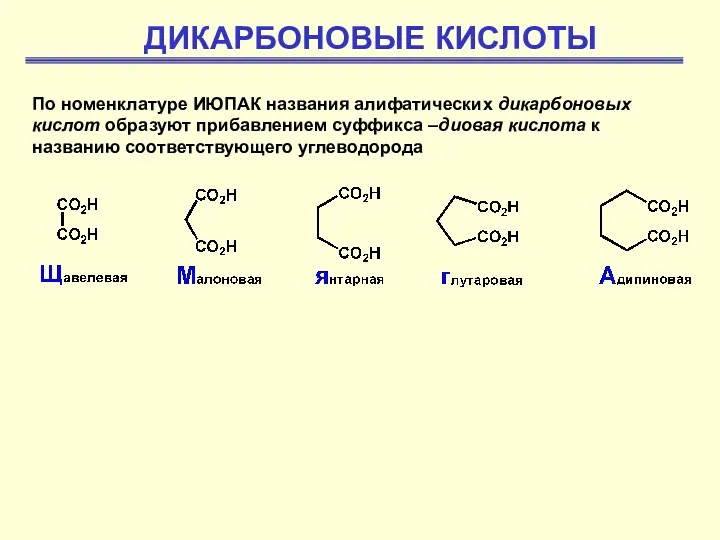 Дикарбоновые кислоты
Дикарбоновые кислоты Функціональні похідні аліфатичних вуглеводнів галогенопохідні вуглеводнів
Функціональні похідні аліфатичних вуглеводнів галогенопохідні вуглеводнів Қоспаларды бөлу әдістері
Қоспаларды бөлу әдістері Углерод
Углерод Органическая химия
Органическая химия Амины. Номенклатура аминов
Амины. Номенклатура аминов Химическая промышленность Донецкой области
Химическая промышленность Донецкой области Основные понятия, классификация, структура и свойства полимеров. (Лекция 1)
Основные понятия, классификация, структура и свойства полимеров. (Лекция 1) Установка изомеризации пентан гексановой фракции
Установка изомеризации пентан гексановой фракции Химия нефти и газа
Химия нефти и газа Галогенопроизводные углеводородов (3)
Галогенопроизводные углеводородов (3) Методические рекомендации по изучению курса Коррозия и защита металлов
Методические рекомендации по изучению курса Коррозия и защита металлов Основные физико-химические свойства нефтей и нефтепродуктов
Основные физико-химические свойства нефтей и нефтепродуктов Соли, их классификация и свойства
Соли, их классификация и свойства Теория электролитической диссоциации
Теория электролитической диссоциации 5511c750430548bfa1da4ba840324bb2
5511c750430548bfa1da4ba840324bb2 Основные понятия органической химии
Основные понятия органической химии Химия и пища». «Белок – основа жизни
Химия и пища». «Белок – основа жизни Массовая доля элемента в сложном веществе
Массовая доля элемента в сложном веществе Органикалық қосылыстар құрылысының теориялық негіздері және олардың реакцияға қабілеттілігін анықтаушы факторлар
Органикалық қосылыстар құрылысының теориялық негіздері және олардың реакцияға қабілеттілігін анықтаушы факторлар Галогены. Историческая справка
Галогены. Историческая справка