Содержание
- 3. 1. Металлы реагируют с неметаллами. Наиболее энергично с кислородом, хлором, серой (галогенами). Горение магния.
- 4. 2Al0 + 3I20 = 2Al+3 I3- 3Ca0 + 2P0 = Ca3+2 P2-3
- 5. а) Щелочные металлы и щелочноземельные Ca и Ba c водой образуют гидроксиды соответствующих металлов и водород!
- 6. б) Mg, Al, Mn, Zn, Cr, Fe, Ni, Pb с водой реагируют при нагревании с образованием
- 7. 3. Металлы способны реагировать с кислотами. Взаимодействие соляной кислоты с магнием, цинком, железом, медью. Mg0 +
- 8. Если металл способен проявлять несколько степеней окисления, то при взаимодействии со слабым окислителем образуется соль, в
- 9. Проблемный вопрос: Дан натрий и раствор соляной кислоты. Как будет протекать реакция между этими двумя веществами.
- 11. 4.Металлы взаимодействуют с растворами солей. Взаимодействие 1) Fe; Al; Pb с раствором CuSO4 2) Fe; Zn;
- 12. Данные факты позволяют сделать вывод, что металлы обладают различной восстановительной способностью.
- 13. Этот ряд называют электрохимическим рядом расположения металлов. Li K Ca Na Mg Al Zn Cr Fe
- 15. Скачать презентацию
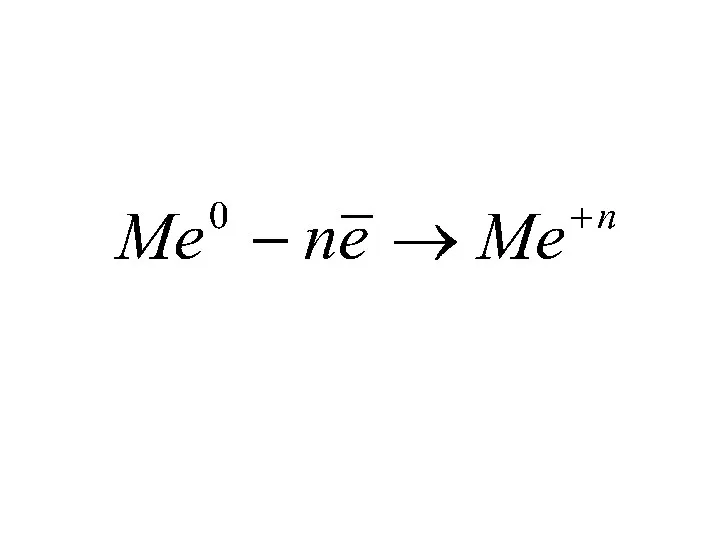

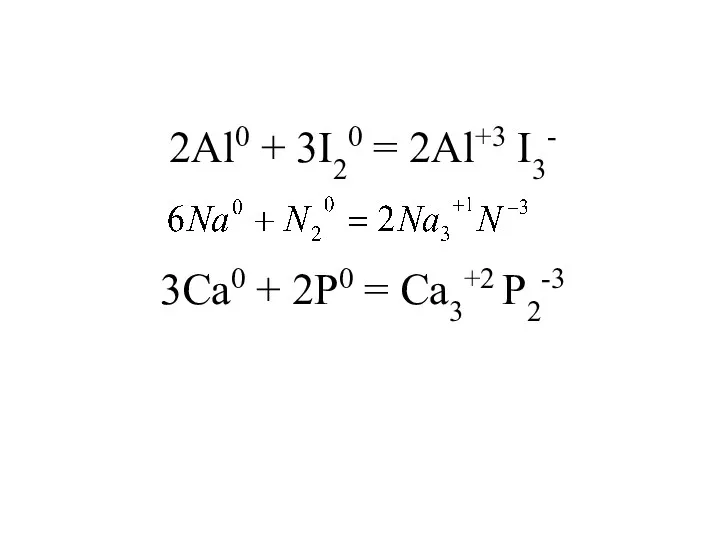





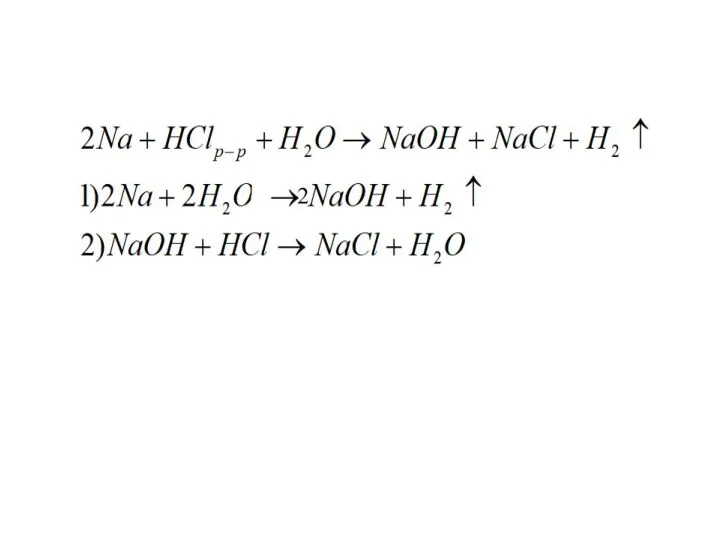



 Металлы. Общая характеристика
Металлы. Общая характеристика Классификация минералов
Классификация минералов Набор № 3 ВС Щелочи
Набор № 3 ВС Щелочи 20230419_izomery
20230419_izomery Строение атома. Теории строения атома
Строение атома. Теории строения атома Адсорбция. Механизм адсорбции
Адсорбция. Механизм адсорбции Буферные растворы. Граф структуры. Теория электрической диссоциации. Химическое равновесие
Буферные растворы. Граф структуры. Теория электрической диссоциации. Химическое равновесие Изотопы. История открытия. Изотопы водорода
Изотопы. История открытия. Изотопы водорода Галогени. Хімічні властивості
Галогени. Хімічні властивості Научные основы и технологии зеленой химии
Научные основы и технологии зеленой химии Железо и его соединения
Железо и его соединения Основні принципи мас-спектрометрії
Основні принципи мас-спектрометрії Современные проблемы молекулярной биологии
Современные проблемы молекулярной биологии Висмут, ртуть, сурьма
Висмут, ртуть, сурьма Крахмал. Физические свойства
Крахмал. Физические свойства Вугдеводи. Моносахариди
Вугдеводи. Моносахариди Теории кислот и оснований. Буферные системы крови
Теории кислот и оснований. Буферные системы крови Cкорость химической реакции
Cкорость химической реакции Роль хімії в пізнанні природи
Роль хімії в пізнанні природи Ознайомлення зі зразками пластмас. Практична робота №4
Ознайомлення зі зразками пластмас. Практична робота №4 Приборы и методы исследования в химической технологии
Приборы и методы исследования в химической технологии Азотная кислота
Азотная кислота Взаємодія кисню зі складними та простими речовинами. Урок 31. 7 клас
Взаємодія кисню зі складними та простими речовинами. Урок 31. 7 клас Многоатомные спирты
Многоатомные спирты Кислород и озон
Кислород и озон Сущность процесса электролитической диссоциации
Сущность процесса электролитической диссоциации Қазақстанда химияны оқыту әдістемесінің даму тарихы
Қазақстанда химияны оқыту әдістемесінің даму тарихы Химическое вещество
Химическое вещество