Содержание
- 2. Строение атома железа. охарактеризует положение химического элемента железа в ПСХЭ Д. И. Менделеева и особенности строения
- 3. Нахождение в природе. Халькопирит с включениями кварца Приморский край Пирит
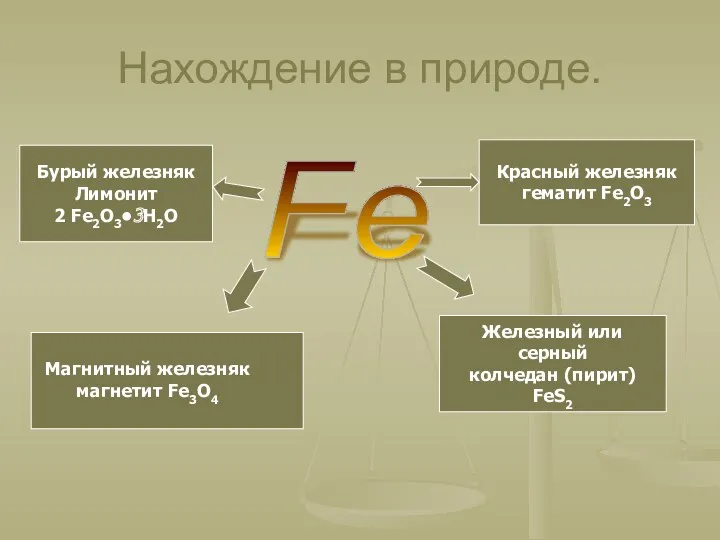
- 4. Нахождение в природе. Fe Магнитный железняк магнетит Fe3O4 Красный железняк гематит Fe2O3 Бурый железняк Лимонит 2
- 5. Физические свойства Железо - сравнительно мягкий ковкий серебристо-серый металл. Температура плавления – 1535 0С Температура кипения
- 6. Химические свойства железа 1. Железо реагирует с неметаллами: Fe + S = FeS При нагревании до
- 7. Химические свойства железа 2. Железо реагирует с кислотами. Fe+H2SO4=FeSO4+H2 В концентрированных азотной и серной кислотах железо
- 8. Химические свойства железа. 3. Реагирует с растворами солей металла согласно электрохимическому ряду напряжений металлов. Fe +
- 20. Биологическая роль железа Железо играет важную роль в жизнедеятельности живых организмов. Оно входит в состав гемоглобина
- 23. Скачать презентацию


















 Характеристика азота и фосфора. Свойства азота
Характеристика азота и фосфора. Свойства азота Тяжелые металлы
Тяжелые металлы Нітроген
Нітроген Неметаллы. Общая характеристика неметаллов
Неметаллы. Общая характеристика неметаллов Взрывчатые вещества, их история и применение
Взрывчатые вещества, их история и применение Присадки. Механизм действия присадок
Присадки. Механизм действия присадок Метанол, етанол та їхнє застосування
Метанол, етанол та їхнє застосування Хімічні властивості кислот
Хімічні властивості кислот Элементы кристаллохимии
Элементы кристаллохимии Химия 20 века
Химия 20 века Эндогенная серия. Альбитит-грейзеновая группа
Эндогенная серия. Альбитит-грейзеновая группа Лекция по химии
Лекция по химии Элементтер-органогендер. Көміртек – органикалық қосылыстардың негізін құраушы. Тірі және өлі табиғат арасындағы шекара
Элементтер-органогендер. Көміртек – органикалық қосылыстардың негізін құраушы. Тірі және өлі табиғат арасындағы шекара Сполуки фосфору
Сполуки фосфору Гомополисахариды (углеводы растений)
Гомополисахариды (углеводы растений) Цинк
Цинк Химическая кинетика
Химическая кинетика Атомы и молекулы. Простые и сложные вещества. 6 класс
Атомы и молекулы. Простые и сложные вещества. 6 класс Алюміній і сполуки алюмінію у побуті людини
Алюміній і сполуки алюмінію у побуті людини Алкадиены
Алкадиены Окислительно-восстановительные реакции в органической химии
Окислительно-восстановительные реакции в органической химии Химия в искусстве
Химия в искусстве Серная кислота H2SO4. 9 классы
Серная кислота H2SO4. 9 классы Товары бытовой химии
Товары бытовой химии Періодичний закон і періодична система хімічних елементів Д.І. Менделєєва. Будова атома
Періодичний закон і періодична система хімічних елементів Д.І. Менделєєва. Будова атома Металдар коррозиясы және онымен күресу шаралары
Металдар коррозиясы және онымен күресу шаралары Полистирол өндірісі
Полистирол өндірісі Искусственная радиоактивность. Ядерное оружие и его поражающие факторы
Искусственная радиоактивность. Ядерное оружие и его поражающие факторы