Содержание
- 2. Положение азота и фосфора в Периодической системе
- 3. «Характеристика азота и фосфора. Свойства азота.»
- 4. Пять знаменитых химиков XVIII в. дали некоему неметаллу, который в виде простого вещества представляет собой газ
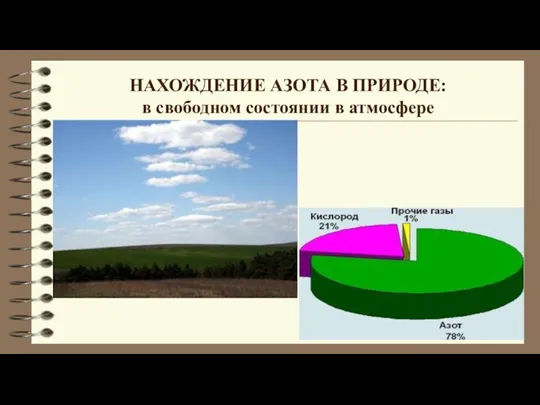
- 5. НАХОЖДЕНИЕ АЗОТА В ПРИРОДЕ: в свободном состоянии в атмосфере
- 6. НАХОЖДЕНИЕ АЗОТА В ПРИРОДЕ: в виде соединений неорганических В небольших количествах в почве: в виде солей
- 7. 3 периодV группа главная подгруппа Порядковый номер 15; относительная атомная масса 31 2 период V группа
- 8. Определите степени окисления азота в соединениях: HNО3, NН3, NO, KNО2, NО2, N2О,НNO2
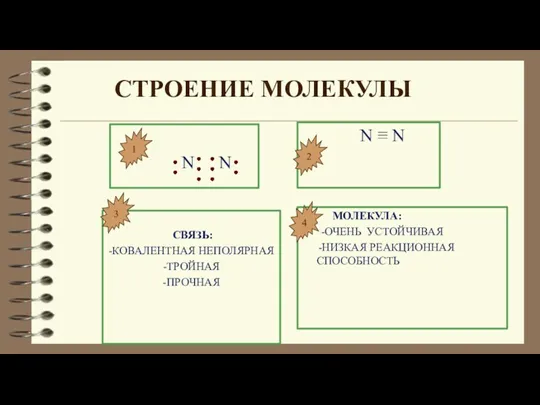
- 9. СТРОЕНИЕ МОЛЕКУЛЫ N N N ≡ N СВЯЗЬ: -КОВАЛЕНТНАЯ НЕПОЛЯРНАЯ -ТРОЙНАЯ -ПРОЧНАЯ МОЛЕКУЛА: -ОЧЕНЬ УСТОЙЧИВАЯ -НИЗКАЯ
- 10. N2 Физические свойства: В, Ц, З, М немного легче воздуха, tкип = -196 0C, tпл =
- 11. В промышленности азот получают дистилляцией воздуха, в лаборатории – термическим разложением соединений (чаще всего NH4NO2): NH4NO2
- 13. Применение Получение аммиака Создание инертной атмосферы Создание низких температур Насыщение поверхности стали для повышения прочности Жидкий
- 14. Вопросы для самоконтроля Найти верные утверждения для O2 и N2 Газ без цвета , вкуса и
- 15. Домашнее задание §23 – читать, выучить понятия и свойства. Стр. 82 №2 письменно. Выполнить схему «Круговорот
- 17. Скачать презентацию












 Сероводород и сульфиды
Сероводород и сульфиды Электроотрицательность химических элементов
Электроотрицательность химических элементов Определение качественного состава минеральных вод
Определение качественного состава минеральных вод Химическая термодинамика
Химическая термодинамика Поверхностные явления. Адсорбция
Поверхностные явления. Адсорбция Класифікація хімічних реакцій
Класифікація хімічних реакцій Фосфор
Фосфор Химические свойства металлов
Химические свойства металлов Строение, свойства и функции аминокислот и белков
Строение, свойства и функции аминокислот и белков Фазовые диаграммы бинарных систем с полиморфными превращениями на примере фазовой диаграммы системы железо-цементит Fe Fe3C
Фазовые диаграммы бинарных систем с полиморфными превращениями на примере фазовой диаграммы системы железо-цементит Fe Fe3C Накопление химических знаний в доисторические времена
Накопление химических знаний в доисторические времена Углеводы, липиды
Углеводы, липиды Многоэлектронный атом
Многоэлектронный атом Полимерные материалы, пластмассы и изделия из них
Полимерные материалы, пластмассы и изделия из них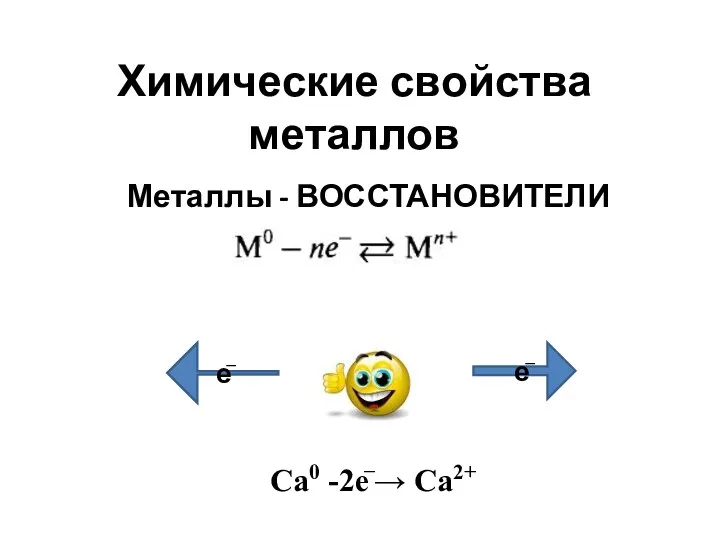 Химические свойства металлов
Химические свойства металлов Природный и попутный нефтяные газы
Природный и попутный нефтяные газы Кремний, его физические и химические свойства
Кремний, его физические и химические свойства Энергоресурсы и их использование
Энергоресурсы и их использование Соли в свете теории электролитической диссоциации
Соли в свете теории электролитической диссоциации Полисахаридтер – жоғары молекулалық көмірсулар
Полисахаридтер – жоғары молекулалық көмірсулар Реакции электрофильного замещения в ароматическом ряду Se
Реакции электрофильного замещения в ароматическом ряду Se Буферные системы
Буферные системы Решение задач. Способы выражения состава раствора
Решение задач. Способы выражения состава раствора Метангидратное ружье. Задача 3. Команда: Когнитивная машина
Метангидратное ружье. Задача 3. Команда: Когнитивная машина Основы общей химии. Тема 1
Основы общей химии. Тема 1 Кислород, азот, водород и инертные газы. Раздел 3
Кислород, азот, водород и инертные газы. Раздел 3 Химия в решении сырьевой проблемы
Химия в решении сырьевой проблемы Способы раскисления и модифицирования стали
Способы раскисления и модифицирования стали