Содержание
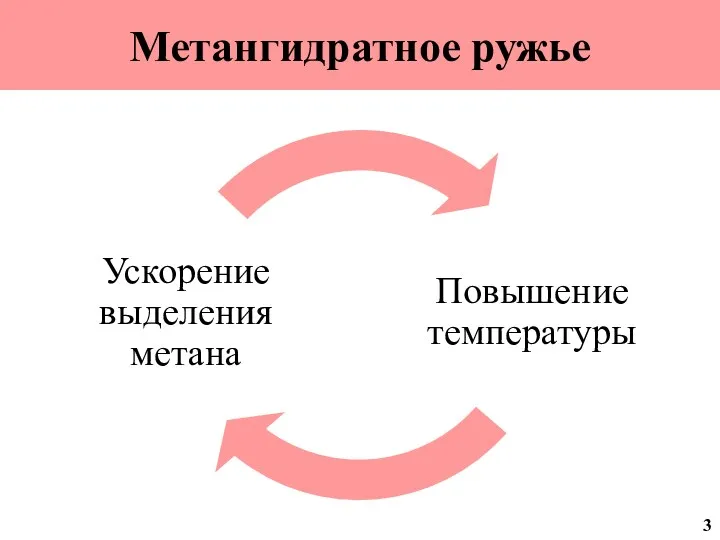
- 2. На дне океана находится значительное количество метана в виде гидратов. Если температура на планете продолжит повышаться,
- 3. Цели 2
- 4. Метангидратное ружье 3
- 5. Что такое метангидрат? (CH4 )4 (H2O)23 4
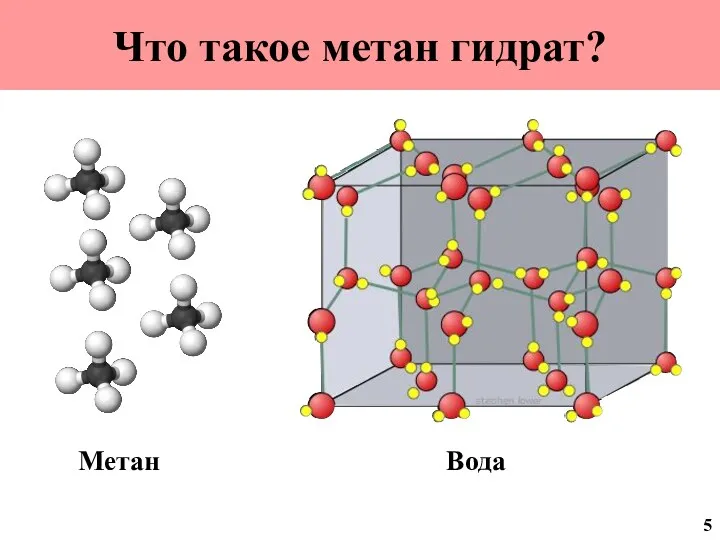
- 6. Что такое метан гидрат? Метан Вода 5
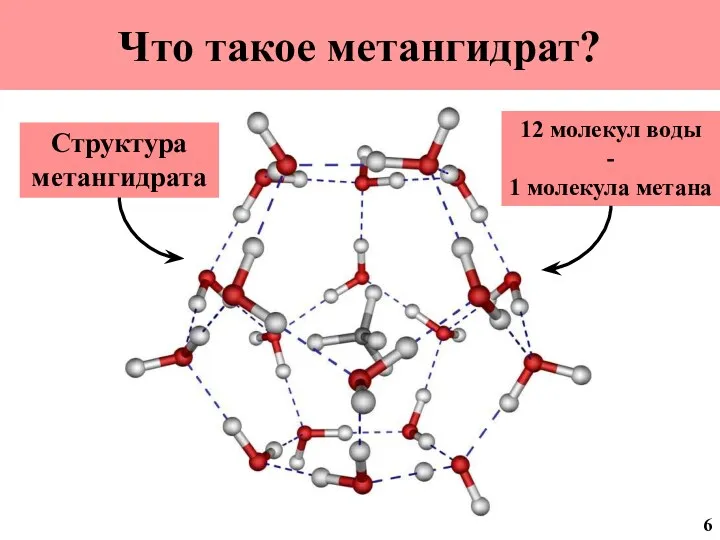
- 7. Что такое метангидрат? Структура метангидрата 12 молекул воды - 1 молекула метана 6
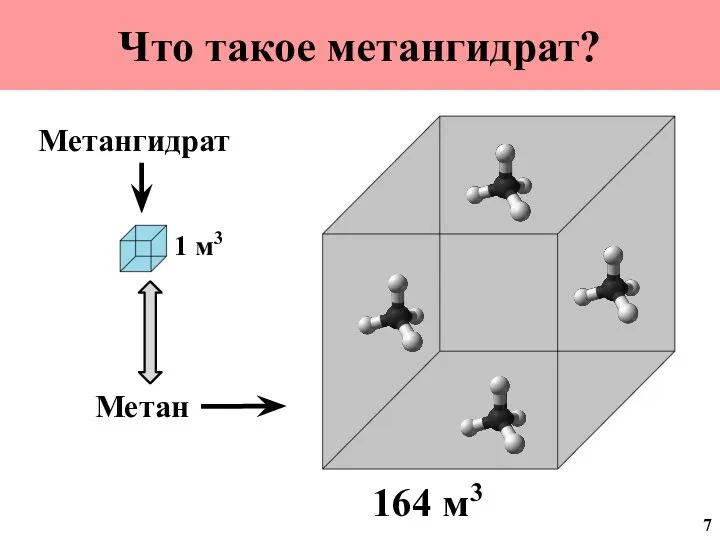
- 8. Что такое метангидрат? 1 м3 Метангидрат Метан 164 м3 7
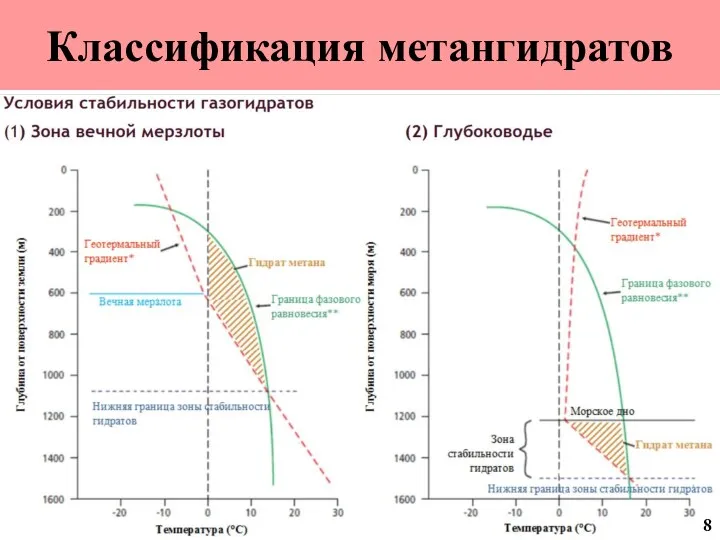
- 9. Классификация метангидратов 8
- 10. Объем метангидратов Общее количество метана 720 триллионов кубических метров 472.32·1012 кг 9
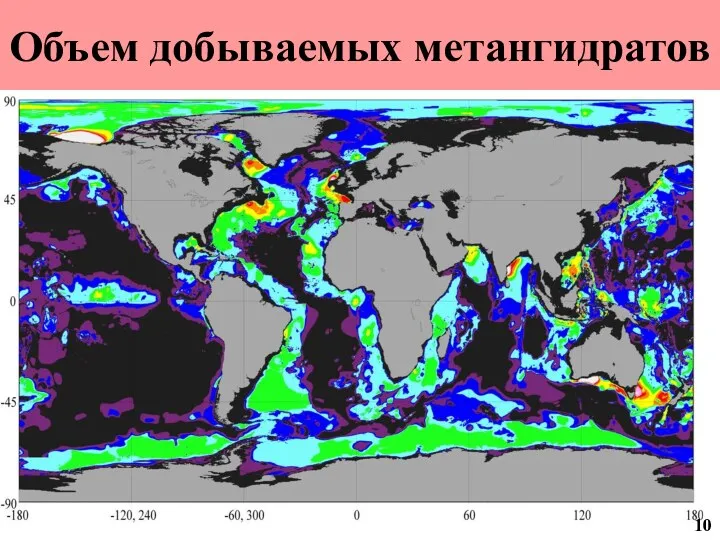
- 11. Объем добываемых метангидратов 10
- 12. Добыча метана из подземных метангидратов 11
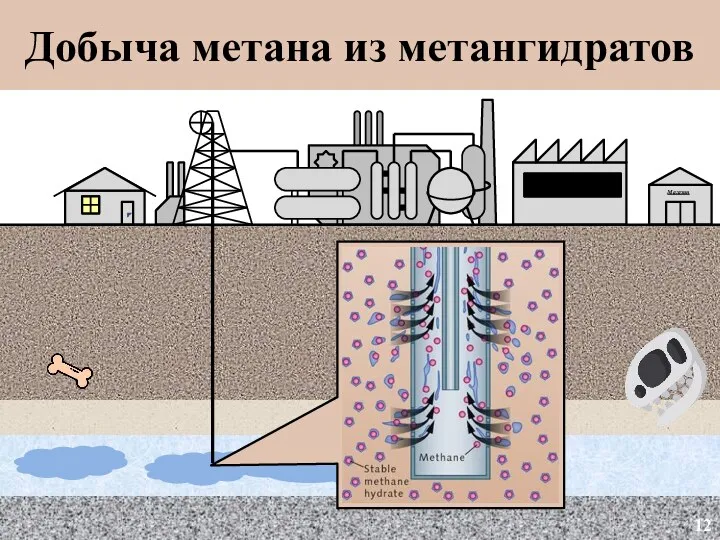
- 13. Магазин Добыча метана из метангидратов 12
- 14. Добыча метана из метангидратов 13
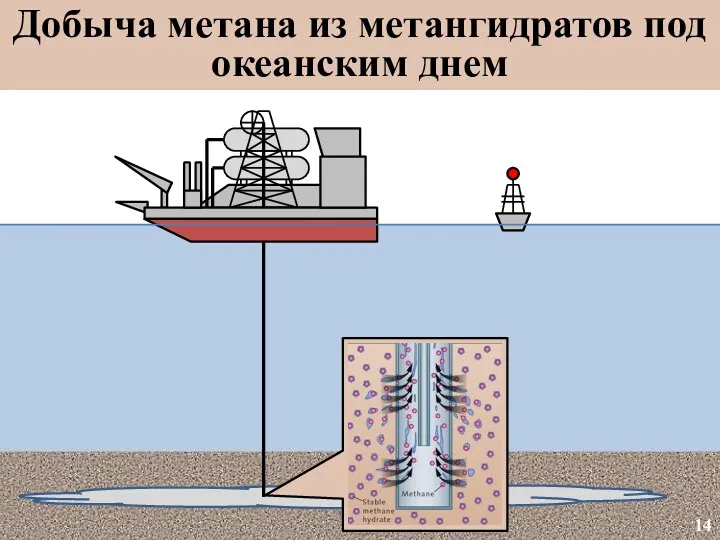
- 15. Добыча метана из метангидратов под океанским днем 14
- 16. Добыча метана из метангидратов под океанским днем 15
- 17. Добыча метана из метангидратов на морском дне 16
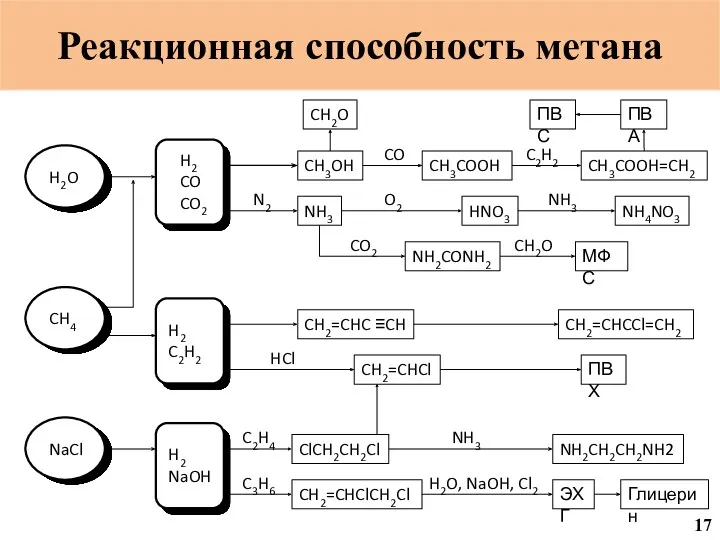
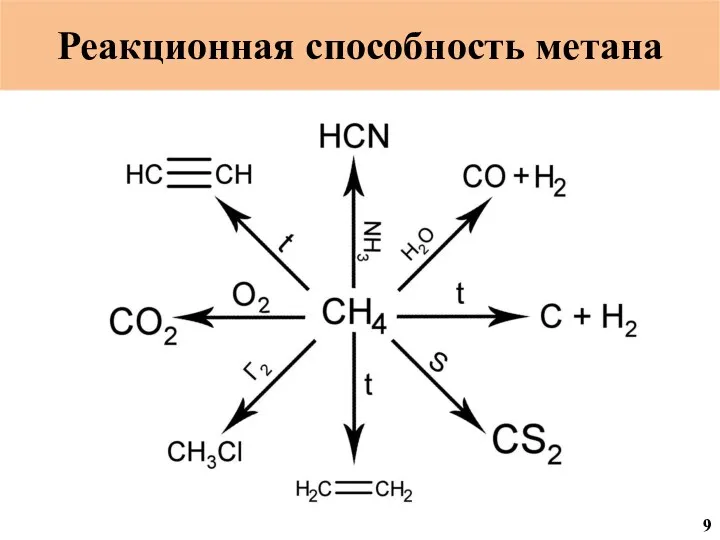
- 18. C C CH3OH CH3COOH CH3COOH=CH2 ПВА ПВС CH2O NH3 HNO3 NH4NO3 Реакционная способность метана NH2CONH2 МФС
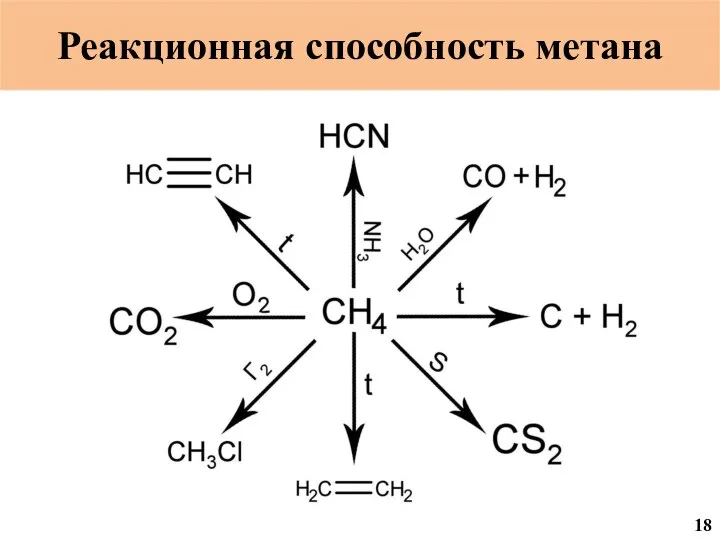
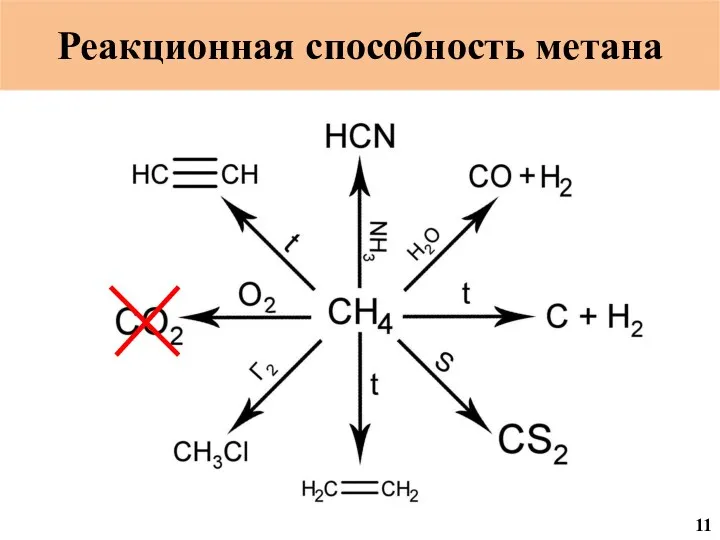
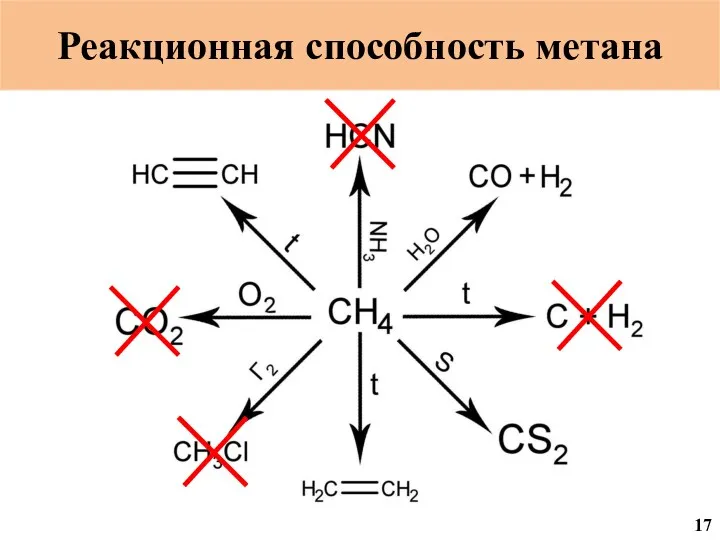
- 19. Реакционная способность метана 18
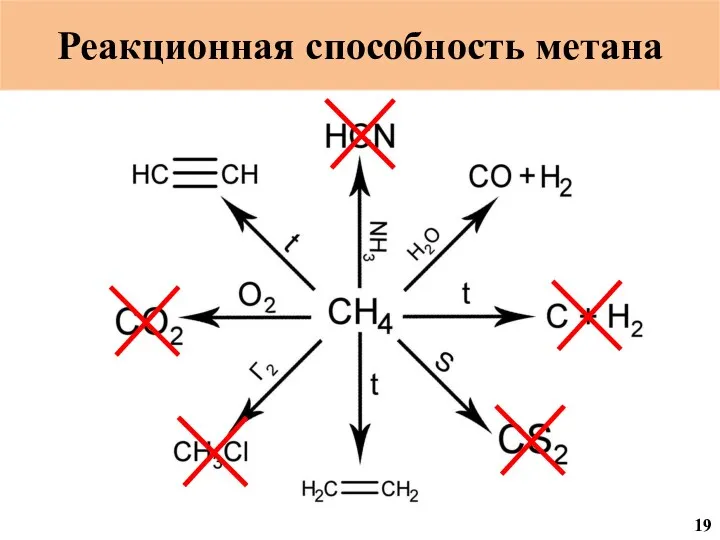
- 20. Реакционная способность метана 19
- 21. Конверсия метана 20
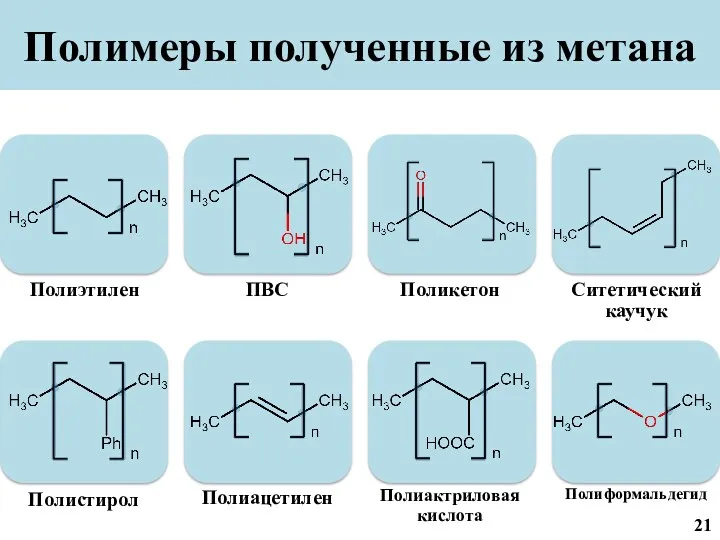
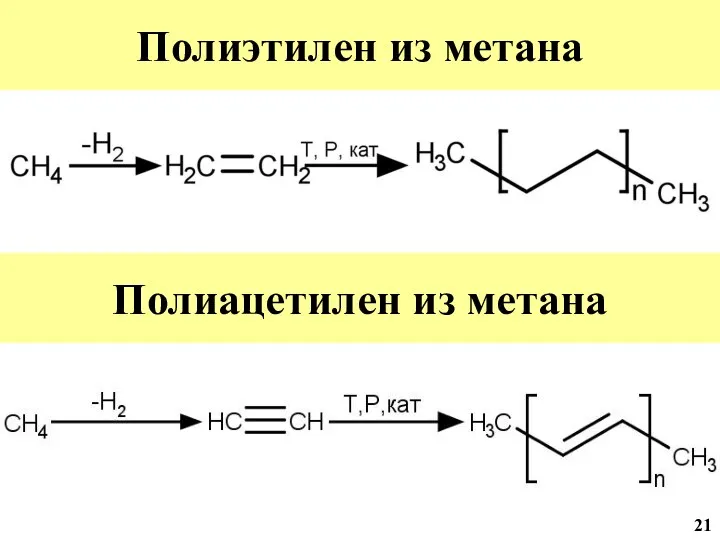
- 22. Полимеры полученные из метана 21
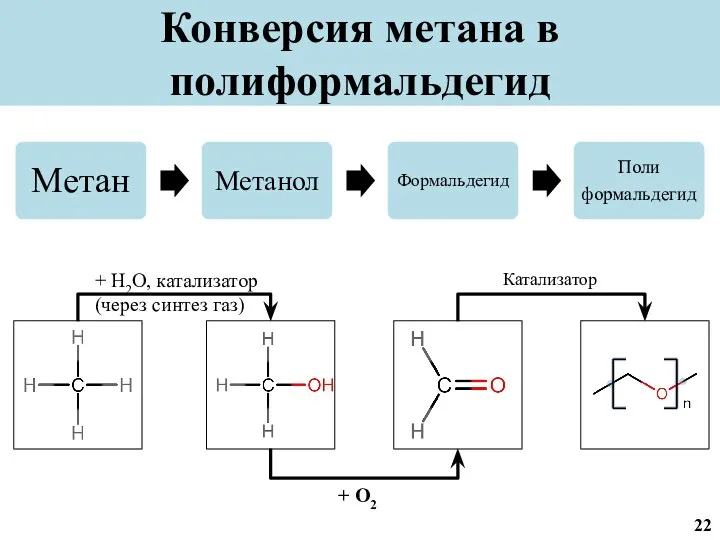
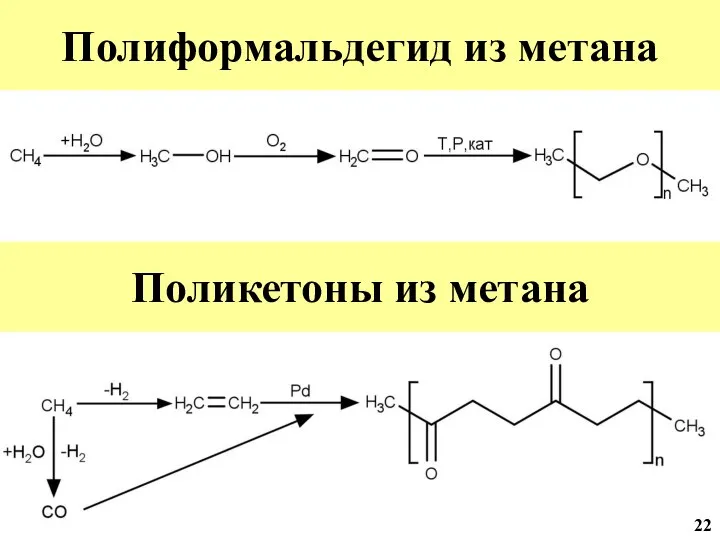
- 23. Конверсия метана в полиформальдегид + H2O, катализатор (через синтез газ) + O2 Катализатор 22
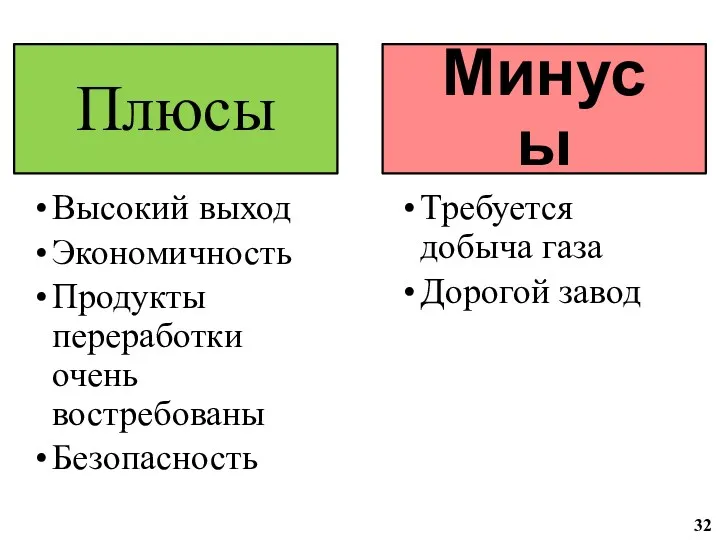
- 24. Характеристики конверсии 23
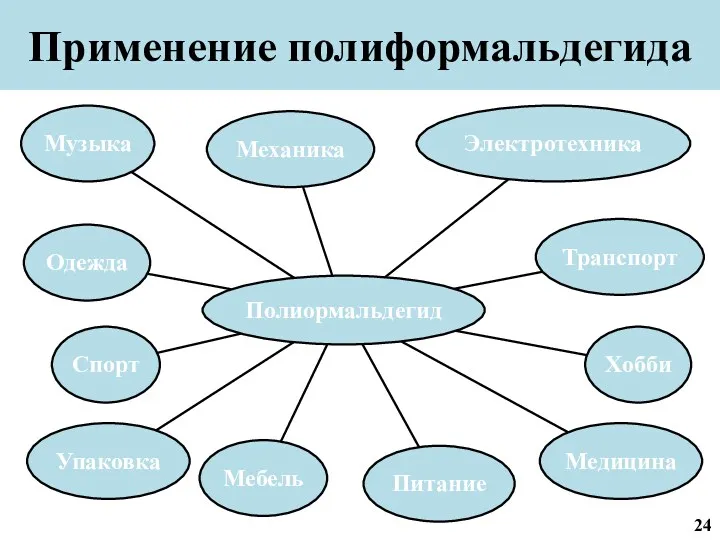
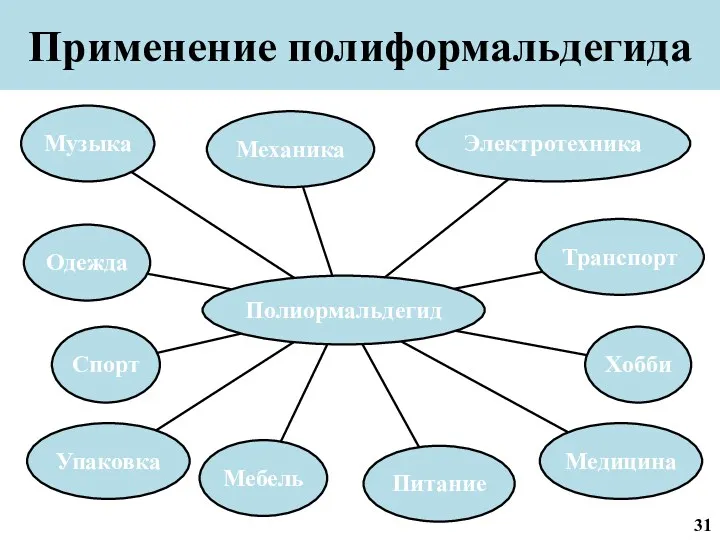
- 25. Применение полиформальдегида 24
- 26. Производство полиформальдегида 25
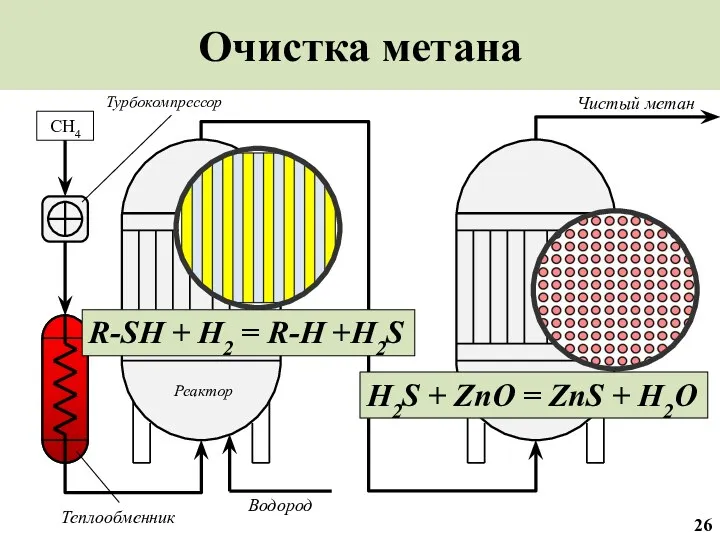
- 27. Очистка метана CH4 Чистый метан Реактор Реактор Водород Теплообменник R-SH + H2 = R-H +H2S H2S
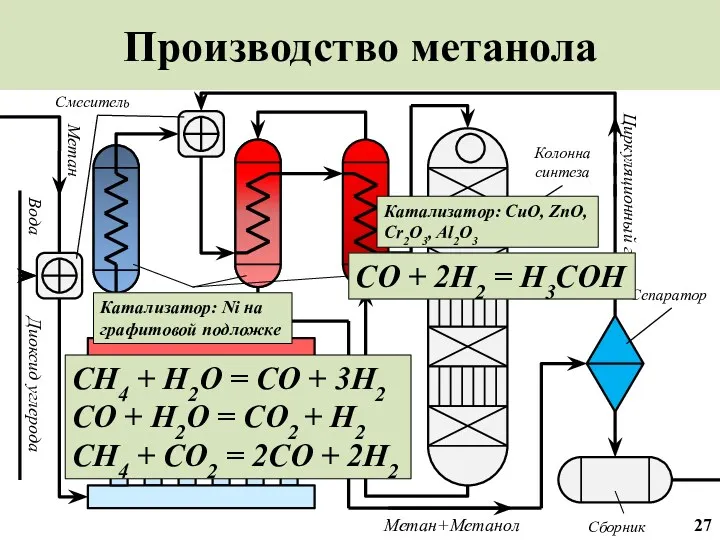
- 28. Производство метанола Синтез-газ Сепаратор Колонна синтеза Смеситель Вода Циркуляционный газ Метан+Метанол Сборник Метан Диоксид углерода Теплообменник
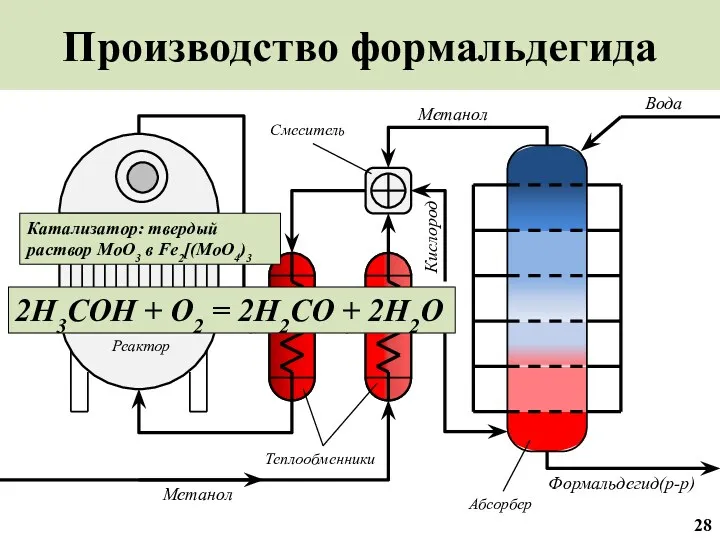
- 29. Производство формальдегида Вода Реактор Абсорбер Теплообменники Формальдегид(р-р) Метанол Метанол 28 Смеситель 2H3COH + O2 = 2H2CO
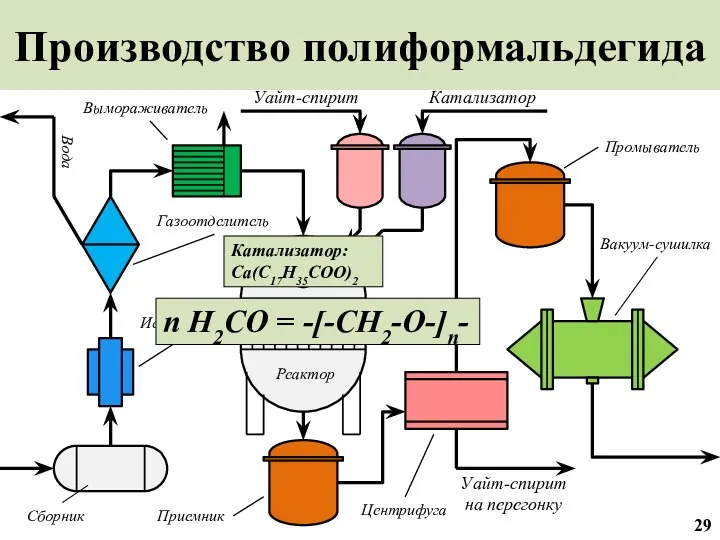
- 30. Производство полиформальдегида Уайт-спирит на перегонку Вакуум-сушилка Промыватель Уайт-спирит Катализатор Центрифуга Реактор Приемник Газоотделитель Вымораживатель Испаритель Вода
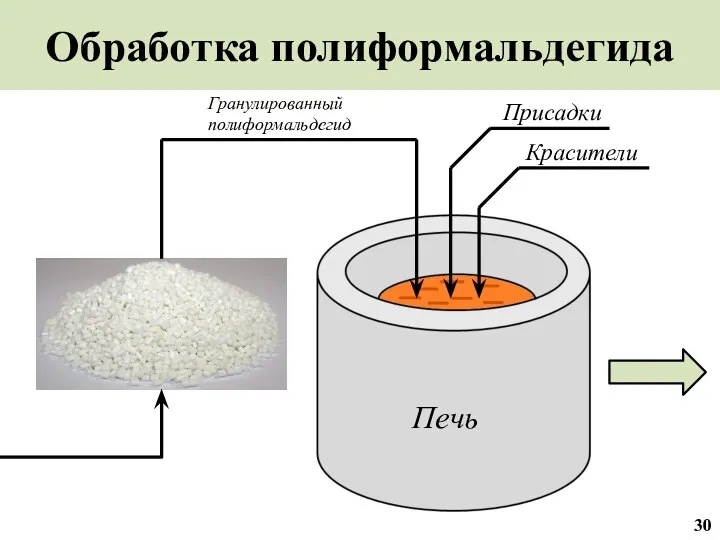
- 31. Обработка полиформальдегида Присадки Красители Гранулированный полиформальдегид Печь 30
- 32. Применение полиформальдегида 31
- 33. 32
- 34. Заключение 33
- 35. Химия и технология основного органического и нефтехимического синтеза / Лебедев Н. Н. – 3-е изд., перераб.
- 36. Resources to Reserves 2013 — Oil, Gas and Coal Technologies for the Energy Markets of the
- 37. Спасибо за внимание
- 38. Выделение метана в небольших количествах 31 CH4
- 39. 31 CH4 Добыча метана из метангидратов
- 40. Добыча метана из метангидратов 31
- 41. 31 Магазин Добыча метана из метангидратов
- 42. Полиэтилен из метана Полиацетилен из метана 21
- 43. Полиформальдегид из метана Поликетоны из метана 22
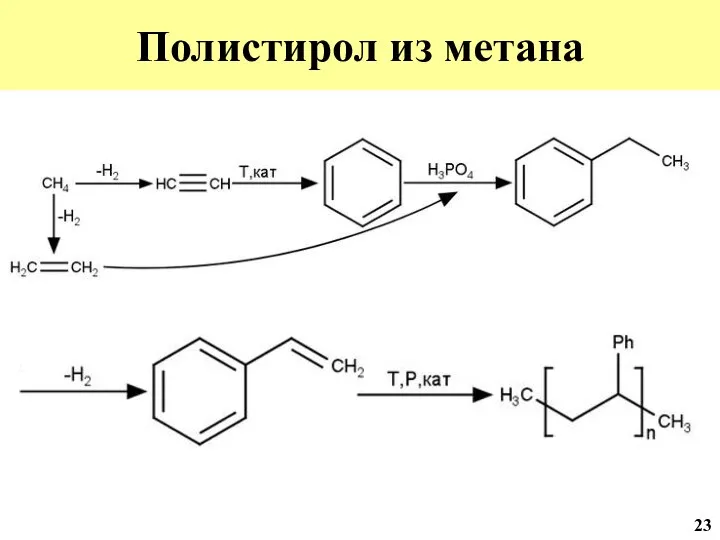
- 44. Полистирол из метана 23
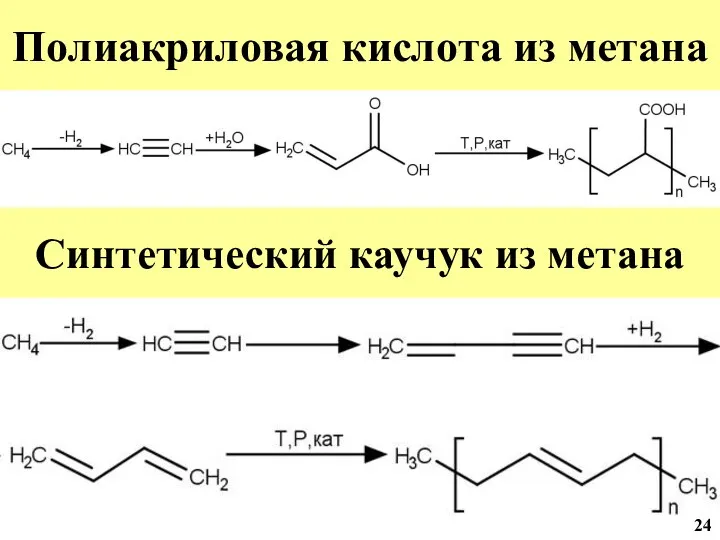
- 45. Полиакриловая кислота из метана Синтетический каучук из метана 24
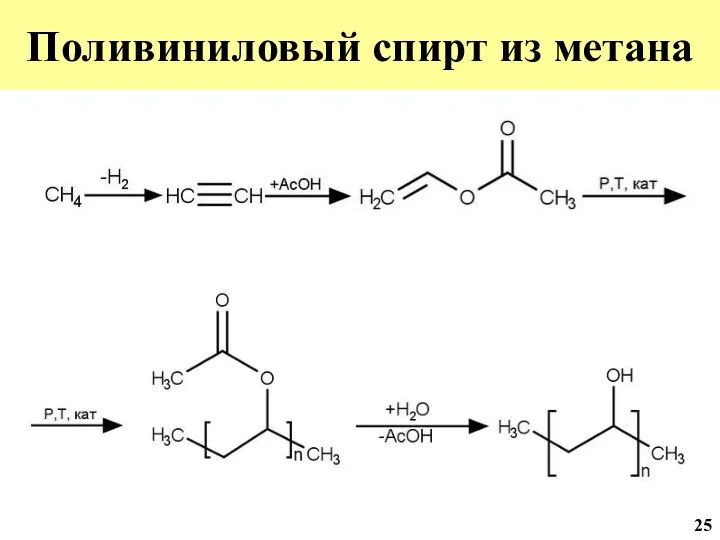
- 46. Поливиниловый спирт из метана 25
- 47. Реакционная способность метана 9
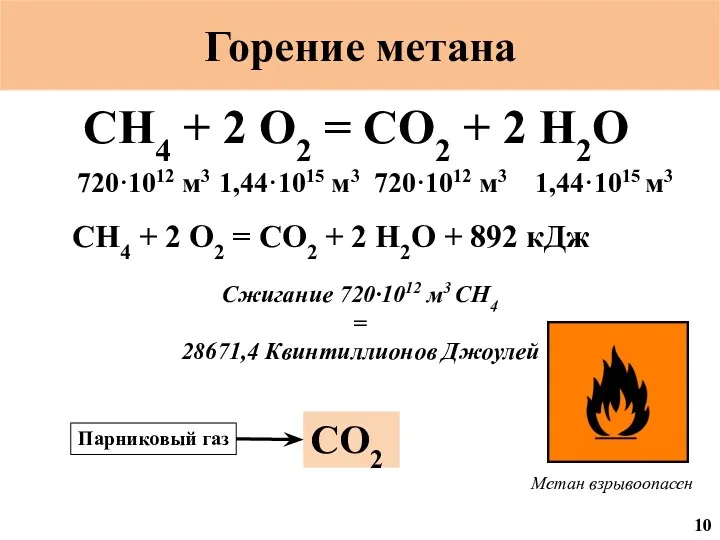
- 48. Горение метана CH4 + 2 O2 = CO2 + 2 H2O 720·1012 м3 1,44·1015 м3 720·1012
- 49. Реакционная способность метана 11
- 50. Разложение метана CH4 = C + 2 H2 12
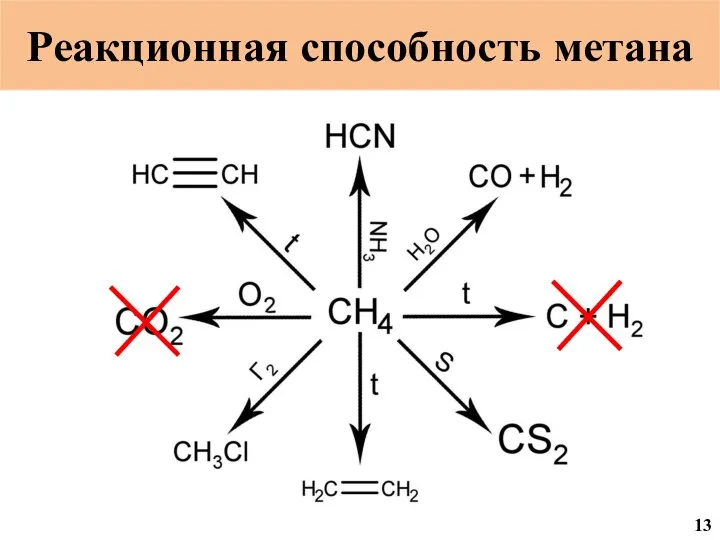
- 51. Реакционная способность метана 13
- 52. Взаимодействие с аммиаком CH4 + NH3 = HCN + 3 H2 ЛД50 3,7 мг/кг 4 4
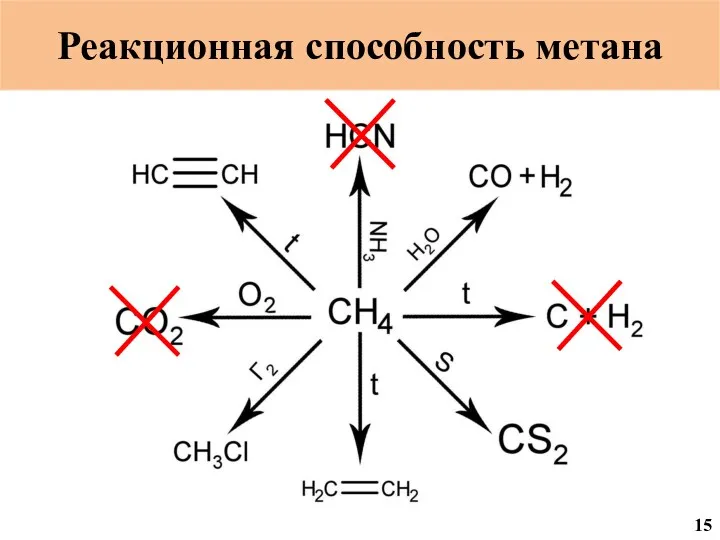
- 53. Реакционная способность метана 15
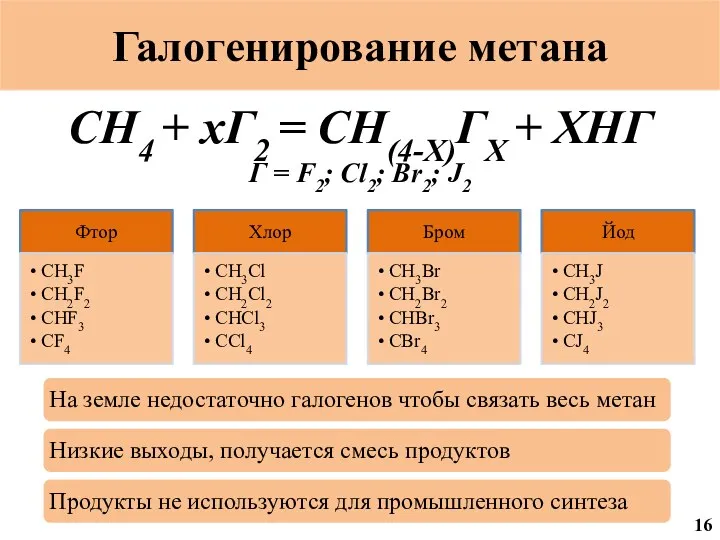
- 54. Галогенирование метана CH4 + xГ2 = CH(4-X)ГX + XHГ Г = F2; Cl2; Br2; J2 16
- 55. Реакционная способность метана 17
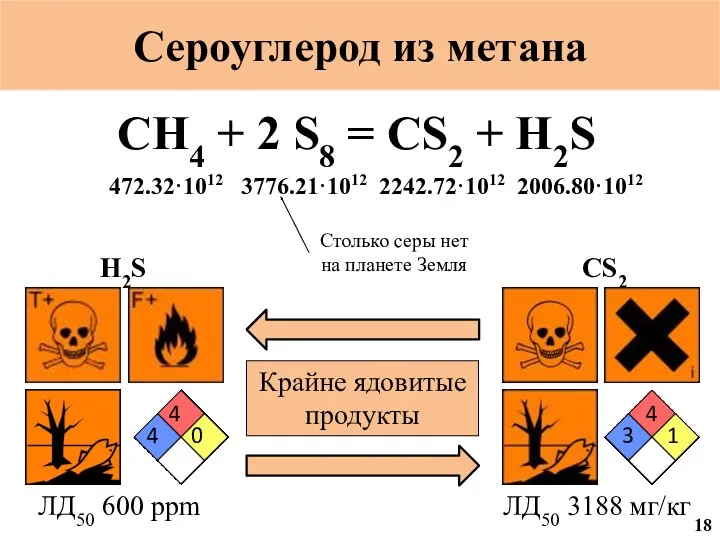
- 56. Сероуглерод из метана CH4 + 2 S8 = CS2 + H2S 3 4 1 ЛД50 3188
- 58. Скачать презентацию
















 Растворы: состав и их коллигативные свойства
Растворы: состав и их коллигативные свойства Пластмаси. Пластичні маси
Пластмаси. Пластичні маси Химияны оқыту әдістері
Химияны оқыту әдістері Створення 3D моделей атомів й молекул елементів
Створення 3D моделей атомів й молекул елементів Полимеры и их использование
Полимеры и их использование Biochemistry. What is biochemistry?
Biochemistry. What is biochemistry? Основания
Основания Водород. Общая характеристика, получение, свойства
Водород. Общая характеристика, получение, свойства Химические свойства солей. Генетическая связь неорганических соединений
Химические свойства солей. Генетическая связь неорганических соединений Історичні відомості про спроби класифікації хімічних елементів. Відкриття періодичного закону Д.І. Менделєєва
Історичні відомості про спроби класифікації хімічних елементів. Відкриття періодичного закону Д.І. Менделєєва Реакції йонного обміну між електролітами у водних розчинах. Практична робота №1. 9 клас
Реакції йонного обміну між електролітами у водних розчинах. Практична робота №1. 9 клас Электролитическая диссоциация
Электролитическая диссоциация Иониты и цеолиты. Цеолитные катализаторы
Иониты и цеолиты. Цеолитные катализаторы Цинк и его применение
Цинк и его применение Скорость химических реакций
Скорость химических реакций Карбоновые кислоты
Карбоновые кислоты Цинк. Месторождения. Применение
Цинк. Месторождения. Применение Процесс конверсии кислого газа в элементарную серу производительностью до 120 т/сутки
Процесс конверсии кислого газа в элементарную серу производительностью до 120 т/сутки Редокс – тепе-теңдік және процестері
Редокс – тепе-теңдік және процестері Обмен индивидуальных аминокислот
Обмен индивидуальных аминокислот Органічні розчинники
Органічні розчинники Азотная кислота и ее свойства
Азотная кислота и ее свойства Водородная связь
Водородная связь Амины. Номенклатура аминов
Амины. Номенклатура аминов Сущность процесса электролитической диссоциации
Сущность процесса электролитической диссоциации Химическая технология природных энергоносителей и углеродных материалов
Химическая технология природных энергоносителей и углеродных материалов Вода – растворитель. Растворы. Значение воды
Вода – растворитель. Растворы. Значение воды Електролітична дисоціація. Гідроліз солей
Електролітична дисоціація. Гідроліз солей