Содержание
- 2. Медична таблиця Мендєлєєва.
- 3. Літери білого кольору – необхідні для обміну речовин. Симоли у бірюзовому входять до складу ліків (Ti
- 4. I. ЕЛЕКТРОЛІТИЧНА ДИСОЦІАЦІЯ ЕЛЕКТРОЛІТИ - це речовини розчини або розплави яких проводять електричний струм
- 5. ЕЛЕКТРОЛІТИ НЕЕЛЕКТРОЛІТИ неорганічні кислоти, дистильована вода, основи, солі більшість органічних речовин. Всі фізіологічні рідини (плазма крові,
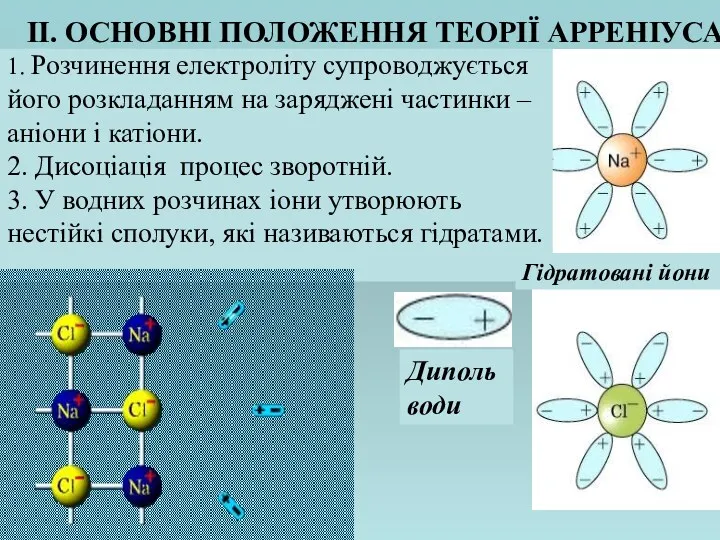
- 6. ІІ. ОСНОВНІ ПОЛОЖЕННЯ ТЕОРІЇ АРРЕНІУСА 1. Розчинення електроліту супроводжується його розкладанням на заряджені частинки – аніони
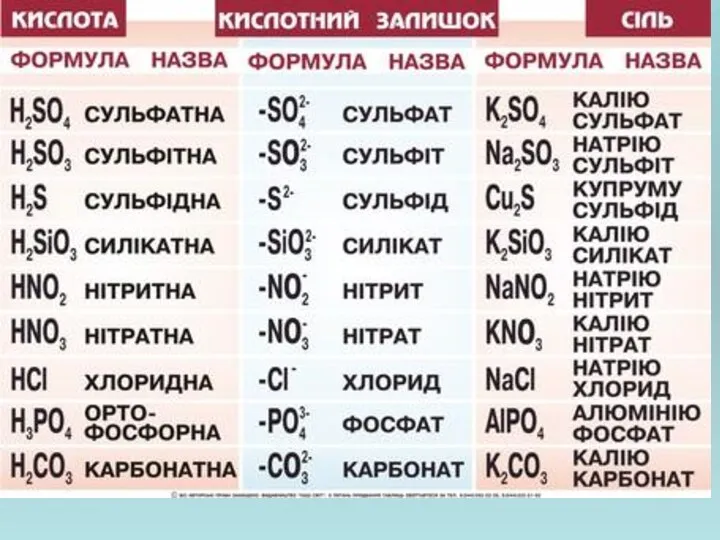
- 7. . ІІІ. СКЛАДАННЯ ЙОННО-МОЛЕКУЛЯРНИХ РІВНЯНЬ. З точки зору електролітичної дисоціації: Кислоти – речовини, які дисоціюють з
- 8. Завдання: на які йони будуть диссоціювати Н2SO4 = CuCl2 = Вa(OH)2 =
- 9. відповідь Н2SO4 = 2Н+ + SO4 2– CuCl2 =Cu2+ + 2Cl– Вa(OH)2 =Вa2+ + 2OH–
- 10. ЗАПИС РІВНЯНЬ ЕЛЕКТРОЛІТИЧНОЇ ДИСОЦІАЦІЇ Реакції у водних розчинах з участю електролітів є реакціями між йонами. Вони
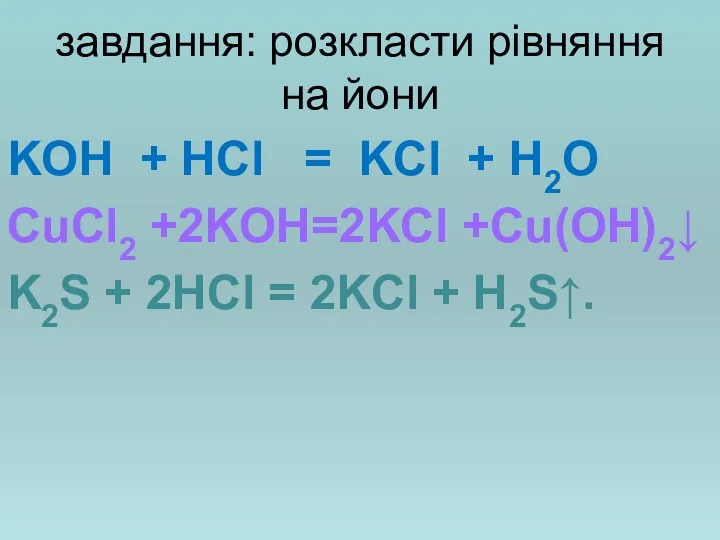
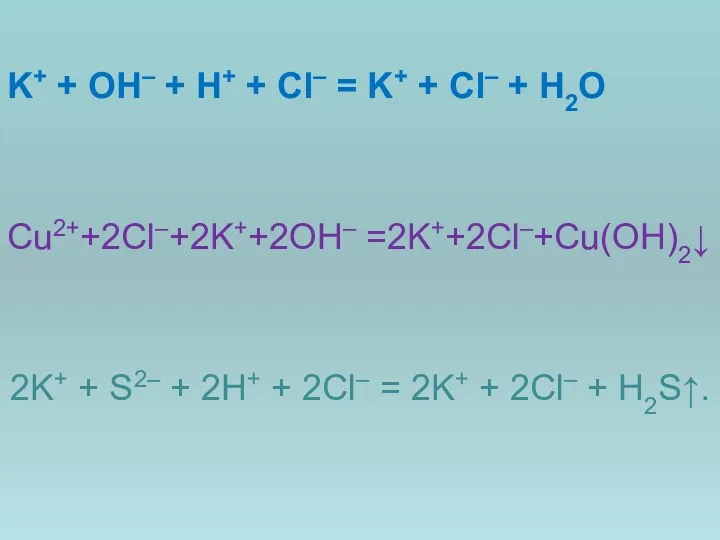
- 11. завдання: розкласти рівняння на йони KOH + HCl = KCl + H2O CuCl2 +2KOH=2KCl +Cu(OH)2↓ K2S
- 12. K+ + OH– + H+ + Cl– = K+ + Cl– + H2O Cu2++2Cl–+2K++2OH– =2K++2Cl–+Cu(OH)2↓ 2K+
- 13. IV. Умови перебігу реакцій обміну до кінця (правило Бертолле) 1. Коли утворюються нерозчинні або малорозчинні сполуки-
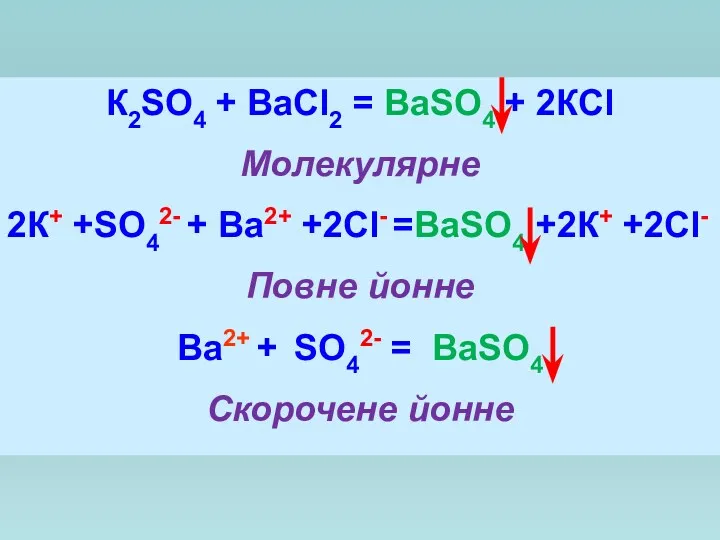
- 14. К2SO4 + BaCl2 = BaSO4 + 2КCl Молекулярне 2К+ +SO42- + Ba2+ +2Cl- =BaSO4 +2К+ +2Cl-
- 15. Завдання: Скласти скорочені йонні рівняння KOH + HCl = KCl + H2O CuCl2 +2KOH=2KCl +Cu(OH)2↓ K2S
- 16. відповідь H+ + OH– = H OН Cu2+ + 2OH– = Cu(OH)2↓. S2– + 2H+ =
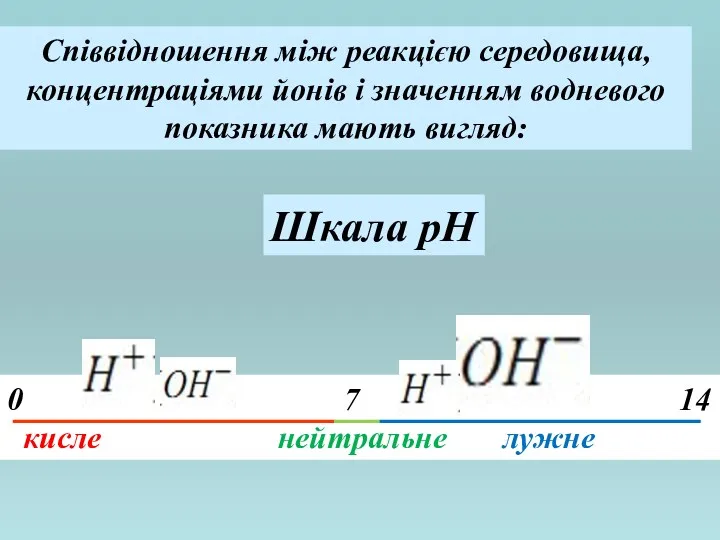
- 17. V. ХАРАКТЕРИСТИКА КИСЛОТНОСТІ СЕРЕДОВИЩА Водневим показником – рН називають від’ємний десятковий логарифм молярної концентрації йонів гідрогену.
- 18. Співвідношення між реакцією середовища, концентраціями йонів і значенням водневого показника мають вигляд: Шкала pH
- 19. ВИМІРЮВАННЯ pH За допомогою pH-метра можна точно виміряти концентрацію йонів гідроксонію. Пристрій показує: рН=5,83 Цифровий рН-метр
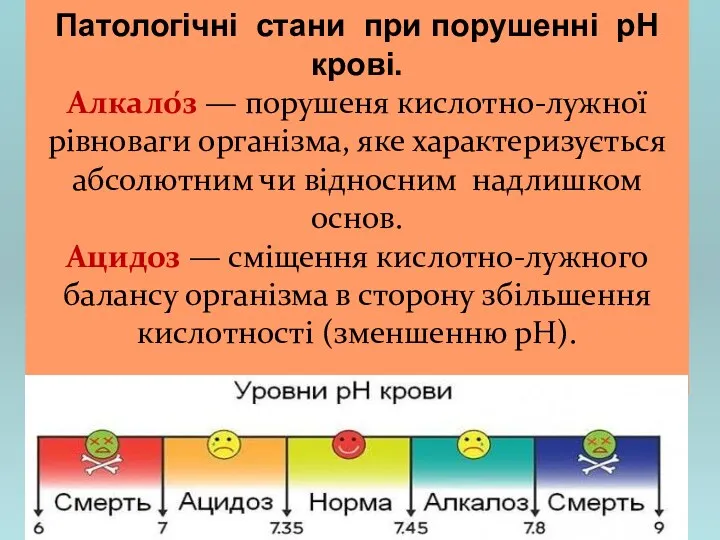
- 20. Патологічні стани при порушенні рН крові. Алкало́з — порушеня кислотно-лужної рівноваги організма, яке характеризується абсолютним чи
- 21. VI. БУФЕРНІ РОЗЧИНИ Буферні розчини, здатні зв'язувати надлишкові іони водню або гідроксид-іони і підтримувати значення рН
- 22. ГІДРОЛІЗ СОЛЕЙ VII. ГІДРОЛІЗ Гідроліз — це обмінна реакція йонів солі з водою, що призводить до
- 23. Види гідролізу Гідроліз солі слабкої кислоти та сильної основи: К2CO3 + Н2О = КHCO3 + NaOH
- 24. ДЛЯ ЧОГО ПОТРІБЕН ГІДРОЛІЗ
- 25. рН продуктів харчування
- 26. Вода та напої
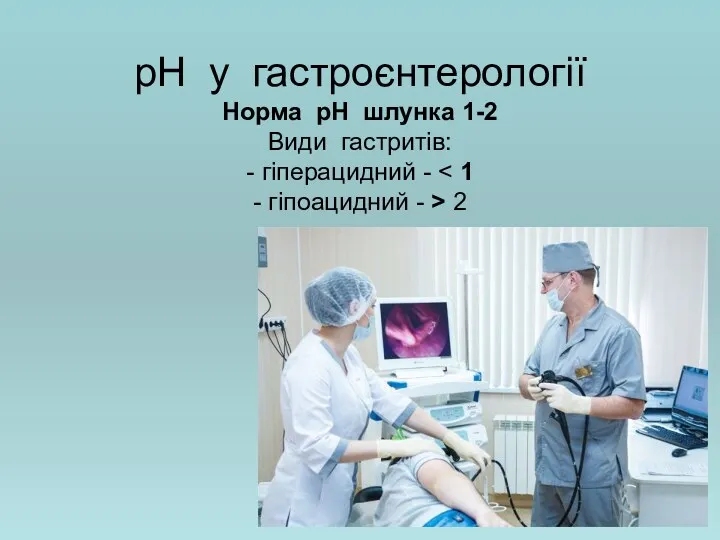
- 27. рН у гастроєнтерології Норма рН шлунка 1-2 Види гастритів: - гіперацидний - 2
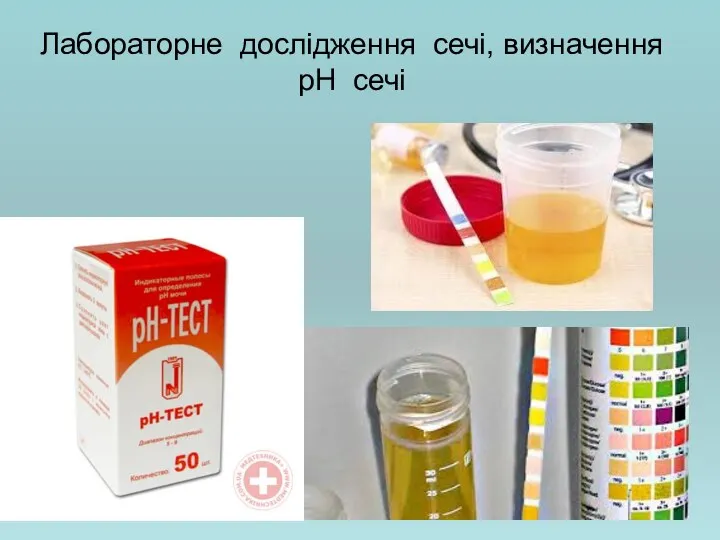
- 28. Лабораторне дослідження сечі, визначення рН сечі
- 29. рН і косметологія
- 30. Роль pH в хімії та біології Кислотність середовища має важливе значення для багатьох хімічних процесів і
- 34. Скачать презентацию






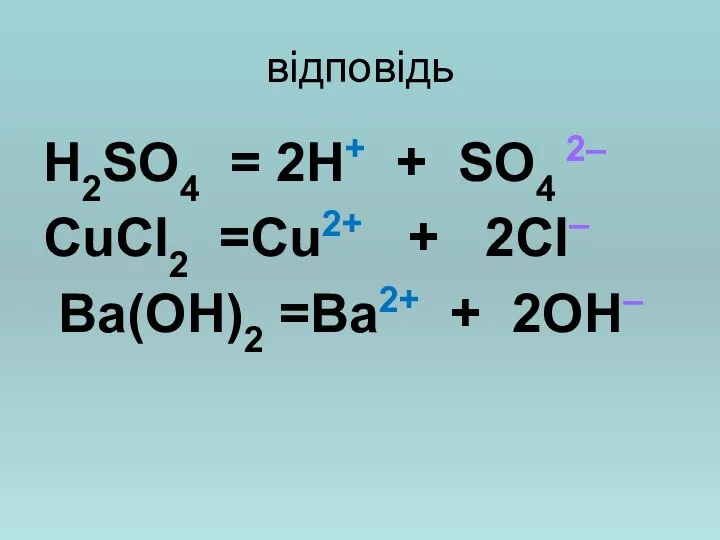















 Основания. Состав, классификация, свойства, получение
Основания. Состав, классификация, свойства, получение Газы, применяемые при сварке
Газы, применяемые при сварке Сера. Аллотропия серы. Физические и химические свойства серы. Применение серы
Сера. Аллотропия серы. Физические и химические свойства серы. Применение серы Crystallography. Part 4: Crystal Forms Twinning
Crystallography. Part 4: Crystal Forms Twinning Менделеевские уроки. День науки
Менделеевские уроки. День науки Неметаллические материалы
Неметаллические материалы Основные сведения о строении атома
Основные сведения о строении атома Решение комбинированных задач. Задачи на смеси
Решение комбинированных задач. Задачи на смеси Соли, их классификация и свойства
Соли, их классификация и свойства Кремний и его соединения
Кремний и его соединения Изучение свойств тиосульфата натрия
Изучение свойств тиосульфата натрия Поливинилхлорид (ПВХ, PVC)
Поливинилхлорид (ПВХ, PVC) Теория радикалов (30 гг. XIX в Й.Берцелиус, Ю.Либих, Ж.Дюма)
Теория радикалов (30 гг. XIX в Й.Берцелиус, Ю.Либих, Ж.Дюма) Электролитическая диссоциация
Электролитическая диссоциация Бензен як представник ароматичних вуглеводнів
Бензен як представник ароматичних вуглеводнів Кислородсодержащие соединения серы
Кислородсодержащие соединения серы Механизмы органических реакций
Механизмы органических реакций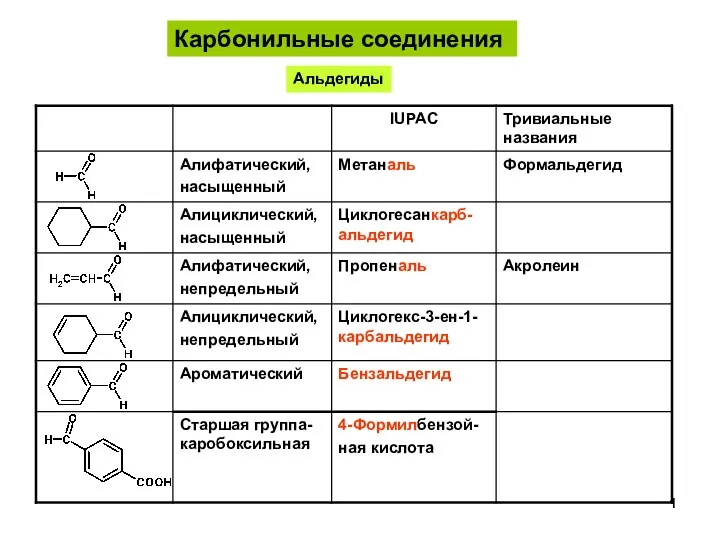 АльдегидыКетоны-1
АльдегидыКетоны-1 Белки. Определение
Белки. Определение Ферменты и гормоны. (10-11 класс)
Ферменты и гормоны. (10-11 класс) Химические свойства алканов
Химические свойства алканов Хімічні властивості кислот
Хімічні властивості кислот большая стирка
большая стирка Пищевые добавки
Пищевые добавки Химическое загрязнение атмосферы
Химическое загрязнение атмосферы Обмен липидов
Обмен липидов Кинетика химических реакций и химическое равновесие
Кинетика химических реакций и химическое равновесие Максимально очищенные фитопрепараты. Технология и стандартизация
Максимально очищенные фитопрепараты. Технология и стандартизация