Содержание
- 2. Белки-это природные высокомолекулярные органические соединения, построенные из остатков α- аминокислот, соединенных между собой пептидными связями. Все
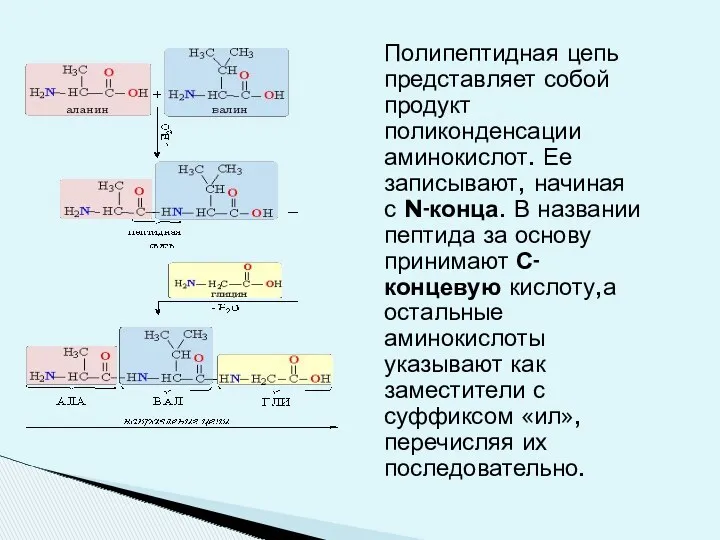
- 3. Полипептидная цепь представляет собой продукт поликонденсации аминокислот. Ее записывают, начиная с N-конца. В названии пептида за
- 4. Полипептидная цепь имеет неразветвленное строение и состоит из чередующихся метиновых (CH) и пептидных (CO-NH) групп. Различия
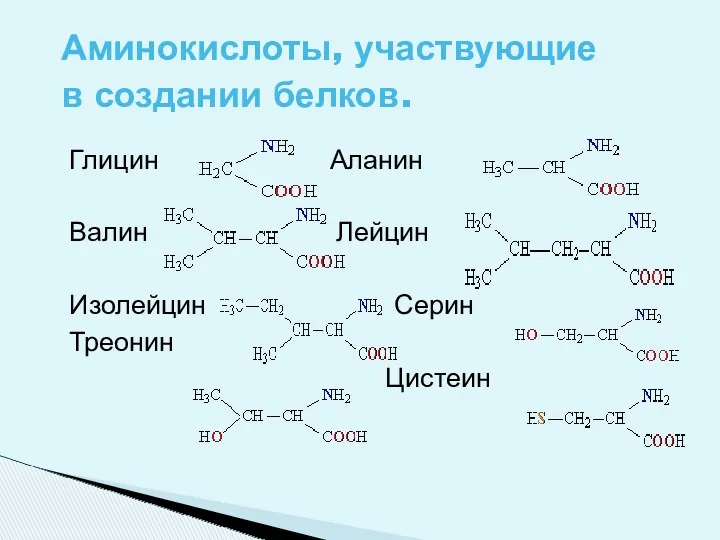
- 5. Глицин Аланин Валин Лейцин Изолейцин Серин Треонин Цистеин Аминокислоты, участвующие в создании белков.
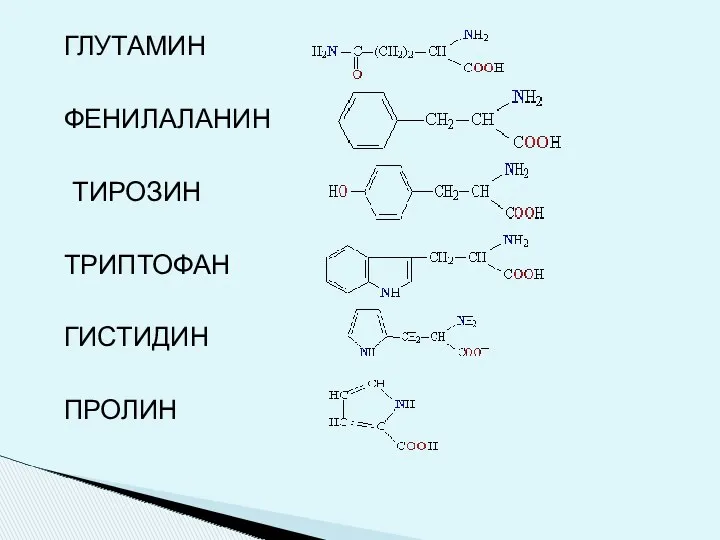
- 6. ГЛУТАМИН ФЕНИЛАЛАНИН ТИРОЗИН ТРИПТОФАН ГИСТИДИН ПРОЛИН
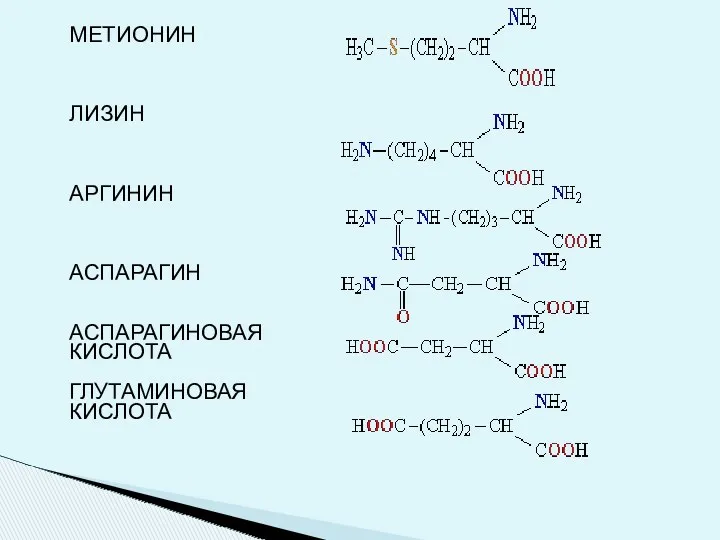
- 7. МЕТИОНИН ЛИЗИН АРГИНИН АСПАРАГИН АСПАРАГИНОВАЯ КИСЛОТА ГЛУТАМИНОВАЯ КИСЛОТА
- 8. Заменимые- могут синтезироваться в организме человека: гли, ала, сер, цис, тир, асп, глу. Незаменимые- не могут
- 9. Аминокислоты незаменимые Триптофан Фенилаланин Лизин Треонин Метионин Лейцин Изолейцин Валин
- 10. Простые (протеины):состоят в основном из 20 остатков аминокислот. Сложные (протеиды):помимо остатков аминокислот в них входят вещества
- 11. Протеин-белок куриного яйца- альбумин. Протеид-гемоглобин. Состав гемоглобина выражается формулой (C738H1166O208N203S2Fe)4 Примеры простых и сложных белков.
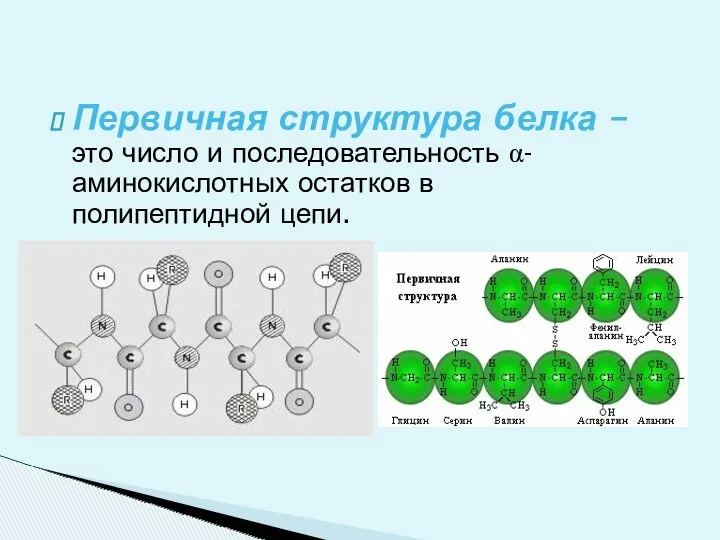
- 12. Первичная структура белка – это число и последовательность α- аминокислотных остатков в полипептидной цепи. Структура белка
- 13. Нарушение последовательности чередования аминокислот в цепи резко изменяет свойство белка. Например, если в молекуле гемоглобина, состоящей
- 14. Один из первых белков, первичная структура которого была установлена- гормон инсулин, регулирующий содержание сахара в крови.
- 15. Инсулин как полипептид
- 16. Вторичная структура белка – это α- спираль (наподобие винтовой лестницы),которая образуется в результате скручивания полипептидной цепи.
- 17. В одном витке спирали содержится 3,6 аминокислотных остатка. Все боковые радикалы находятся снаружи спирали. Вторичная структура
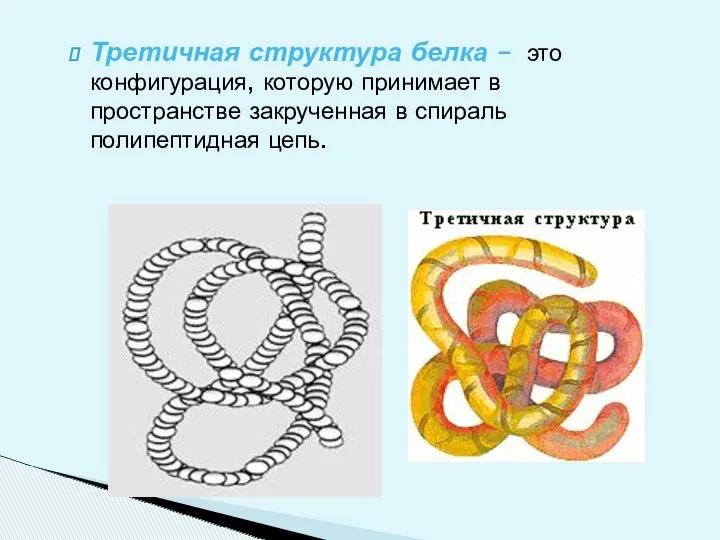
- 18. Третичная структура белка – это конфигурация, которую принимает в пространстве закрученная в спираль полипептидная цепь.
- 19. Спиралевидная цепь способна сворачиваться в клубок. Она поддерживается за счет взаимодействия различных функциональных групп: сложноэфирных мостиков,
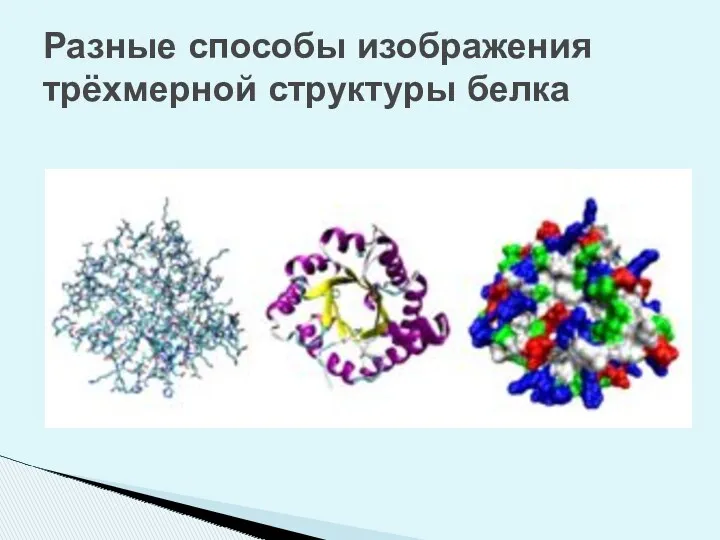
- 20. Разные способы изображения трёхмерной структуры белка
- 21. Четвертичная структура белка – это соединенные друг с другом макромолекулы белков. Они образуют комплекс. Например, гемоглобин
- 22. По растворимости: фибриллярные и глобулярные. Фибриллярные белки нерастворимы в воде. Они имеют линейное строение. Пример- кератин.
- 23. По агрегатному состоянию различают твердые, жидкие или полужидкие (студнеобразные) белки.
- 24. Белки содержат различные функциональные группы, поэтому их нельзя отнести к определенному классу соединений. Это полифункциональные вещества.
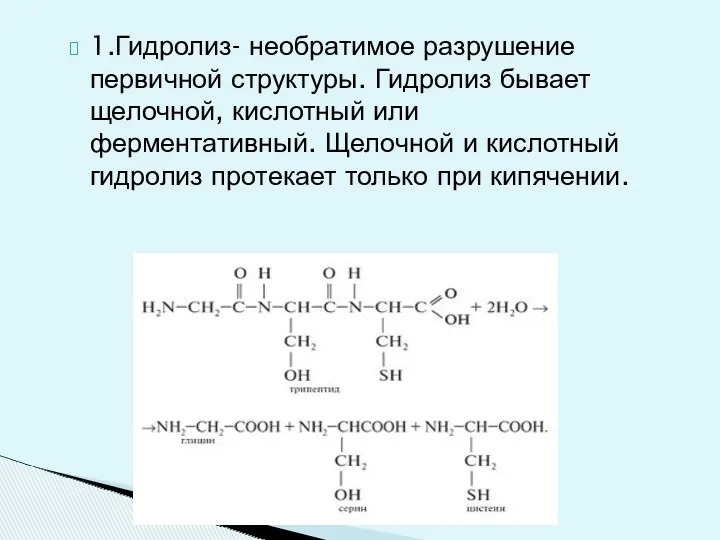
- 25. 1.Гидролиз- необратимое разрушение первичной структуры. Гидролиз бывает щелочной, кислотный или ферментативный. Щелочной и кислотный гидролиз протекает
- 26. Ферментативный гидролиз протекает селективно, т.е. ферменты расщепляют строго определенные участки цепи; образующиеся при этом аминокислоты используются
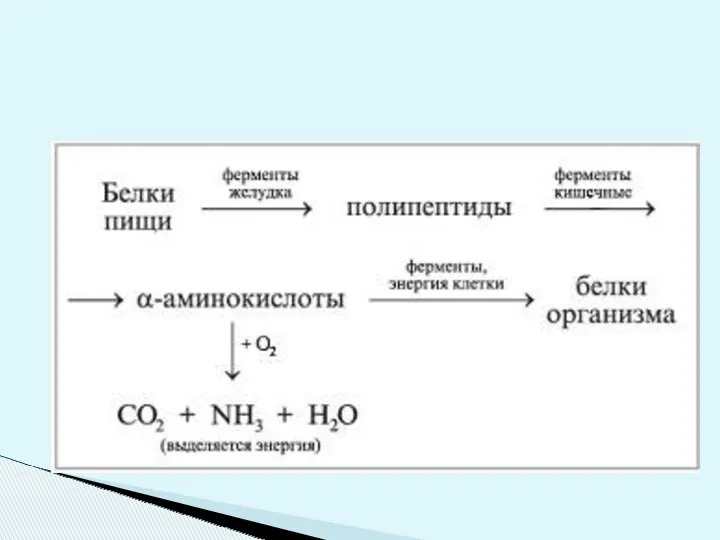
- 27. Гидролиз белков в организме
- 28. 2) денатурация – нарушение природной структуры белка (под действием нагревания и химических реагентов)
- 29. При действии органических растворителей, продуктов жизнедеятельности некоторых бактерий (молочнокислое брожение) или при повышении температуры происходит разрушение
- 30. Первичная структура белка при денатурации сохраняется. Денатурация может быть обратимой (так называемая, ренатурация) и необратимой. Пример
- 31. Для аминокислот, постоянно встречающихся в составе белков, разработано множество цветных (в том числе именных) реакций. Многие
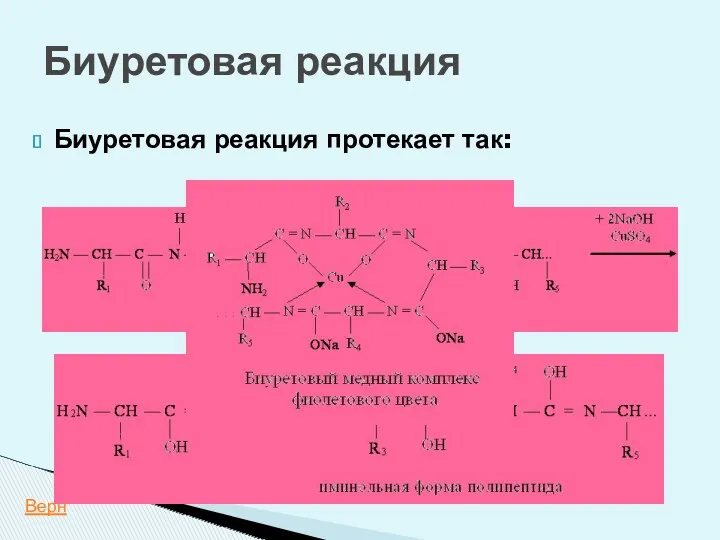
- 32. Биуретовая реакция Определяет наличие пептидной связи в растворе исследуемого соединения. Белок + CuSО4 + ОН------фиолетовое окрашивание
- 34. Биуретовая реакция Биуретовая реакция протекает так: +CuSO4 +NaOH Верн
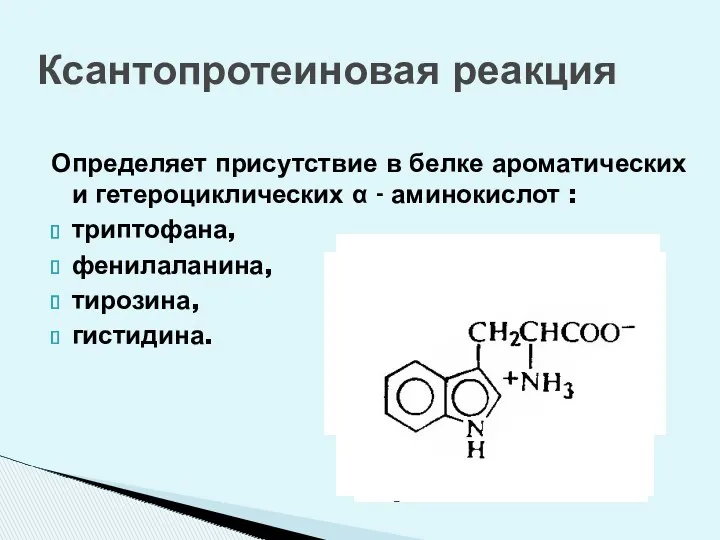
- 35. Определяет присутствие в белке ароматических и гетероциклических α - аминокислот : триптофана, фенилаланина, тирозина, гистидина. Ксантопротеиновая
- 36. Ксантопротеиновая реакция При действии концентрированной НNО3 на раствор белка образуется нитросоединение, окрашенное в желтый цвет.
- 37. Цистеиновая реакция.
- 42. Скачать презентацию




























 Цветные металлы и сплавы
Цветные металлы и сплавы Массовая доля вещества в растворе
Массовая доля вещества в растворе Характеристики атома. Электроотрицательность. Шкала Полинга. Изменения химических свойств элементов в ПСЭ. (Лекция 1.2)
Характеристики атома. Электроотрицательность. Шкала Полинга. Изменения химических свойств элементов в ПСЭ. (Лекция 1.2) Анилин. Строение. Физические и химические свойства
Анилин. Строение. Физические и химические свойства Технология промышленных газов
Технология промышленных газов Химия вокруг нас
Химия вокруг нас Непредельные, ненасыщенные, ацетиленовые алкины
Непредельные, ненасыщенные, ацетиленовые алкины Перегонка с водяным паром
Перегонка с водяным паром Липиды. Классификация липидов
Липиды. Классификация липидов Основания. Номенклатура оснований
Основания. Номенклатура оснований Химические свойства металлов
Химические свойства металлов Процесс в химическом реакторе
Процесс в химическом реакторе Скорость химических реакций. Факторы, влияющие на скорость химической реакции
Скорость химических реакций. Факторы, влияющие на скорость химической реакции Щелочные металлы. Периодическая система химических элементов Д.И. Менделеева
Щелочные металлы. Периодическая система химических элементов Д.И. Менделеева Пена и пенообразователи. Назначение, виды, состав и свойства
Пена и пенообразователи. Назначение, виды, состав и свойства Гидроксиды. Основания: способы получения
Гидроксиды. Основания: способы получения Спирты
Спирты Кондуктометрия и кондуктометрическое титрование
Кондуктометрия и кондуктометрическое титрование Тяжелые металлы
Тяжелые металлы Горение жидкостей
Горение жидкостей Определение фосфатов, железа, хлоридов
Определение фосфатов, железа, хлоридов Изменения, происходящие с белками в процессах технологической переработки сырья
Изменения, происходящие с белками в процессах технологической переработки сырья Металлическая связь
Металлическая связь Химический состав воздуха
Химический состав воздуха Сладкая жизнь. Проектно-исследовательская работа
Сладкая жизнь. Проектно-исследовательская работа Хімічні явища в побуті
Хімічні явища в побуті Кристаллы. Кристаллические вещества
Кристаллы. Кристаллические вещества Алканы. (Предельные углеводороды. Парафины. Насыщенные углеводороды.)
Алканы. (Предельные углеводороды. Парафины. Насыщенные углеводороды.)