Содержание
- 2. I. Строение и общие свойства π σ σ σ С С Н Н Атом С находится
- 3. II. Изомерия и номенклатура алкинов Гомологический ряд алкинов СnH2n-2 С2Н2 СН≡СН систематическое рациональное брутто структурная Формула
- 4. Для алкинов характерно несколько видов изомерии: изомерия углеродного скелета изомерия положения тройной связи межклассовая изомерия С4Н6
- 5. IV. Способы получения 1. Карбидный способ – промышленный и лабораторный метод. карбид кальция – СаС2 ацетилен
- 6. 2. Пиролиз природного газа – основная часть которого метан. метан ацетилен 3. Дегидрогалогенирование дигалогенпроизводных соединений. 1,2-дихлорэтан
- 7. V. Химические свойства Учитывая особенности тройной связи, для алкинов характерны реакции присоединения, которые протекают в две
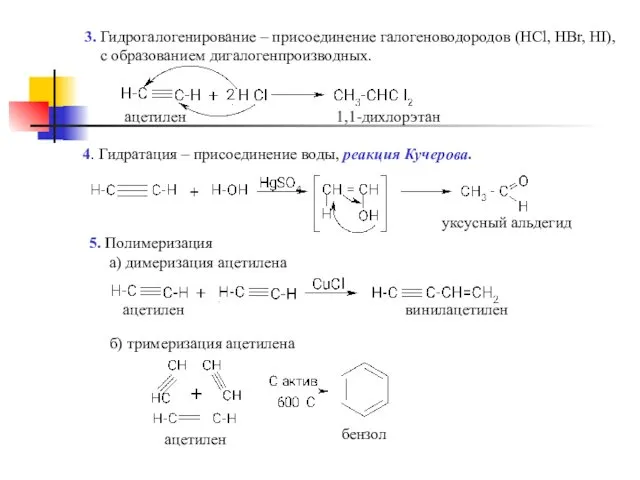
- 8. 3. Гидрогалогенирование – присоединение галогеноводородов (НCl, HBr, HI), с образованием дигалогенпроизводных. 1,1-дихлорэтан ацетилен 4. Гидратация –
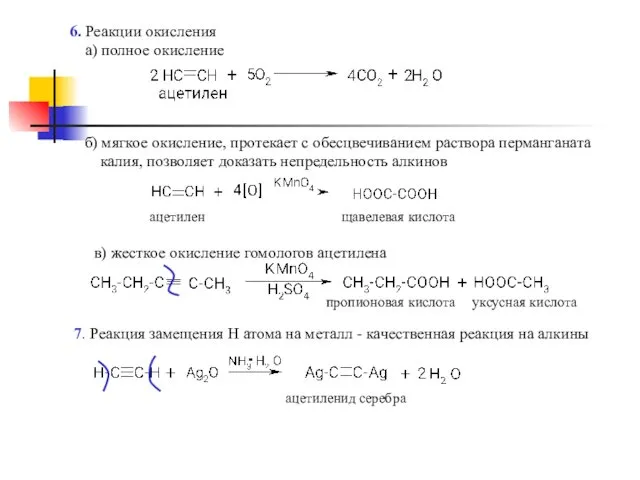
- 9. 6. Реакции окисления а) полное окисление б) мягкое окисление, протекает с обесцвечиванием раствора перманганата калия, позволяет
- 10. VI. Применение этилового спирта C2H5OH – в производстве парфюмерных средств; Алкины не используют в качестве топлива,
- 11. АЛКАДИЕНЫ Общая формула СnH2n-2 Диеновые углеводороды – это непредельные углеводороды, в молекулах которых имеются две двойные
- 12. 1. Дегидрирование н-бутана (двухстадийный каталитический процесс). Методы получения бутадиен-1,3 2. Метод Лебедева, включает две реакции одновременно
- 13. Диены способны присоединять водород, галогены, галогеноводороды. Особенностью присоединения к диенам является способность присоединять молекулы как в
- 14. Реакции полимеризации Реакция является основой для получения синтетических каучуков. Полимеризация сопряженных диенов протекает по механизму 1,4-присоединения,
- 15. Применение дивинил (бутадиен-1,3) синтетический каучук – в производстве шин, обмотки кабелей и проводов; Основная область применения
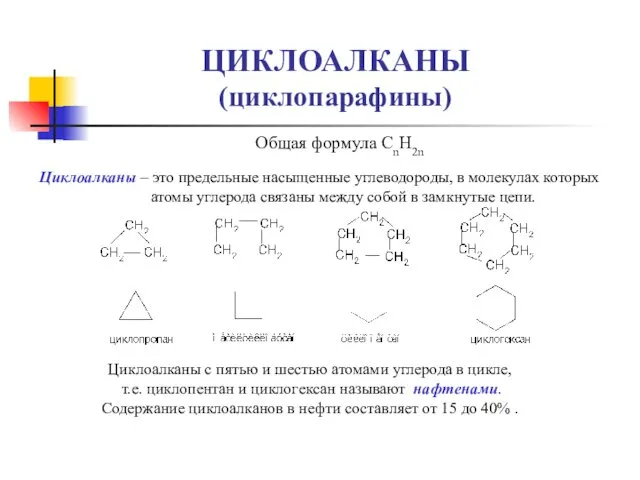
- 16. ЦИКЛОАЛКАНЫ (циклопарафины) Общая формула СnH2n Циклоалканы – это предельные насыщенные углеводороды, в молекулах которых атомы углерода
- 17. Методы получения 1. Дегалогенирование дигалогенпроизводных (внутримолекулярная реакция Вюрца). В основном свойственна для получения трех- и четырехчленных
- 18. Химические свойства Свойства циклоалканов зависят от природы цикла. Для малых циклов (циклопропана, циклобутана) характерны реакции присоединения,
- 20. Скачать презентацию














 Поверхностные явления. Типы поверхностных явлений
Поверхностные явления. Типы поверхностных явлений Графит
Графит Серная кислота и её свойства
Серная кислота и её свойства Оксиды, их классификация и свойства
Оксиды, их классификация и свойства Алкадиены. Строение алкадиенов
Алкадиены. Строение алкадиенов Курс биохимии. Биохимия крови
Курс биохимии. Биохимия крови Действующие вещества. Лексикон
Действующие вещества. Лексикон Классификация минералов в соответствии с систематикой, утвержденной IMA
Классификация минералов в соответствии с систематикой, утвержденной IMA Алкены. Непредельные углеводороды
Алкены. Непредельные углеводороды Кислород. Промышленный способ (перегонка жидкого воздуха)
Кислород. Промышленный способ (перегонка жидкого воздуха) Атомовиты. Анатомо-физиологические свойства
Атомовиты. Анатомо-физиологические свойства Д.И. Менделеев Мощь и сила науки во множестве фактов, цель – в обобщении этого множества
Д.И. Менделеев Мощь и сила науки во множестве фактов, цель – в обобщении этого множества Гидроочистка нефти и газа
Гидроочистка нефти и газа Поверхностные явления
Поверхностные явления Скорость химических реакций. Химическое равновесие
Скорость химических реакций. Химическое равновесие Центрифугирование в почвоведении
Центрифугирование в почвоведении Классификация химических реакций (11 класс)
Классификация химических реакций (11 класс) Особливості горіння дисперсних систем
Особливості горіння дисперсних систем Первая группа периодической системы Менделеева. Щелочные металлы
Первая группа периодической системы Менделеева. Щелочные металлы Оптические свойства салических породообразующих минералов (лекция 8)
Оптические свойства салических породообразующих минералов (лекция 8) Альдегиды и кетоны
Альдегиды и кетоны Углеводы. Молекулярные формулы
Углеводы. Молекулярные формулы Трансмиссионные масла
Трансмиссионные масла Атомно-молекулярное учение. (Лекция 1)
Атомно-молекулярное учение. (Лекция 1) Закон постоянства состава
Закон постоянства состава Путешествие на остров Соединений химических элементов. Урок-игра
Путешествие на остров Соединений химических элементов. Урок-игра Кобальт. Химический элемент
Кобальт. Химический элемент 20230306_oni_byli_pervymi
20230306_oni_byli_pervymi