Д.И. Менделеев Мощь и сила науки во множестве фактов, цель – в обобщении этого множества презентация
Содержание
- 2. «Типы химических реакций» Тема урока:
- 3. 1) Н2О → Н2↑ + О2↑ 2) Zn + HCl → ZnCl2 + H2↑ 3) Mg
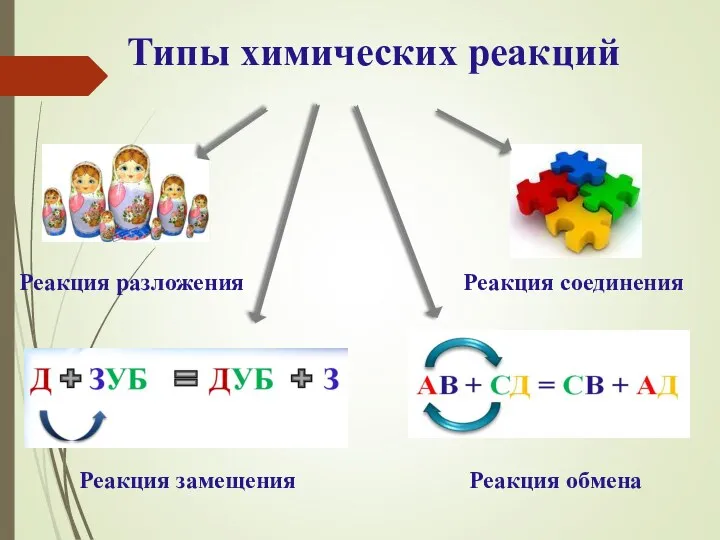
- 4. Типы химических реакций Реакция разложения Реакция соединения Реакция замещения Реакция обмена
- 5. Что общего в данных реакциях? 2Н2О = 2Н2↑ + О2↑ 2KMnO4 = K2MnO4 + MnO2 +
- 6. Лабораторный опыт № 1 Cu2(OH)2CO3 = 2CuO + CO2↑ + H2O 1) Данная реакция протекает при
- 7. Реакция разложения- реакция, в результате которой из одного сложного вещества образуются два или несколько простых или
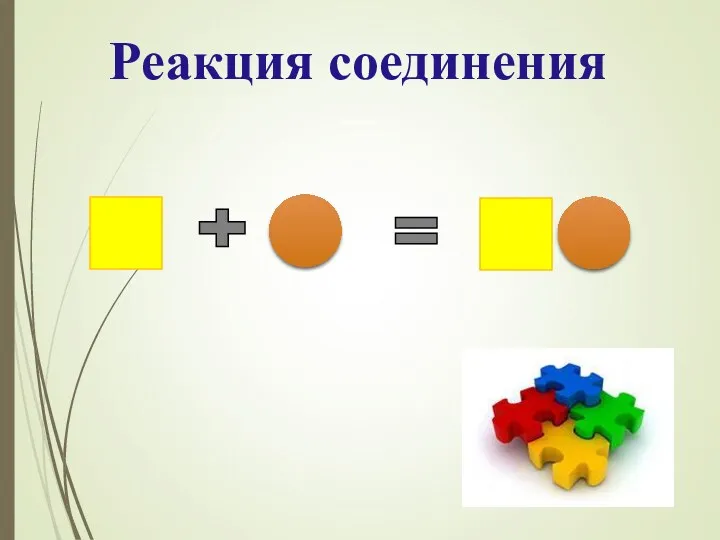
- 8. Что общего в данных реакциях? 2Mg + O2 = 2MgO BaO + H2O = Ba(OH)2 Fe
- 9. Лабораторный опыт № 2 Fe + S → FeS 1) Данная реакция протекает при нагревании. 2)
- 10. Реакция соединения- реакция, в результате которой из двух или нескольких простых или сложных веществ образуется одно
- 11. Что общего в данных реакциях? Zn + 2HCl = ZnCl2 + H2↑ H2 + CuO =
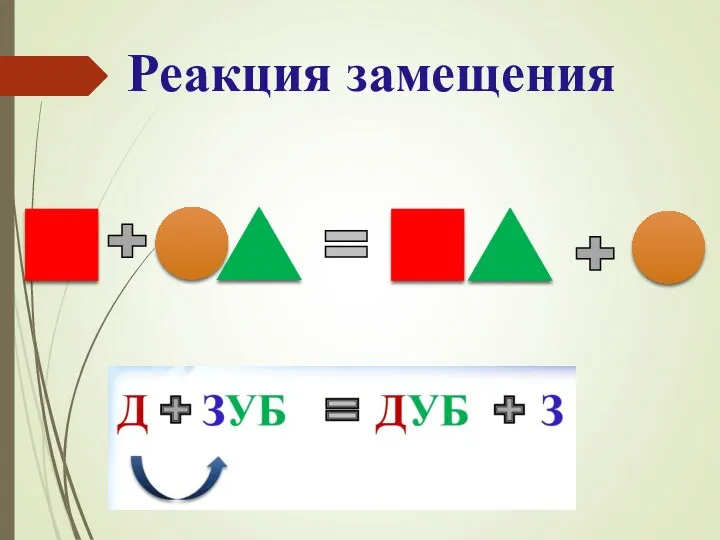
- 12. Лабораторный опыт № 3 ↓ Fe + CuSO4 → FeSO4 + Cu Синий раствор Зеленый раствор
- 13. Реакция замещения- реакция между простым и сложным веществами, в результате которой атомы простого вещества замещают атомы
- 14. Реакция разложения
- 15. Реакция соединения
- 16. Реакция замещения
- 17. http://videouroki.net/look/superfizmin/index.html
- 18. http://files.school-collection.edu.ru/dlrstore/617fb4bc-8cff-11db-b606-0800200c9a66/ch08_29_01.swf Интерактив «Реакции разложения»
- 19. Интерактив «Реакции соединения» http://files.school-collection.edu.ru/dlrstore/617fb4c0-8cff-11db-b606-0800200c9a66/ch08_30_01.swf
- 20. Интерактив «Реакции замещения» http://files.school-collection.edu.ru/dlrstore/617fb4c4-8cff-11db-b606-0800200c9a66/ch08_31_01.swf
- 21. 1) Al + H2SO4 = 2) Zn + O2 = 3) Fe + HCl = 4)
- 22. Рефлексия Оцените свою работу на уроке с позиции: Я научился (ась) … Я узнал (а) …
- 23. § 21. Химия. 8 класс. Электронное приложение к учебнику Г.Е. Рудзитиса, Ф.Г. Фельдмана. – М.: Просвещение,
- 25. Скачать презентацию



















 Иондық байланыс
Иондық байланыс Щелочные металлы
Щелочные металлы Камень чароит
Камень чароит Основные особенности композитов по сравнению с традиционными материалами
Основные особенности композитов по сравнению с традиционными материалами Гидроксид железа
Гидроксид железа Методические проблемы преподавания органической химии и ее основные теоретические понятия
Методические проблемы преподавания органической химии и ее основные теоретические понятия Предмет, история и задачи геохимии, положение среди других наук
Предмет, история и задачи геохимии, положение среди других наук Общая характеристика неметаллов
Общая характеристика неметаллов Классификация и номенклатура органических соединений
Классификация и номенклатура органических соединений Фенол қосылыстары
Фенол қосылыстары Алкадиены. Гомологический ряд, номенклатура и изомерия
Алкадиены. Гомологический ряд, номенклатура и изомерия Особенности выбора связующих и наполнителей для производства деталей машин из ПКМ
Особенности выбора связующих и наполнителей для производства деталей машин из ПКМ Реакции ионного обмена между растворами электролитов
Реакции ионного обмена между растворами электролитов Классификация химических реакций
Классификация химических реакций Этот многоликий цинк
Этот многоликий цинк Аллотропия
Аллотропия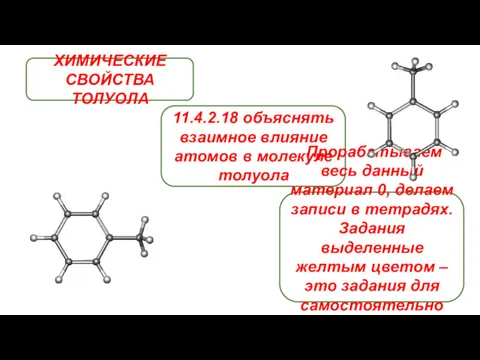 Химические свойства толуола
Химические свойства толуола Обмоточные провода
Обмоточные провода Периодические системы химических элементов
Периодические системы химических элементов Барий. Щелочноземельные металлы
Барий. Щелочноземельные металлы Ароматические кислоты фенолокислоты
Ароматические кислоты фенолокислоты Изучение раздела Углеводороды в курсе органической химии в старшей школе
Изучение раздела Углеводороды в курсе органической химии в старшей школе Синтез олиголактозаминов – лигандов галектинов
Синтез олиголактозаминов – лигандов галектинов Білки (протеїни)
Білки (протеїни) Химиялық реакция белгілерін атаңыз
Химиялық реакция белгілерін атаңыз Электрофоретические и хроматографические методы
Электрофоретические и хроматографические методы Основания. 8 класс
Основания. 8 класс Производство серной кислоты контактным способом
Производство серной кислоты контактным способом