Содержание
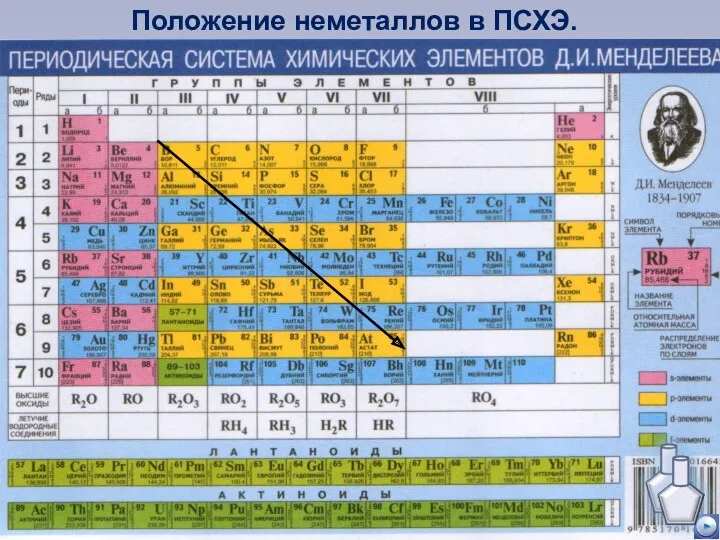
- 2. Положение неметаллов в ПСХЭ.
- 3. Небольшой атомный радиус (в сравнении с радиусами атомов-металлов одного с ними периода). Большее число электронов на
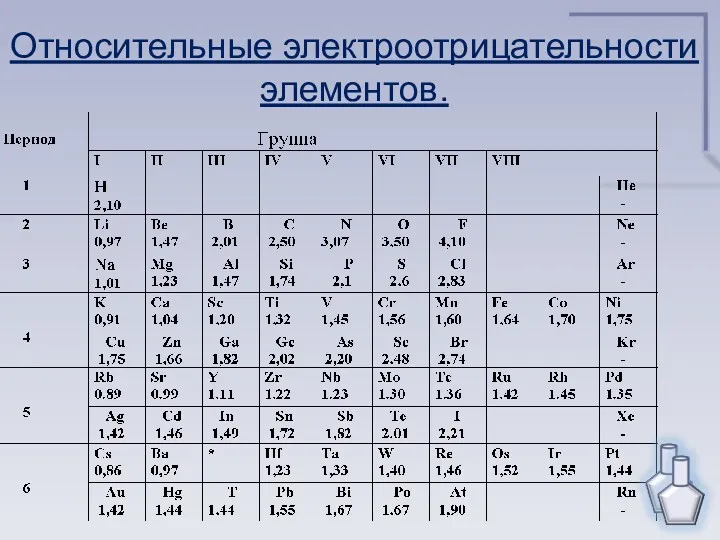
- 4. Электроотрицательность – это свойство атомов химических элементов поляризовать химическую связь, оттягивать к себе общие электронные пары
- 5. Относительные электроотрицательности элементов.
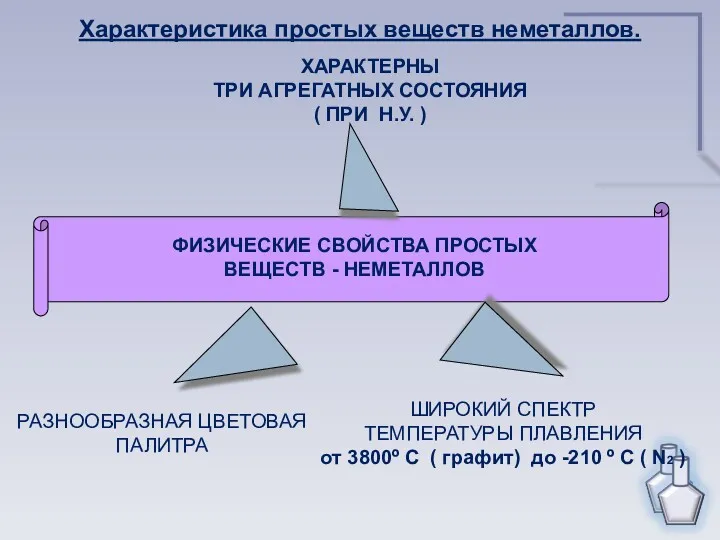
- 6. ФИЗИЧЕСКИЕ СВОЙСТВА ПРОСТЫХ ВЕЩЕСТВ - НЕМЕТАЛЛОВ ХАРАКТЕРНЫ ТРИ АГРЕГАТНЫХ СОСТОЯНИЯ ( ПРИ Н.У. ) РАЗНООБРАЗНАЯ ЦВЕТОВАЯ
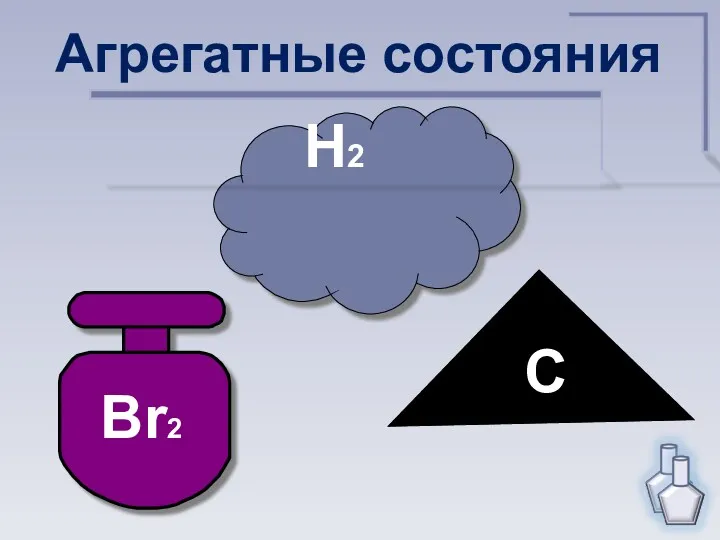
- 7. Br2 H2 С Агрегатные состояния
- 8. А З О Т Й О Д С Е Р А Х Л О Р ФОСФОР
- 9. ? ? ? В чем причина разнообразия физических свойств у неметаллов ?
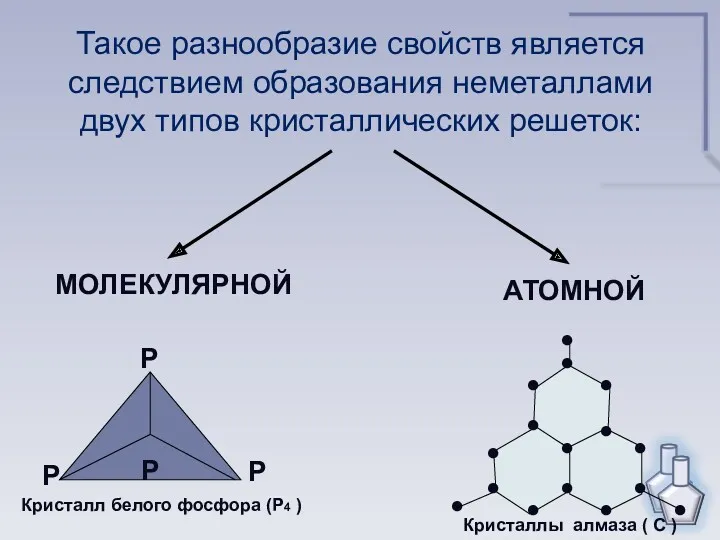
- 10. Такое разнообразие свойств является следствием образования неметаллами двух типов кристаллических решеток: МОЛЕКУЛЯРНОЙ АТОМНОЙ Р Р Р
- 11. Аллотропия – это способность одного и того же химического элемента образовывать несколько простых веществ. Что такое
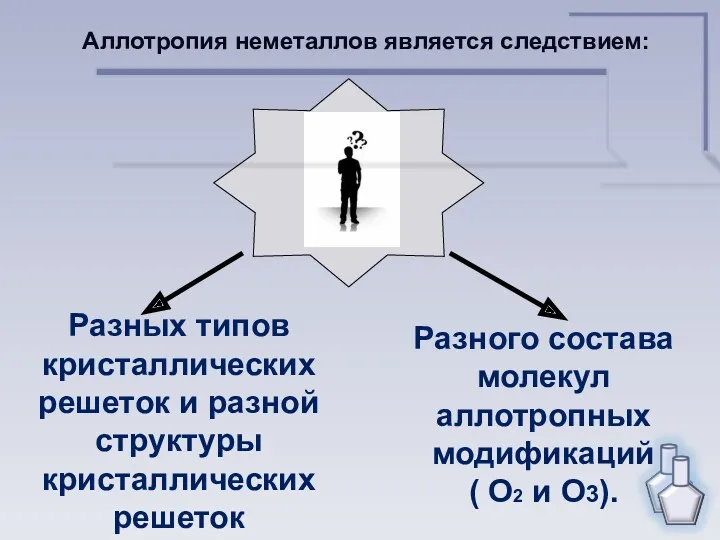
- 12. Каковы причины аллотропии неметаллов?
- 13. Разных типов кристаллических решеток и разной структуры кристаллических решеток Разного состава молекул аллотропных модификаций ( О2
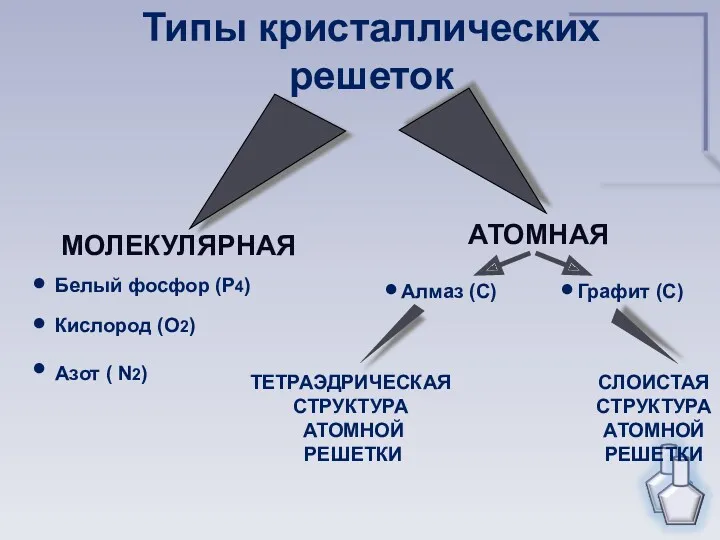
- 14. МОЛЕКУЛЯРНАЯ АТОМНАЯ Типы кристаллических решеток ТЕТРАЭДРИЧЕСКАЯ СТРУКТУРА АТОМНОЙ РЕШЕТКИ СЛОИСТАЯ СТРУКТУРА АТОМНОЙ РЕШЕТКИ
- 15. А Л М А З
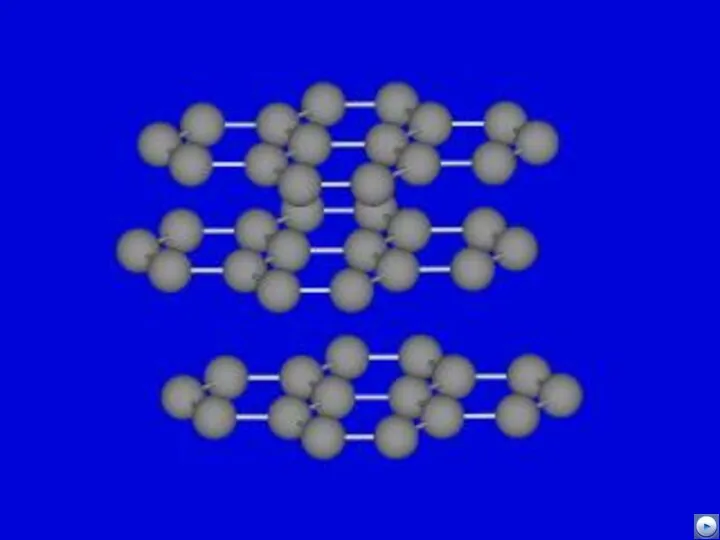
- 17. Г Р А Ф И Т
- 20. Скачать презентацию









 Ферум та його сполуки
Ферум та його сполуки Көмірсутектерді пиролиздеу арқылы қарапайым олефиндерді алу
Көмірсутектерді пиролиздеу арқылы қарапайым олефиндерді алу Керамические материалы
Керамические материалы Гидрокси(окси) кислоты
Гидрокси(окси) кислоты Прикладная геохимия. Первичные ореолы
Прикладная геохимия. Первичные ореолы Закон триад. Открытие периодического закона
Закон триад. Открытие периодического закона Пестициды. Применение пестицидов
Пестициды. Применение пестицидов Фенол и его свойства
Фенол и его свойства Хром. Строение атома
Хром. Строение атома 20230321_obobshchenie_po_elektroliticheskoy_dissotsiatsii
20230321_obobshchenie_po_elektroliticheskoy_dissotsiatsii Основные положения теории растворов электролитов, используемых в аналитической химии
Основные положения теории растворов электролитов, используемых в аналитической химии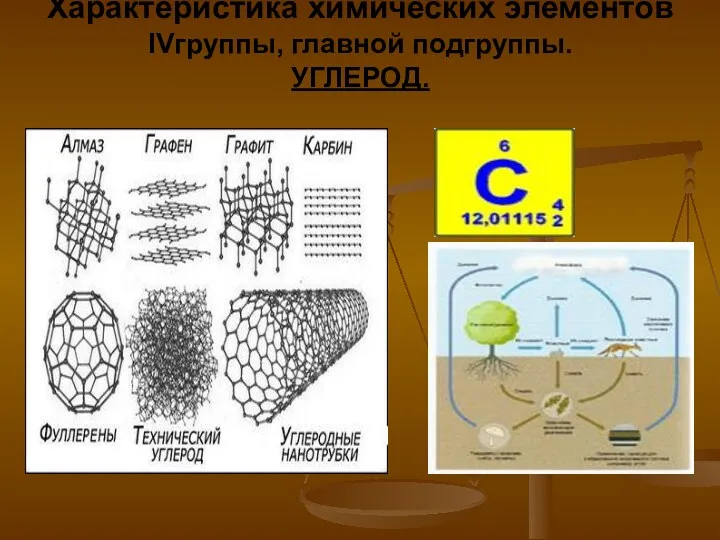 Характеристика химических элементов IV группы, главной подгруппы. Углерод
Характеристика химических элементов IV группы, главной подгруппы. Углерод Алкины. Ацетилен.
Алкины. Ацетилен. Драгоценные камни
Драгоценные камни Элемент свинец Рb
Элемент свинец Рb Химическая технология природных энергоносителей и углеродных материалов
Химическая технология природных энергоносителей и углеродных материалов Силикаты. Слюды. Тальк. Фосфаты. Апатит. Крокоит
Силикаты. Слюды. Тальк. Фосфаты. Апатит. Крокоит Материаловедение. Основные задачи материаловедения
Материаловедение. Основные задачи материаловедения Методика преподавания химии
Методика преподавания химии Тепловой эффект химической реакции, термохимические уравнения, экзо- и эндотермические реакции
Тепловой эффект химической реакции, термохимические уравнения, экзо- и эндотермические реакции Признаки химических реакций. (Практическая работа 5,4)
Признаки химических реакций. (Практическая работа 5,4) Современные методы образования амидной связи с использованием ацилгалогенидов, ангидридов, активированных эфиров и их аналогов
Современные методы образования амидной связи с использованием ацилгалогенидов, ангидридов, активированных эфиров и их аналогов Основания. Степени окисления элементов в соединениях
Основания. Степени окисления элементов в соединениях Магматические горные породы
Магматические горные породы Генетическая связь между основными классами неорганических веществ
Генетическая связь между основными классами неорганических веществ Классификация химических реакций по различным основаниям. 9 класс
Классификация химических реакций по различным основаниям. 9 класс Материаловедение. Силикатные материалы
Материаловедение. Силикатные материалы Органическая химия
Органическая химия