Содержание
- 2. История создания В 1840 Ю.Ф.Фрицше обнаружил, что при нагревании с щелочью синяя окраска индиго исчезает и
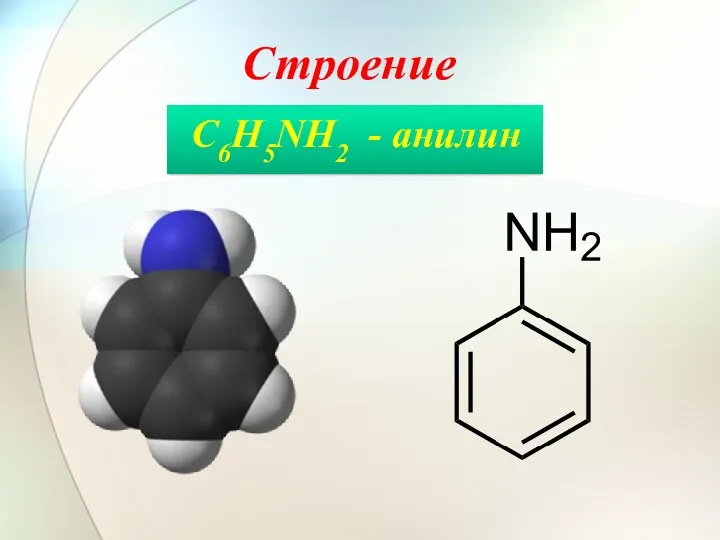
- 3. Строение C6H5NH2 - анилин
- 4. Физические свойства Анилин - бесцветная маслянистая жидкость. Немного тяжелее воды, малорастворим в ней. Хорошо растворяется в
- 5. В промышленности анилин получают в две стадии. На первой стадии бензол нитруется смесью концентрированной азотной и
- 6. Другим способом получение анилина является восстановление нитросоединений- Реакция Зинина: C6H5NO2 + 3(NH4)2S → C6H5NH2 + 6NH3
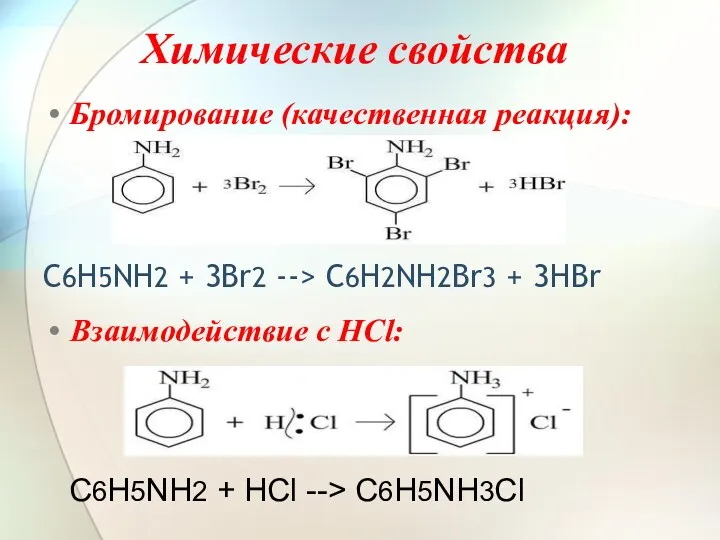
- 7. Химические свойства Бромирование (качественная реакция): C6H5NH2 + 3Br2 --> C6H2NH2Br3 + 3HBr Взаимодействие с HCl: C6H5NH2
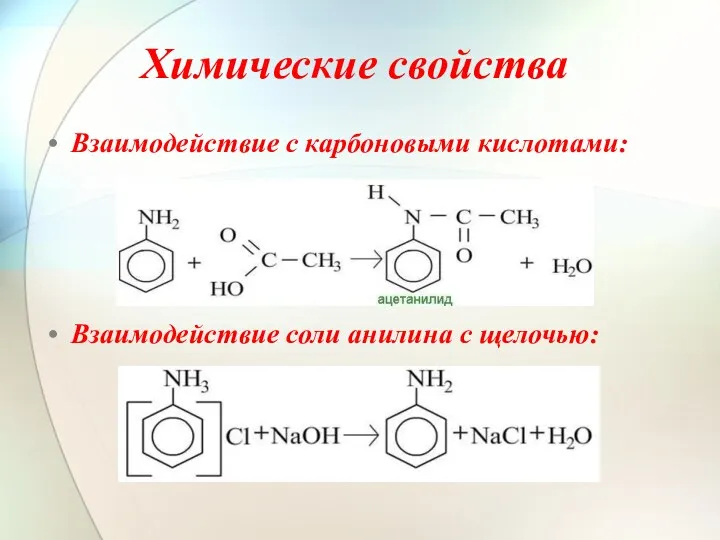
- 8. Химические свойства Взаимодействие с карбоновыми кислотами: Взаимодействие соли анилина с щелочью:
- 9. Анилин+соляная кислота
- 10. Окисление анилина раствором хлорной извести
- 11. Применение В настоящий момент в мире основная часть (85%) производимого анилина используется для производства метилдиизоционатов (MDI),
- 13. Скачать презентацию







 Соединения химических элементов. Урок-игра. 8 класс
Соединения химических элементов. Урок-игра. 8 класс Комплексонометрия – метод количественного титриметрического анализа
Комплексонометрия – метод количественного титриметрического анализа Экстракционные методы выделения продуктов микробиологического синтеза
Экстракционные методы выделения продуктов микробиологического синтеза Химическая связь
Химическая связь Общая характеристика и источники сырья производств основного органического и нефтехимического синтеза. Лекция № 5-6
Общая характеристика и источники сырья производств основного органического и нефтехимического синтеза. Лекция № 5-6 большая стирка
большая стирка Алкадиены. Гомологический ряд, номенклатура и изомерия
Алкадиены. Гомологический ряд, номенклатура и изомерия Химическая связь
Химическая связь Бор шикізатын қышқылдық ыдырату
Бор шикізатын қышқылдық ыдырату Ароматические соединения - арены
Ароматические соединения - арены Водородная связь
Водородная связь Электролиты и неэлектролиты. Катионы и анионы. Электролитическая диссоциация кислот, щелочей и солей
Электролиты и неэлектролиты. Катионы и анионы. Электролитическая диссоциация кислот, щелочей и солей Атомный и ионный радиусы. Принципы шаровых упаковок
Атомный и ионный радиусы. Принципы шаровых упаковок Азот и его соединения
Азот и его соединения Технология оптического стекла
Технология оптического стекла Современная химия. (Лекция 6)
Современная химия. (Лекция 6) Электрохимические процессы
Электрохимические процессы Простые вещества
Простые вещества Кислород
Кислород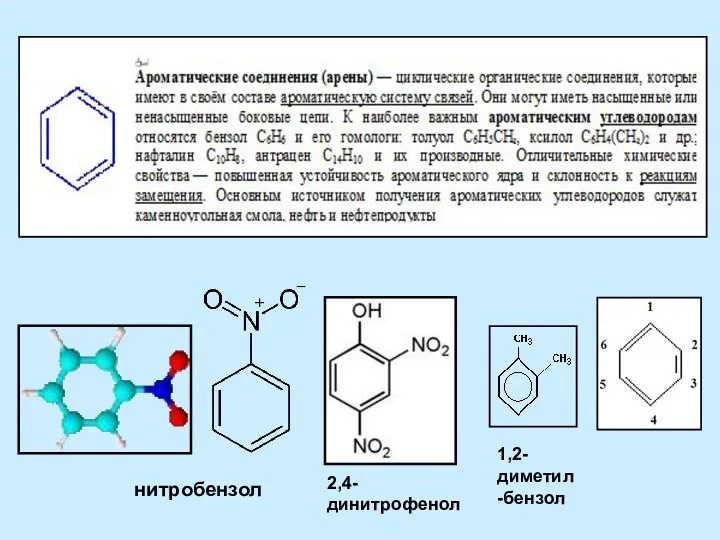 Ароматические соединения (арены)
Ароматические соединения (арены) Алкалоидтар
Алкалоидтар Лекция 2. Строение атома и Периодический закон Д.И. Менделеева
Лекция 2. Строение атома и Периодический закон Д.И. Менделеева Тепловой эффект химических реакций. 8 класс
Тепловой эффект химических реакций. 8 класс Периодический закон и периодическая система химических элементов Д.И. Менделеева
Периодический закон и периодическая система химических элементов Д.И. Менделеева Общая характеристика твердого, жидкого и газообразного видов топлива
Общая характеристика твердого, жидкого и газообразного видов топлива Химия в строительстве
Химия в строительстве Кислотные и основные свойства органических соединений
Кислотные и основные свойства органических соединений Углерод
Углерод