Содержание
- 2. 1. ОБЩАЯ ХАРАКТЕРИСТИКА ЭЛЕМЕНТА «КИСЛОРОД» Химический знак О Положение в ПСХЭ период II, группа VIА, порядковый
- 3. 14.03.2021 Кислород как элемент. 1. Элемент кислород находится в VI группе, главной подгруппе, II периоде, порядковый
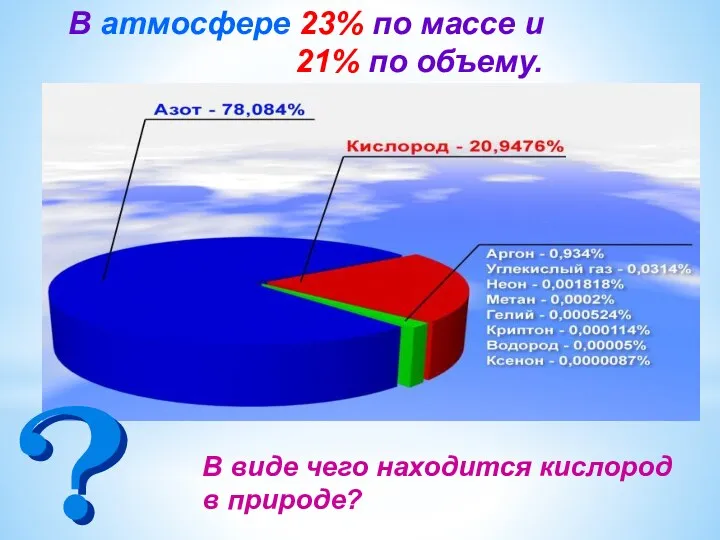
- 4. 14.03.2021 Кислород как элемент. 4. В земной коре его 49% по массе, в гидросфере – 89%
- 5. В атмосфере 23% по массе и 21% по объему. В виде чего находится кислород в природе?
- 6. 14.03.2021 Физические свойства Газ - без цвета, вкуса и запаха; в 100V H2O растворяется 3V O2
- 7. 2. РАСПРОСТРАНЕНИЕ КИСЛОРОДА В ПРИРОДЕ Первое место по распространенности в земной коре, т.е. литосфере, занимает кислород
- 8. История открытия Карл Вильгельм Шееле (шведский химик) в 1772 году получил и детально исследовал «огненный воздух»,
- 9. История открытия Антуан Лавуазье в 1774 году провел эксперимент и доказал, что воздух состоит на 1/5
- 10. Аллотропные модификации кислорода О2 О3 О
- 11. Которое зовут озоном. И в этом есть большой резон: В грозу запахнет над газоном – От
- 12. 3. ФИЗИЧЕСКИЕ СВОЙСТВА КИСЛОРОДА Кислород – газ, без цвета и запаха, мало растворим в воде (в
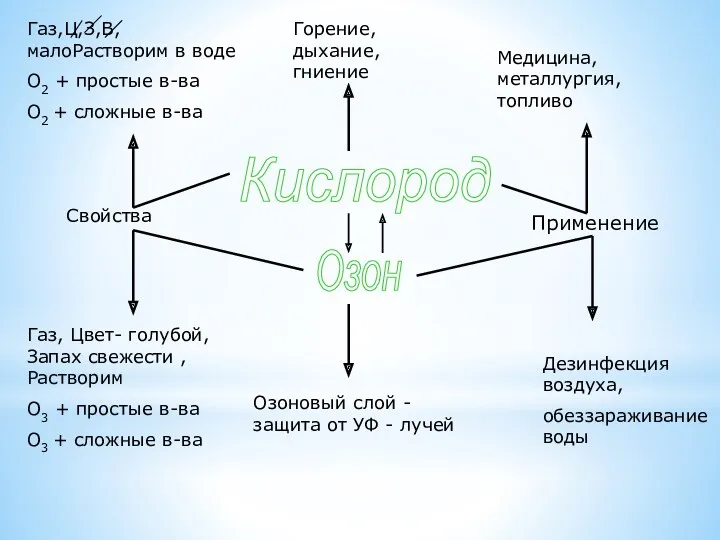
- 13. Кислород Озон Применение Свойства Озоновый слой - защита от УФ - лучей Газ,Ц,З,В, малоРастворим в воде
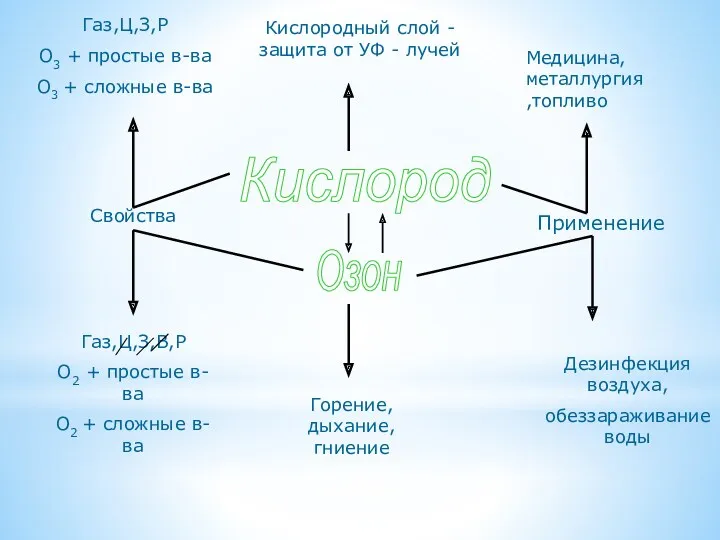
- 14. Найди и исправь ошибки
- 15. Кислород Озон Применение Свойства Кислородный слой - защита от УФ - лучей Газ,Ц,З,В,Р О2 + простые
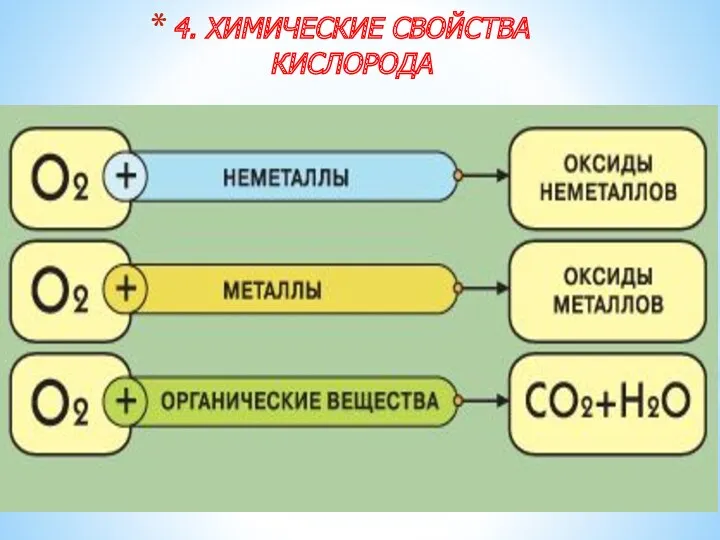
- 16. 4. ХИМИЧЕСКИЕ СВОЙСТВА КИСЛОРОДА
- 17. 14.03.2021 5 Химические свойства Взаимодействие веществ с кислородом называется окислением или горением С кислородом реагируют все
- 18. 14.03.2021 5 Химические свойства ОЗОН. 1. Неустойчив: O3 → O2 + O 2. Сильный окислитель: 2KI
- 19. ЗАДАНИЕ: СОСТАВЬТЕ УРАВНЕНИЯ ХИМИЧЕСКИХ РЕАКЦИЙ ГОРЕНИЯ, НАПРИМЕР, СЕРЫ (VI), НАТРИЯ, МЕТАНА (CH4). Проверьте себя. S +
- 20. 5. СПОСОБЫ ПОЛУЧЕНИЯ КИСЛОРОДА 1. В промышленности кислород получают из воздуха. Воздух представляет собой смесь различных
- 21. Джозеф Пристли (английский ученый) в 1774 году разложением оксида ртути (II) открыл кислород и изучил его
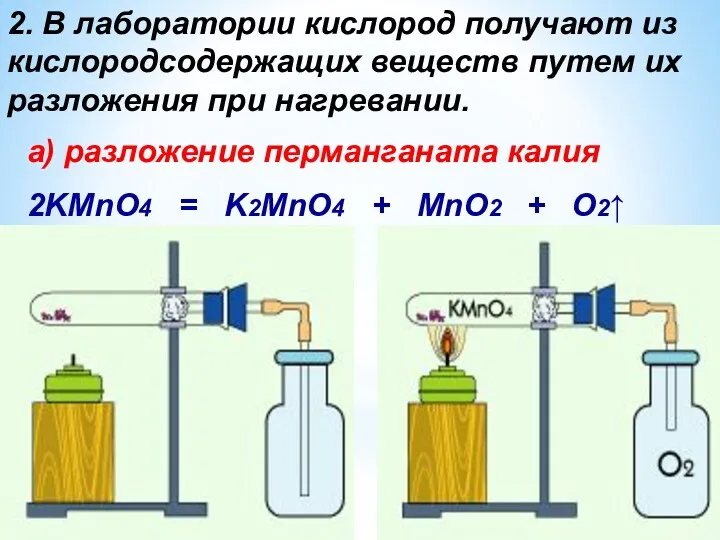
- 22. 2. В лаборатории кислород получают из кислородсодержащих веществ путем их разложения при нагревании. а) разложение перманганата
- 23. 14.03.2021 Способы получения кислорода (продолжение). Разложение этой соли идёт при нагревании её выше 2000 С. Нагрев
- 24. б) электролиз воды 2H2O = 2H2↑ + O2↑ в) разложение пероксида водорода 2H2O2 = 2H2O +
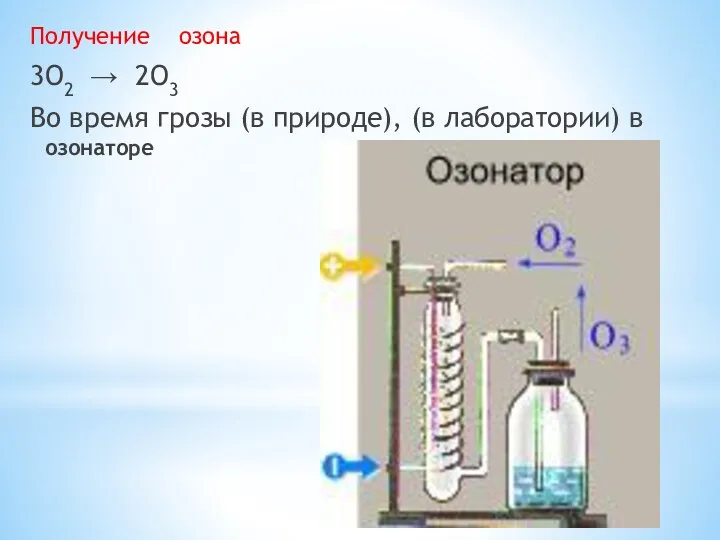
- 25. 14.03.2021 6 Получение озона 3O2 → 2O3 Во время грозы (в природе), (в лаборатории) в озонаторе
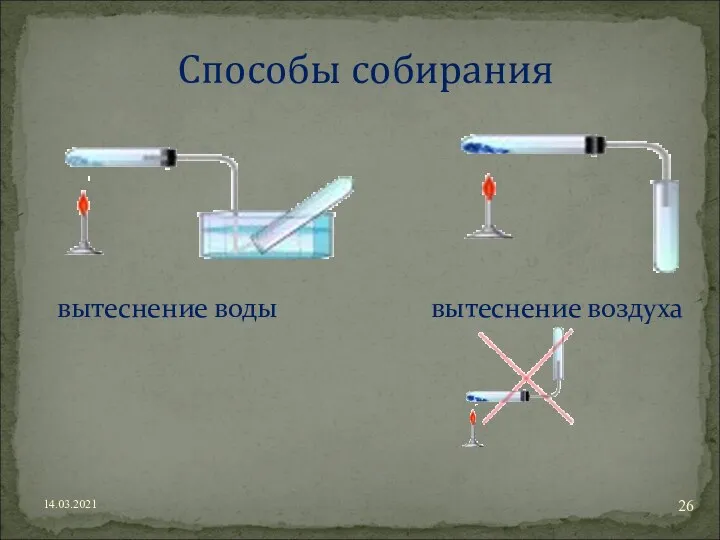
- 26. 14.03.2021 Способы собирания вытеснение воды вытеснение воздуха =
- 27. 14.03.2021 Применение кислорода:
- 28. 6. ПРИМЕНЕНИЕ КИСЛОРОДА ЧЕЛОВЕКОМ
- 29. 14.03.2021 Применение кислорода: Находит широкое применение в медицине и промышленности. При высотных полётах лётчиков снабжают специальными
- 30. . . Растения выделяют за год в атмосферу 400 млрд. тонн кислорода, усваивают 600 млрд. тонн
- 31. Установлено, что современный пассажирский самолет при полете в течение 9 часов расходует 50-75 т кислорода. Один
- 32. Тест Кислород – бесцветный газ Кислород – двухвалентен Кислород – составная часть воздуха В лаборатории кислород
- 33. Какие процессы иллюстрируют данные уравнения? СН4 + О2 = ? + Н2О С9Н20 + О2 =
- 35. Скачать презентацию

























 Композиционные материалы
Композиционные материалы Биохимическая трансформация веществ (2)
Биохимическая трансформация веществ (2) Методы выращивания монокристаллов кремния. Сравнение. Сферы применения монокристаллов, выращенных различными методами
Методы выращивания монокристаллов кремния. Сравнение. Сферы применения монокристаллов, выращенных различными методами Особенность, или Закономерность в строении атомов элементов. Периодическая система химических элементов Д.И. Менделеева
Особенность, или Закономерность в строении атомов элементов. Периодическая система химических элементов Д.И. Менделеева Р-элементы IV Группы Периодической Системы
Р-элементы IV Группы Периодической Системы Польза и вред химического производства
Польза и вред химического производства Мир камня. Чувашский национальный музей
Мир камня. Чувашский национальный музей Свойства растворов электролитов
Свойства растворов электролитов Растворы электролитов. Ионизация воды и шкала рН
Растворы электролитов. Ионизация воды и шкала рН Вклад ученых-химиков в победу в Великой Отечественной войне
Вклад ученых-химиков в победу в Великой Отечественной войне Физико-химические свойства аммиака. Производство аммиака
Физико-химические свойства аммиака. Производство аммиака Происхождение химических элементов
Происхождение химических элементов Химические реакции. Закон сохранения массы веществ
Химические реакции. Закон сохранения массы веществ Химические формулы
Химические формулы Химическая промышленность
Химическая промышленность Строение атома углерода. Валентные состояния атома углерода
Строение атома углерода. Валентные состояния атома углерода Буферные растворы. Граф структуры. Теория электрической диссоциации. Химическое равновесие
Буферные растворы. Граф структуры. Теория электрической диссоциации. Химическое равновесие Приёмы обращения с лабораторным оборудованием и основы техники безопасности
Приёмы обращения с лабораторным оборудованием и основы техники безопасности Основные типы химический реакций
Основные типы химический реакций Процессы нитрования
Процессы нитрования Кондуктометрия. Кондуктометрия әдісі. Электрохимиялық әдістер
Кондуктометрия. Кондуктометрия әдісі. Электрохимиялық әдістер Кислородсодержащие органические соединения
Кислородсодержащие органические соединения Хімічна рівновага
Хімічна рівновага Растворы. Роль растворов в природе
Растворы. Роль растворов в природе Кислород. Электронное строение и свойства
Кислород. Электронное строение и свойства Молекулы и атомы
Молекулы и атомы Нефть
Нефть Ионная связь и степень окисления. 8 класс
Ионная связь и степень окисления. 8 класс