Содержание
- 2. Процессы нитрования Нитрующие агенты - азотная кислота и ее смеси с разными реагентами. Основные методы нитрования:
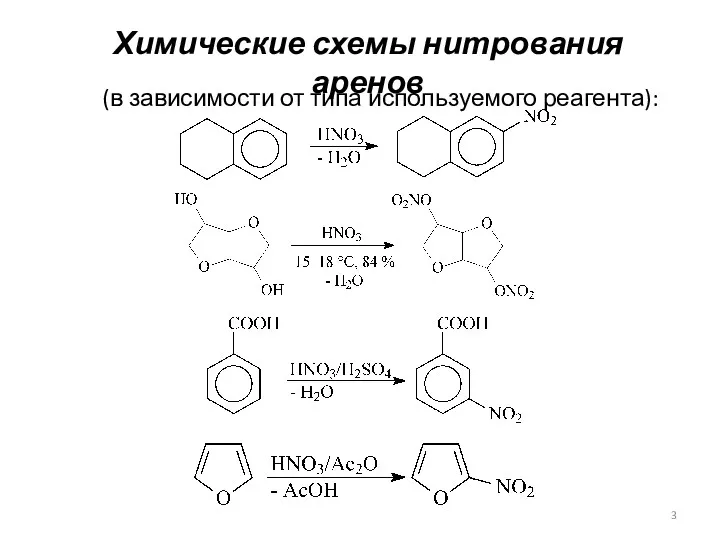
- 3. Химические схемы нитрования аренов (в зависимости от типа используемого реагента):
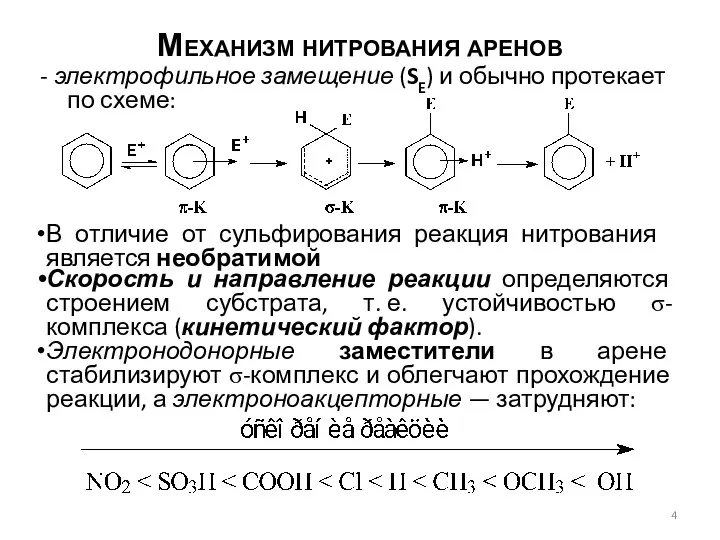
- 4. Механизм нитрования аренов - электрофильное замещение (SE) и обычно протекает по схеме: В отличие от сульфирования
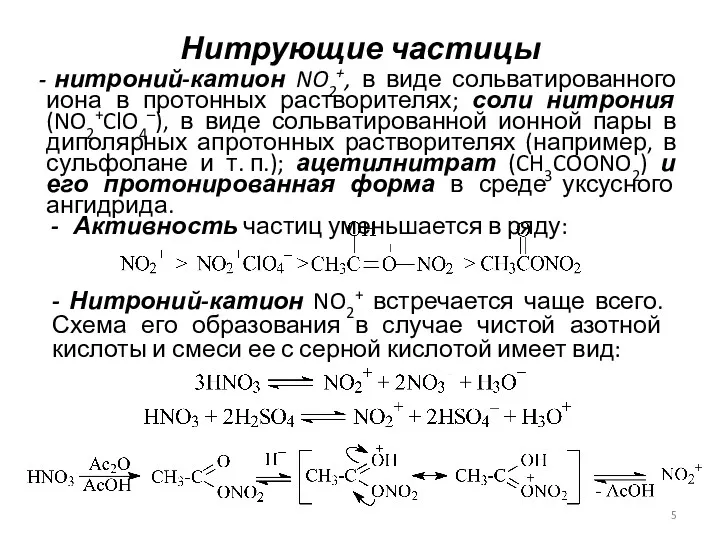
- 5. Нитрующие частицы нитроний-катион NO2+, в виде сольватированного иона в протонных растворителях; соли нитрония (NO2+ClO4–), в виде
- 6. 1. Влияние концентрации HNO3 на нитрование аренов Диссоциация азотная кислота идет по следующим схемам: Чем больше
- 7. Нитрование аренов в присутствии H2SO4 и уксусного ангидрида - Серная кислота в нитрующих смесях способствует образованию
- 8. 2.Модуль ванны - Этот параметр реакции связан с тем, что большинство процессов нитрования являются гетерогенными. Модуль
- 9. 3. Интенсивность перемешивания гетерогенной массы(vпер) ↑ vпер → ↑ Sр.ф. → ↑vдиф. → ↑vр., до vдиф.
- 10. 4.Влияние температуры на скорость реакции Температурный коэффициент константы скорости нитрования около 3 (при сульфировании 1,5—2), т.
- 11. Особенности теплового режима процесса нитрования. А)Тепловой эффект - Теплота реакции 150 кДж/моль (примерно такая же, как
- 12. Б)Отвод тепла процесса нитрования Для увеличения скорости отвода тепла, а, следовательно, уменьшения времени процесса - предварительно
- 13. В.Порядок слива компонентов Прямой – к субстрату приливают нитрующую смесь: мононитронитрование, азотная кислота используется полностью; комплексы
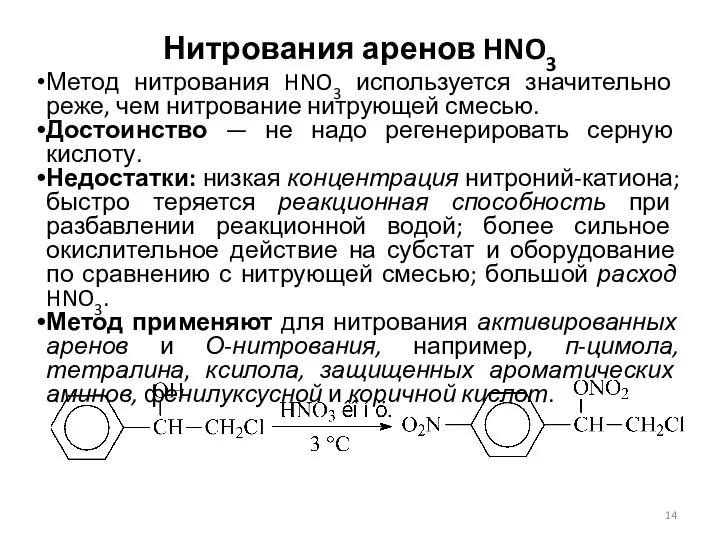
- 14. Нитрования аренов HNO3 Метод нитрования HNO3 используется значительно реже, чем нитрование нитрующей смесью. Достоинство — не
- 15. Совершенствование нитрования аренов HNO3 Устранение недостатков (увеличение концентрации NO2+, и уменьшение окислительных свойств кислоты): чем выше
- 16. Нитрование смесью азотной и серной кислот - отличаются универсальностью и большой активностью, которая сохраняется до конца
- 17. Схема приготовления нитрующей смеси - включает аппаратуру для отмеривания, смешения и хранения приготовленных смесей: Смеситель -
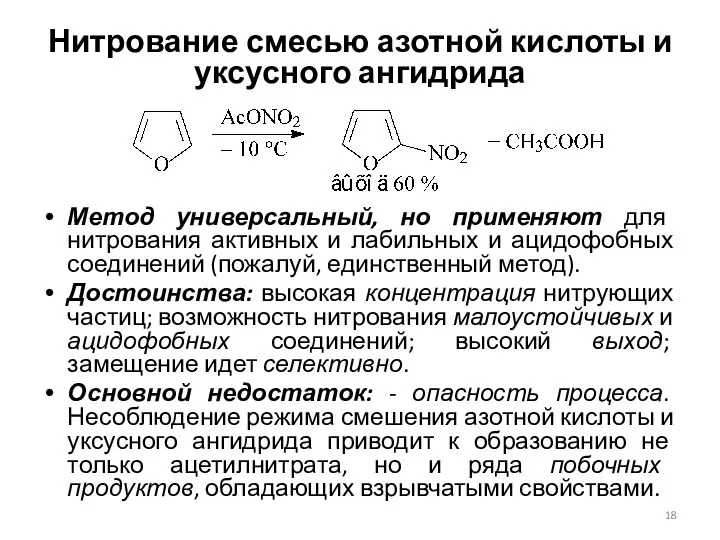
- 18. Нитрование смесью азотной кислоты и уксусного ангидрида Метод универсальный, но применяют для нитрования активных и лабильных
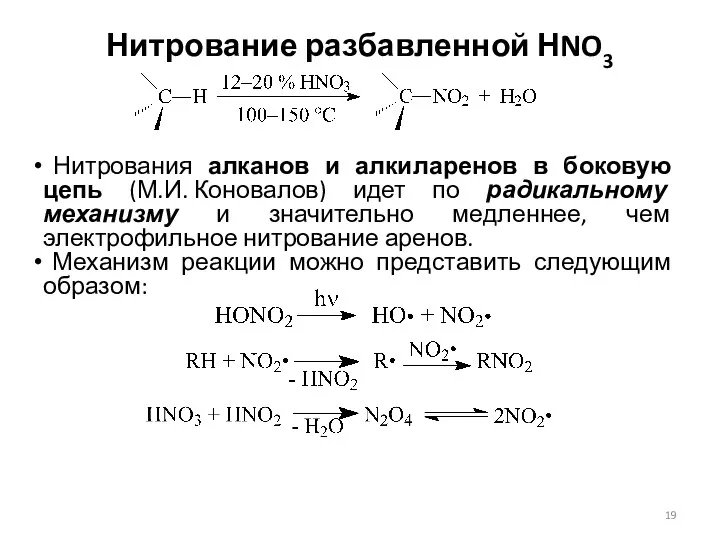
- 19. Нитрование разбавленной НNO3 Нитрования алканов и алкиларенов в боковую цепь (М.И. Коновалов) идет по радикальному механизму
- 20. Нитрование по М.И.Коновалову Направление реакции и реакционная способность нитруемых соединений определяется устойчивостью образующихся радикалов, поэтому жирно-ароматические
- 22. Скачать презентацию













 Су қоймасындағы тіршілік үшін темірдің рөлі
Су қоймасындағы тіршілік үшін темірдің рөлі Общая теория протолитических равновесий и процессов. Буферные системы
Общая теория протолитических равновесий и процессов. Буферные системы Хроматографические методы в радиохимии
Хроматографические методы в радиохимии Гидролиз солей
Гидролиз солей Геохимия и космохимия: история возникновения и развития, основное содержание и задачи
Геохимия и космохимия: история возникновения и развития, основное содержание и задачи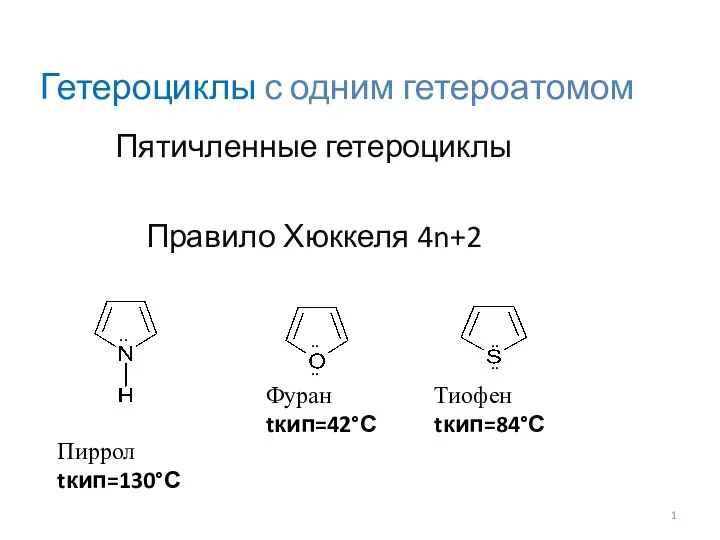 Гетероциклы с одним гетероатомом
Гетероциклы с одним гетероатомом Закон збереження маси речовини. Хімічні рівняння
Закон збереження маси речовини. Хімічні рівняння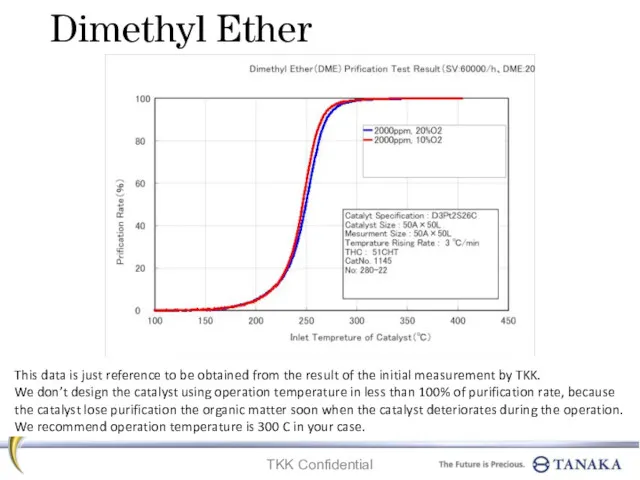 Dimethyl ether. Prification test result
Dimethyl ether. Prification test result Ионная связь и степень окисления. 8 класс
Ионная связь и степень окисления. 8 класс Амінокислоти. Класифікація та номенклатура
Амінокислоти. Класифікація та номенклатура Выращивание кристаллов в домашних условиях
Выращивание кристаллов в домашних условиях Теорія розвитку та припинення горіння
Теорія розвитку та припинення горіння Гидрирование пиробензина
Гидрирование пиробензина Новинки СН старт: июль 2016 Профессиональная химия PRO service
Новинки СН старт: июль 2016 Профессиональная химия PRO service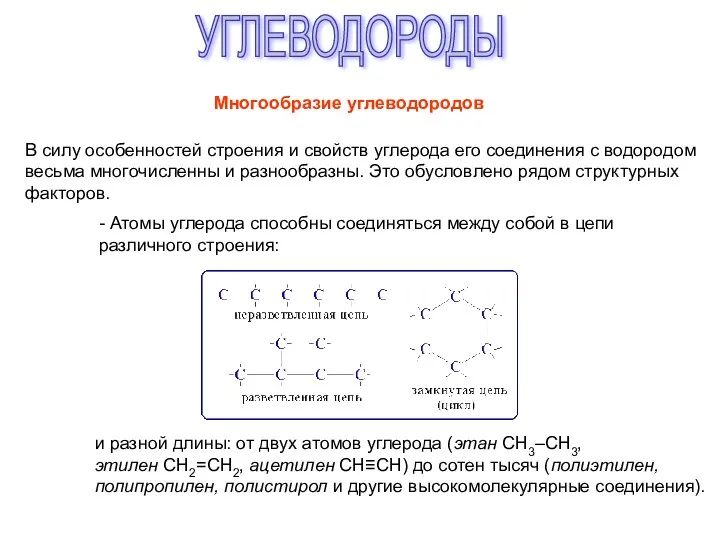 Углеводороды. Многообразие углеводородов
Углеводороды. Многообразие углеводородов Скорость химических реакций. Факторы, влияющие на скорость химической реакции (лекция № 5)
Скорость химических реакций. Факторы, влияющие на скорость химической реакции (лекция № 5) Прикладные аспекты химии поверхностно-активных веществ
Прикладные аспекты химии поверхностно-активных веществ Природные источники углеводородов
Природные источники углеводородов Вода как среда и участник протекания биохимических процессов в организме
Вода как среда и участник протекания биохимических процессов в организме Електроліти в сучасних акумуляторах
Електроліти в сучасних акумуляторах Арены. Бензол
Арены. Бензол Періодичний закон Д.І. Менделєєва. Структура періодичної системи
Періодичний закон Д.І. Менделєєва. Структура періодичної системи Алкены (олефины). 10 профиль. Лекция №1
Алкены (олефины). 10 профиль. Лекция №1 Лабораторные исследования состава и физико-химических свойств нефти
Лабораторные исследования состава и физико-химических свойств нефти Кислородсодержащие соединения серы. Оксиды, кислоты, соли
Кислородсодержащие соединения серы. Оксиды, кислоты, соли Электроотрицательность химических элементов
Электроотрицательность химических элементов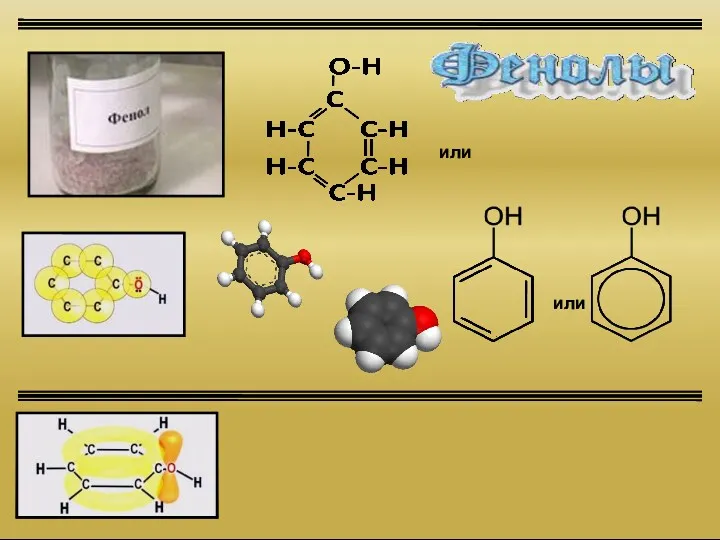 Фенолы
Фенолы Окислительно-восстановительные реакции (ОВР). Лекция 6
Окислительно-восстановительные реакции (ОВР). Лекция 6