Содержание
- 2. ЭЛЕКТРООТРИЦАТЕЛЬНОСТЬ ХИМИЧЕСКИХ ЭЛЕМЕНТОВ
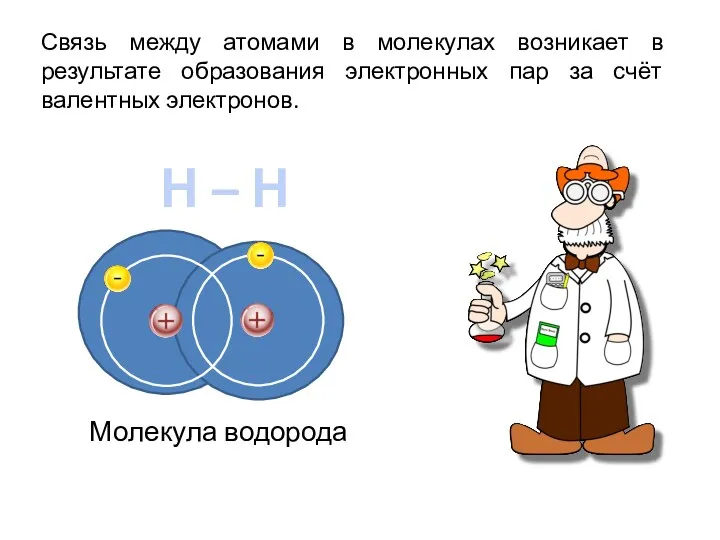
- 3. Связь между атомами в молекулах возникает в результате образования электронных пар за счёт валентных электронов. Н
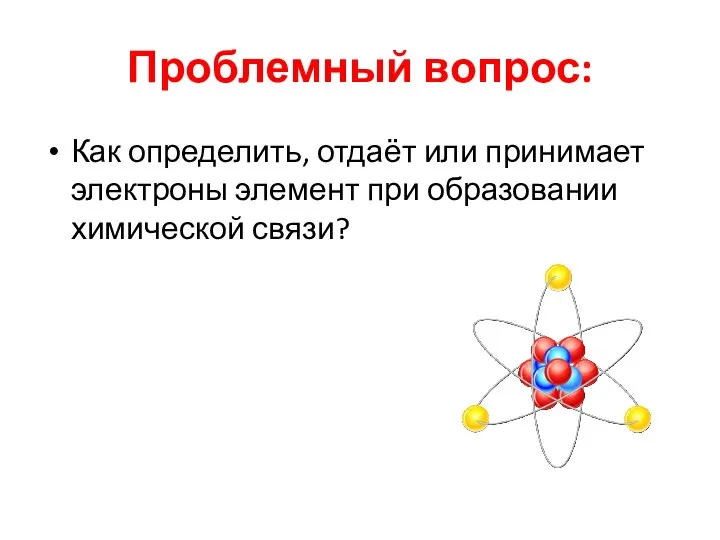
- 4. Проблемный вопрос: Как определить, отдаёт или принимает электроны элемент при образовании химической связи?
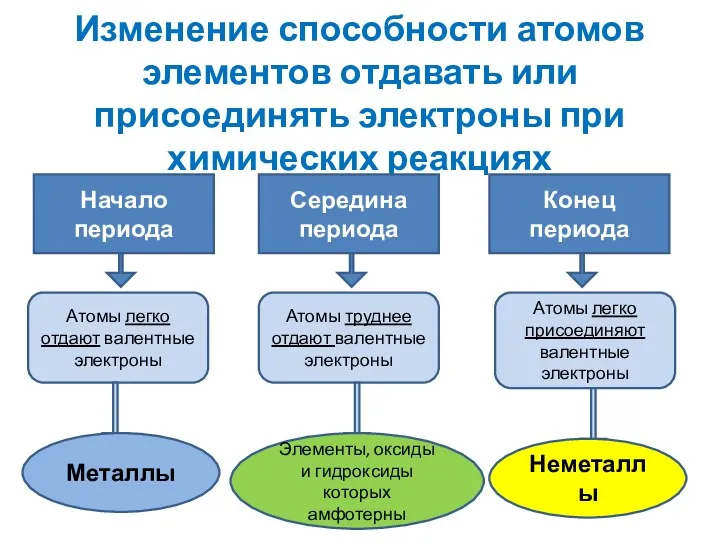
- 5. Изменение способности атомов элементов отдавать или присоединять электроны при химических реакциях Начало периода Середина периода Конец
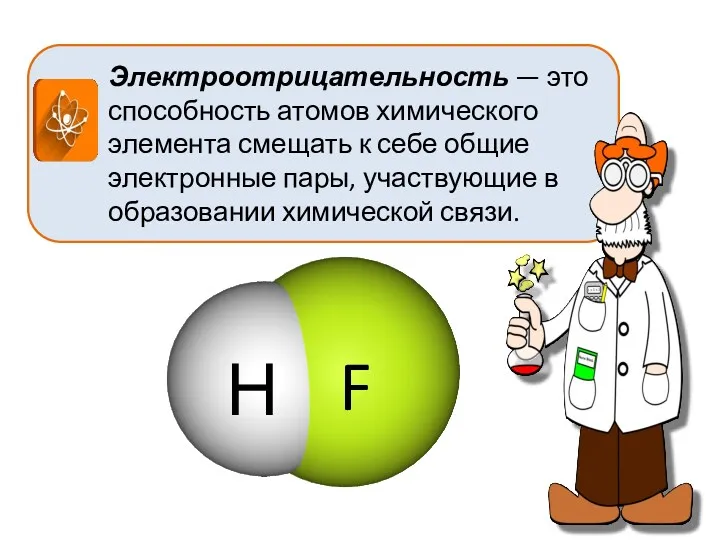
- 6. Электроотрицательность — это способность атомов химического элемента смещать к себе общие электронные пары, участвующие в образовании
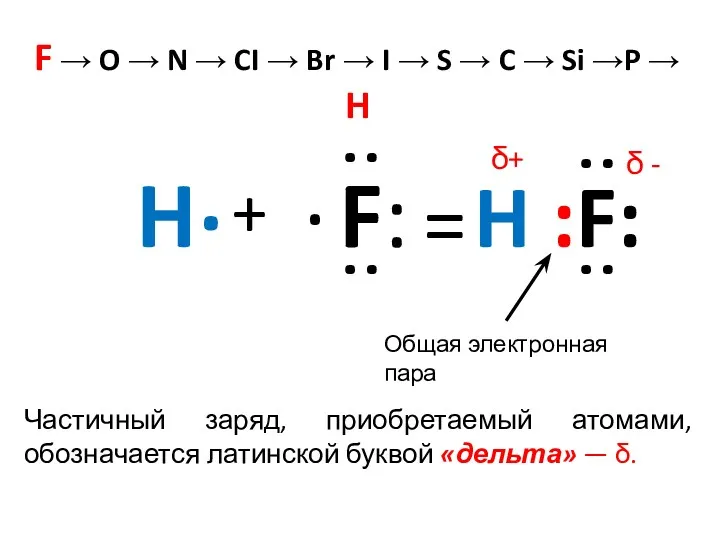
- 7. F → O → N → CI → Br → I → S → C →
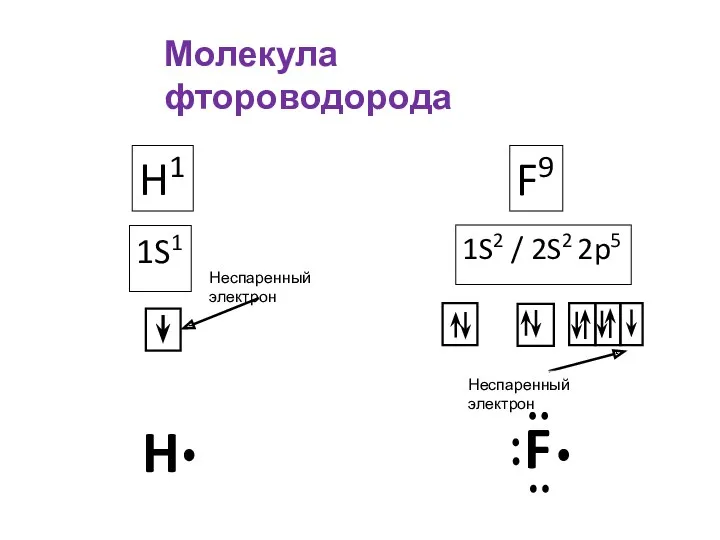
- 8. Молекула фтороводорода H1 1S1 F9 1S2 / 2S2 2p5 H F Неспаренный электрон Неспаренный электрон
- 9. H . + F: . : : = H :F: : : Общая электронная пара F
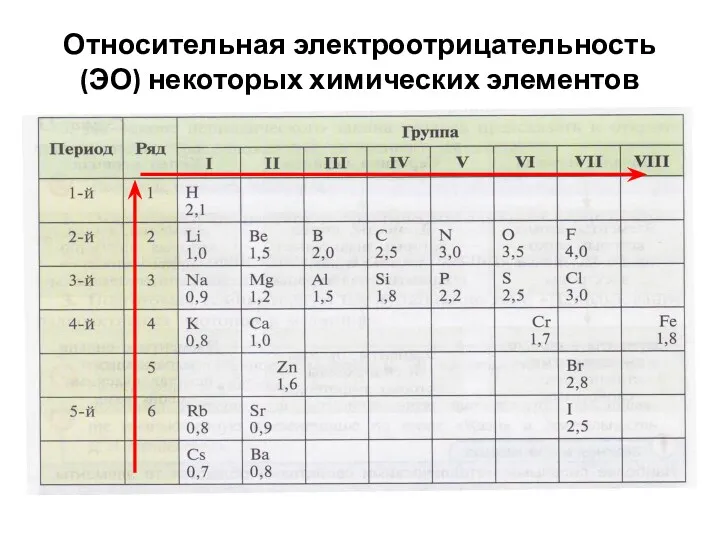
- 10. Относительная электроотрицательность (ЭО) некоторых химических элементов
- 11. Изменение электроотрицательности (ЭО) химических элементов: В периодах электроотрицательность (ЭО) увеличивается слева направо. В главных подгруппах (А-группах)
- 12. Выводы: Электроотрицательность (ЭО) – это важное свойство атомов химических элементов. Зная электроотрицательность (ЭО) элемента, можно определить
- 13. Подумай и ответь: А. Cs Б. H В. Br Г. F Д. O Какой из элементов
- 14. Проверь свои ответы: 1) А 2) Г 3) А, Б 4) В, Г 5) А Оцени
- 16. Скачать презентацию





 Ансамбль пор в реальном твердом теле
Ансамбль пор в реальном твердом теле Общие сведения о полезных ископаемых. (Лекция 2)
Общие сведения о полезных ископаемых. (Лекция 2) Aluminium
Aluminium Зеленая химия и проблемы устойчивого развития
Зеленая химия и проблемы устойчивого развития Химические реакторы. Гетерогенно-каталитические химические процессы. Лекция №15
Химические реакторы. Гетерогенно-каталитические химические процессы. Лекция №15 Бензо́л (C6H6, PhH)
Бензо́л (C6H6, PhH) Классы неорганических веществ
Классы неорганических веществ Заключительный урок в 8 классе Тест по химии.
Заключительный урок в 8 классе Тест по химии. Реакции ионного обмена
Реакции ионного обмена кл химия Классификация химических элементов
кл химия Классификация химических элементов Галогены. Получение и применение галогенов
Галогены. Получение и применение галогенов Жоғары молекулалық қосылыстар химиясы
Жоғары молекулалық қосылыстар химиясы Органолептические и визуальные методы идентификация полимера
Органолептические и визуальные методы идентификация полимера Форми періодичної системи хімічних елементів
Форми періодичної системи хімічних елементів Мыло. Синтетические моющие средства
Мыло. Синтетические моющие средства Каталитический риформинг
Каталитический риформинг Экстракция. Понятия в экстракции
Экстракция. Понятия в экстракции Методы определения вязкости жидкости
Методы определения вязкости жидкости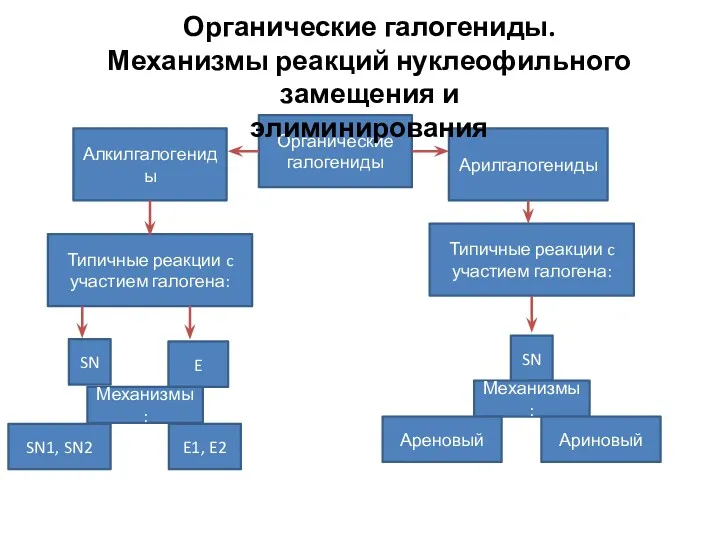
 Методы термического обезвреживания промышленных газов
Методы термического обезвреживания промышленных газов Геохимическая классификация элементов
Геохимическая классификация элементов Целлюлоза
Целлюлоза Электротехнический фарфор – разновидность твердого фарфора
Электротехнический фарфор – разновидность твердого фарфора Активированные кислородные метаболиты
Активированные кислородные метаболиты Количественный анализ. Гравиметрия
Количественный анализ. Гравиметрия Кислородсодержащие соединения серы
Кислородсодержащие соединения серы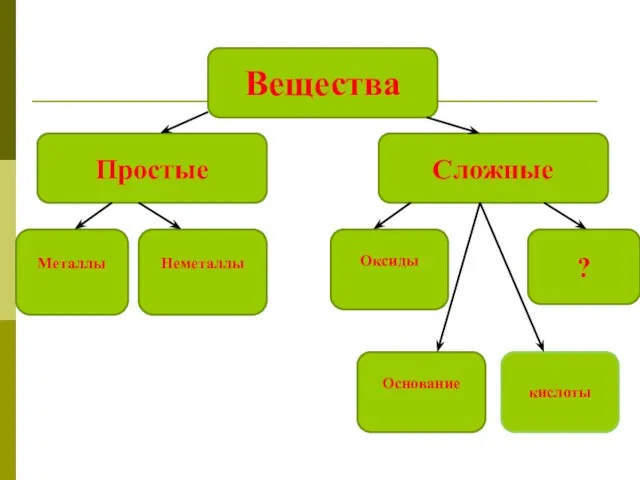 Соли, как производные кислот и оснований
Соли, как производные кислот и оснований Электрохимический ряд напряжений металлов. Свойства металлов
Электрохимический ряд напряжений металлов. Свойства металлов