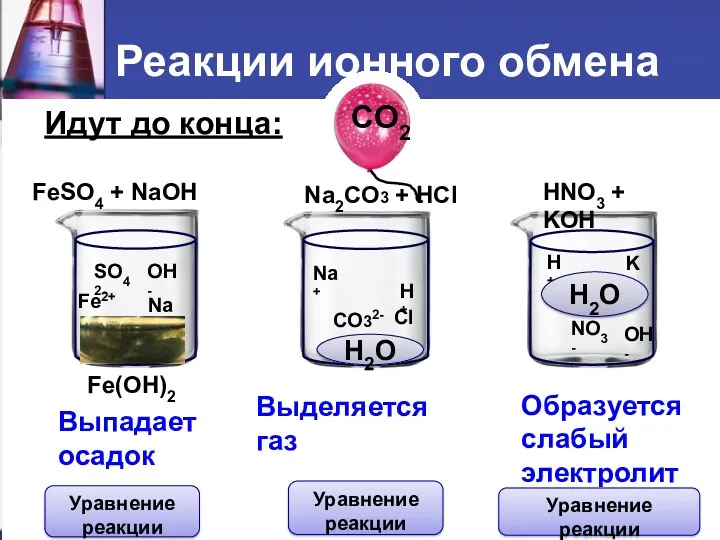
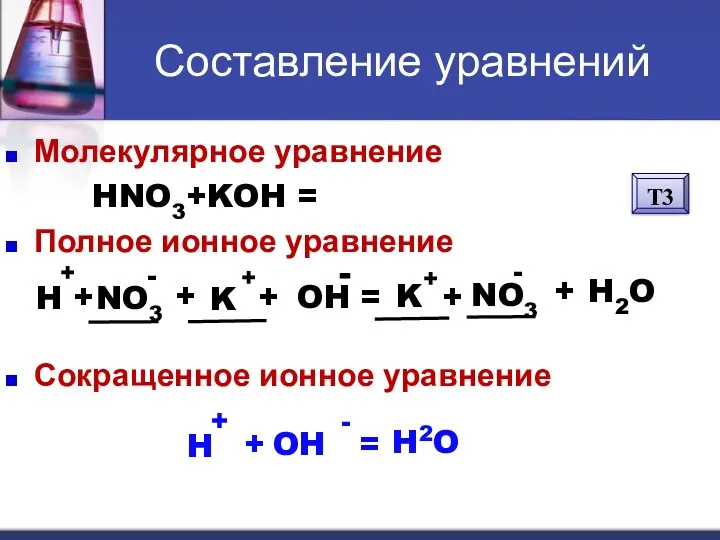
Алгоритм составления уравнений
Молекулярное уравнение
FeSO4+2NaOH = Fe(OH)2 + Na2SO4
Полное ионное уравнение
Сокращенное
ионное уравнение
Fe
2+
+
SO4
2-
+
2
Na
+
+
2
OH
-
=
Fe(OH)2
+
2
Na
+
+
SO4
2-
Fe
2+
+
2OH
-
=
Fe(OH)2
1.Записать уравнение реакции в
молекулярном виде
2.По таблице растворимости определить
растворимость каждого вещества
3.Составить полное ионное уравнение (записать
диссоциацию растворимых исходных веществ
и продуктов реакции)
4.Найти одинаковые ионы в левой и
правой частях, сократить их и записать
сокращенное ионное уравнение






 Что такое хорошо и что такое плохо, Или правила игры от очень строгой химички
Что такое хорошо и что такое плохо, Или правила игры от очень строгой химички Общие представления о фазовых состояниях и фазовых переходах полимеров
Общие представления о фазовых состояниях и фазовых переходах полимеров Катализ в органическом синтезе
Катализ в органическом синтезе Конденсация. Капельная и пленочная конденсация
Конденсация. Капельная и пленочная конденсация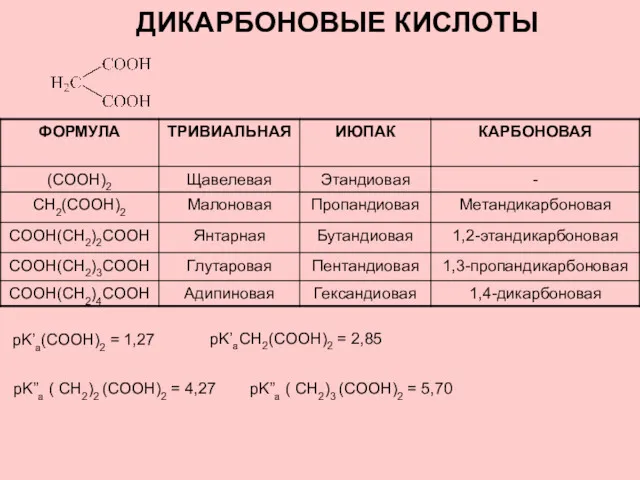 Дикарбоновые кислоты
Дикарбоновые кислоты Классификация химических веществ СГС
Классификация химических веществ СГС Нуклеофильное замещение галогена и других функциональных групп
Нуклеофильное замещение галогена и других функциональных групп Введение в органическую химию
Введение в органическую химию Алканы. Строение, номенклатура, изомерия, химические и физические свойства
Алканы. Строение, номенклатура, изомерия, химические и физические свойства Кислородные соединения серы. 2 часть
Кислородные соединения серы. 2 часть Химические формулы. Относительная молекулярная масса вещества
Химические формулы. Относительная молекулярная масса вещества Методы разделения смесей веществ
Методы разделения смесей веществ Отчет по исследовательской работе Образование АСПО
Отчет по исследовательской работе Образование АСПО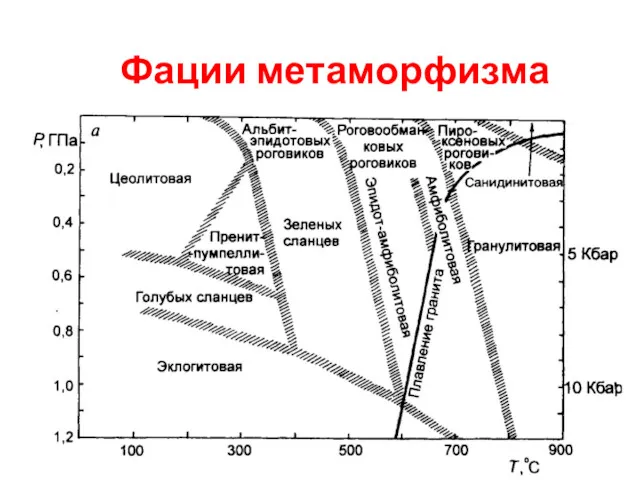 Фации метаморфизма
Фации метаморфизма Практическая работа. Химический состав клетки
Практическая работа. Химический состав клетки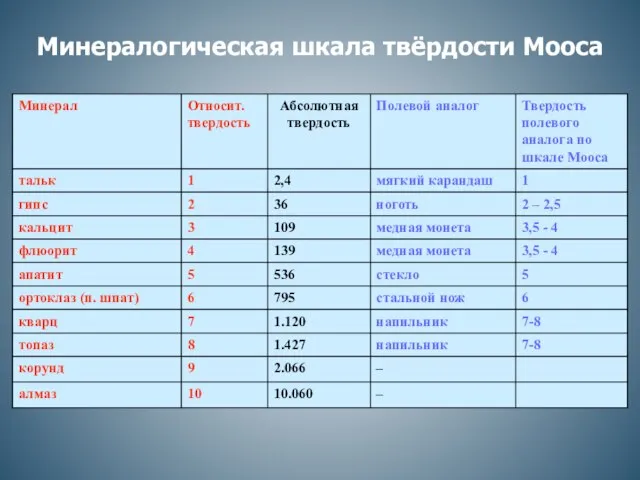 Минералогическая шкала твёрдости Мооса
Минералогическая шкала твёрдости Мооса Воздух и его состав. Урок-презентация. 8 класс
Воздух и его состав. Урок-презентация. 8 класс Теория электролитической диссоциации
Теория электролитической диссоциации Кислород
Кислород Химия и повседневная жизнь человека
Химия и повседневная жизнь человека Кристаллы. Формы
Кристаллы. Формы Электролитическая диссоциация. Гидролиз
Электролитическая диссоциация. Гидролиз Белки. Функции белков
Белки. Функции белков Сплавы металлов. 11 класс
Сплавы металлов. 11 класс Химические свойства. Оксиды, основания, кислоты и соли
Химические свойства. Оксиды, основания, кислоты и соли Целлюлоза
Целлюлоза Water
Water Методы оценки плотности и вязкости нефтей и нефтепродуктов
Методы оценки плотности и вязкости нефтей и нефтепродуктов