Содержание
- 2. КИСЛОТЫ
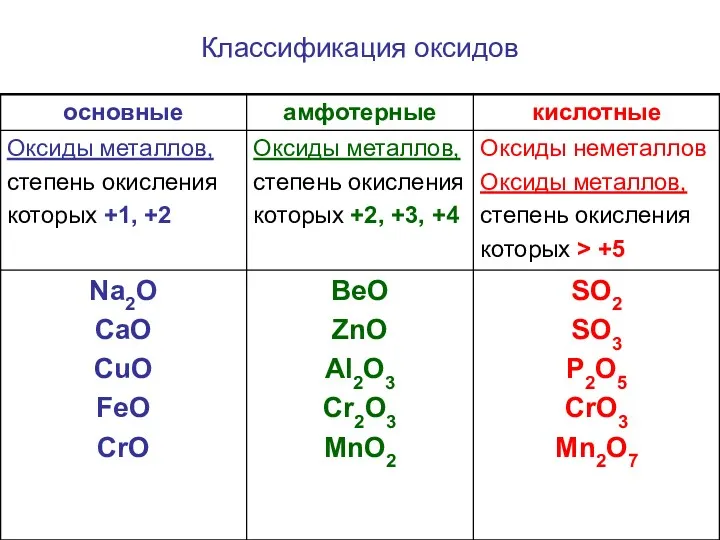
- 3. Классификация оксидов
- 4. 1. Кислотные свойства проявляет оксид: 1) SiO2 2) Al2O3 3) CO 4) BaO 3. Установите соответствие
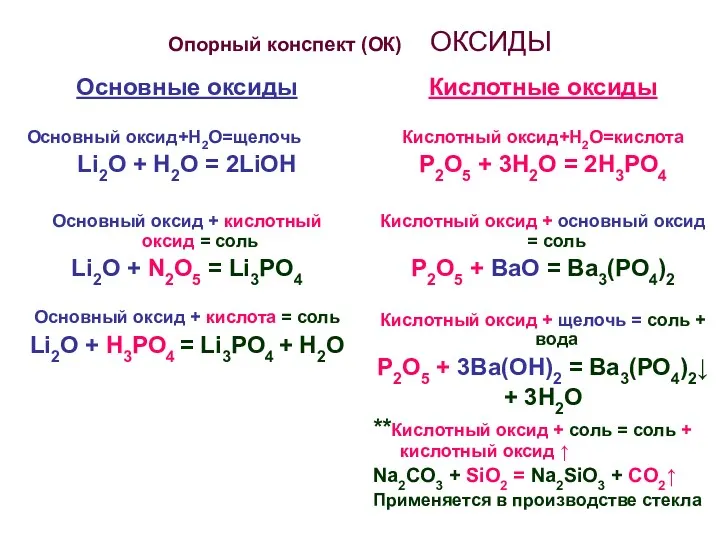
- 5. Опорный конспект (ОК) ОКСИДЫ Основные оксиды Основный оксид+Н2О=щелочь Li2O + H2O = 2LiOH Основный оксид +
- 6. Выберите из перечня веществ основный оксид. Напишите для него уравнения возможных реакций с перечисленными ниже веществами:
- 7. Выберите из перечня веществ кислотный оксид. Напишите для него уравнения возможных реакций с перечисленными ниже веществами:
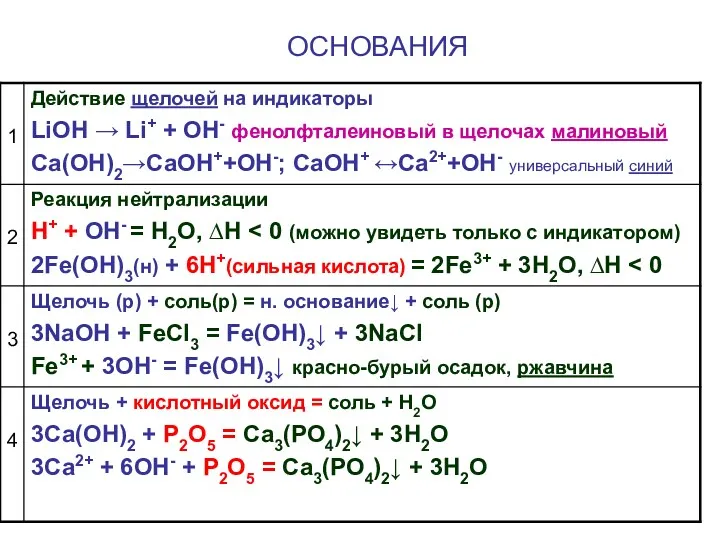
- 8. ОСНОВАНИЯ
- 9. Выберите из перечня веществ основание (щелочь). Напишите для него уравнения возможных реакций с перечисленными ниже веществами:
- 10. Выберите из перечня веществ кислоту Напишите для нее уравнения возможных реакций с перечисленными ниже веществами: вода,
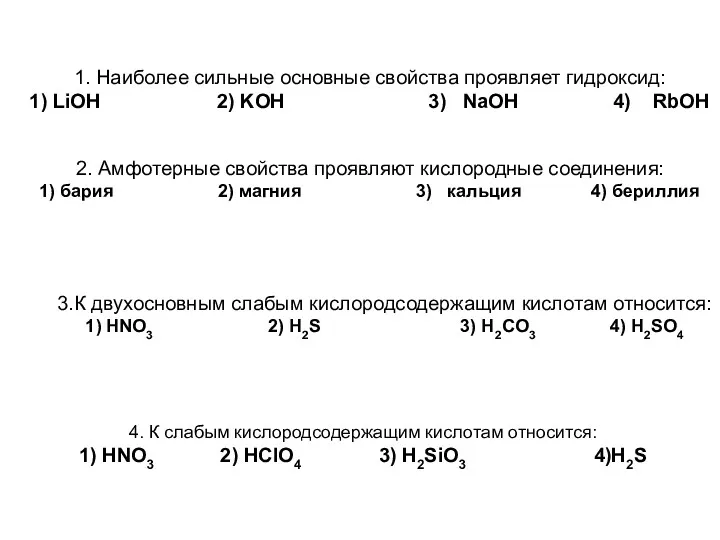
- 11. 1. Наиболее сильные основные свойства проявляет гидроксид: 1) LiOH 2) KOH 3) NaOH 4) RbOH 2.
- 12. СОЛИ Все соли – ионные соединения, сильные электролиты
- 13. Выберите из перечня веществ соль Напишите для нее уравнения возможных реакций с перечисленными ниже веществами: вода,
- 14. Генетическая связь неорганических веществ Металл Основный оксид Основание Соль Неметалл Кислотный оксид Кислота Соль
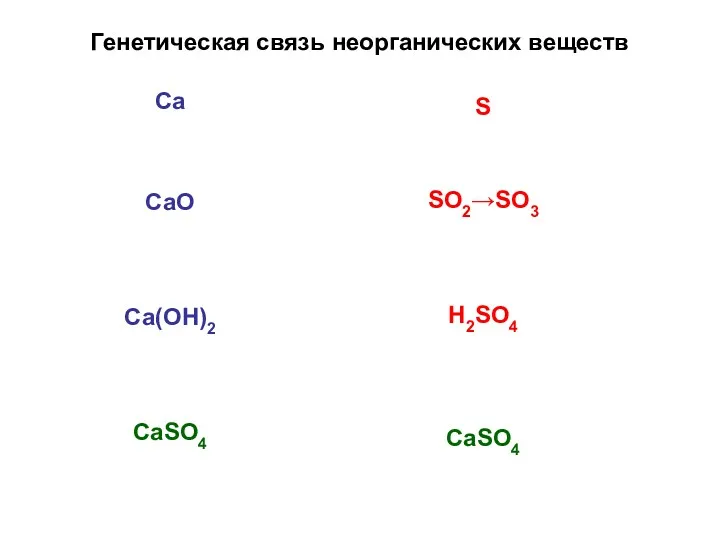
- 15. Генетическая связь неорганических веществ Са СаО Са(ОН)2 СаSО4 S SO2→SO3 H2SO4 CaSO4
- 16. Реакции ионного обмена идут без изменения заряда ионов В ионном виде не записывают слабые электролиты: Н2О,
- 18. Скачать презентацию










 Кислород
Кислород Силикатное производство
Силикатное производство Карбоновые кислоты
Карбоновые кислоты Биогенді (s.p.d) элементтермен олардың қосылыстарының медициналық және биологиялық маңызы
Биогенді (s.p.d) элементтермен олардың қосылыстарының медициналық және биологиялық маңызы Определите положение в ПСХЭ элементов
Определите положение в ПСХЭ элементов Методы составления уравнений окислительно-восстановительных реакций. Лекция №20
Методы составления уравнений окислительно-восстановительных реакций. Лекция №20 Диеновые углеводороды CnH2n-2
Диеновые углеводороды CnH2n-2 Кристаллическая решетка
Кристаллическая решетка Мыла: прошлое, настоящее, будущее
Мыла: прошлое, настоящее, будущее Кремний и его соединения
Кремний и его соединения Минералы. Классификация минералов
Минералы. Классификация минералов Застосування неметалів
Застосування неметалів Амины, аминокислоты; состав, получение, значение, применение
Амины, аминокислоты; состав, получение, значение, применение Спектроскопія ямр на ядрах 13с
Спектроскопія ямр на ядрах 13с Типы химических реакций
Типы химических реакций Титан
Титан Соединения кремния
Соединения кремния Переработка угля
Переработка угля Классификация химических элементов. 8 класс
Классификация химических элементов. 8 класс Аппаратчик химводоочистки. Билеты для экзамена с ответами (1-16)
Аппаратчик химводоочистки. Билеты для экзамена с ответами (1-16) Классы органических и неорганических веществ
Классы органических и неорганических веществ Строение атома. Лекция 2
Строение атома. Лекция 2 Углеводы. Моносахариды. Лекция 5
Углеводы. Моносахариды. Лекция 5 Теории химической кинетики. Лекция 4
Теории химической кинетики. Лекция 4 Палладий. История открытия химических веществ
Палладий. История открытия химических веществ Кислородсодержащие органические соединения. Лабораторная работа
Кислородсодержащие органические соединения. Лабораторная работа Основные сырьевые материалы для производства портландцемента
Основные сырьевые материалы для производства портландцемента Періодична система хімічних елементів
Періодична система хімічних елементів