Содержание
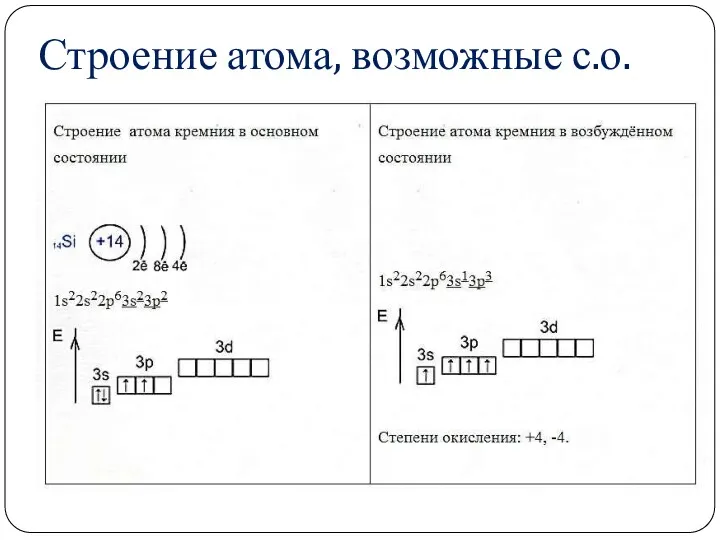
- 2. Строение атома, возможные с.о.
- 3. Распространение кремния в природе Второй по распространённости элемент в земной коре после кислорода (27,6% по массе).
- 4. Химические свойства кремния: 0 ? Si + 2Mg →Mg2Si -4 силицид магния Кристаллический кремний инертен, аморфный
- 5. II. Восстановительные свойства (с.о. +4). 1) С кислородом ? 0 +4 Si + O2 → Si
- 6. 3) С углеродом: ? 0 +4 Si + С →SiС карбид кремния (IV), карборунд SiC -
- 7. 4) С кислотами не реагирует, только с плавиковой кислотой Si+4HF → SiF4+2H2 Растворяется только в смеси
- 8. 5) Со щелочами (при нагревании): ? 0 +4 Si + 2NaOH + H2O → Na2Si O3+
- 9. 6) С оксидами металлов при высокой температуре: 0 ? Si + 2FeO → 2Fe + SiO2
- 10. 8) С водородом не взаимодействует Силан (SiH4) получают взаимодействием силицидов металлов с кислотами или водой: Mg2Si
- 11. Получение кремния: ? ? Промышленный способ – нагревание угля с песком: 2C + SiO2 → Si
- 12. Применение кремния Кремний широко используется электронике как полупроводник, в для изготовления солнечных батарей. Добавки кремния к
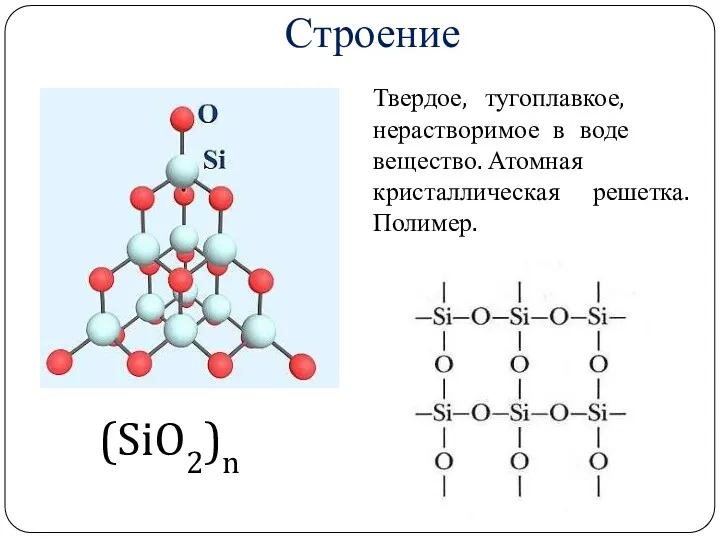
- 13. Оксид кремния (IV) (SiO2)n
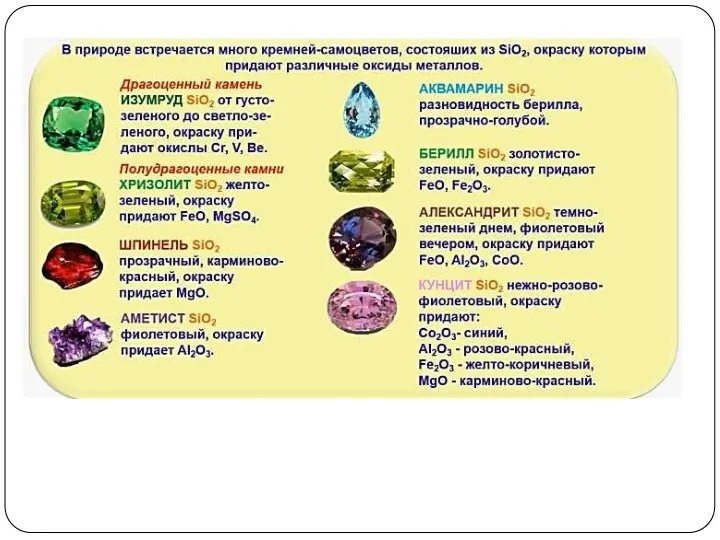
- 14. SiO2 - кварц, горный хрусталь, аметист, агат, яшма, опал, кремнезём (основная часть песка)
- 18. Строение Твердое, тугоплавкое, нерастворимое в воде вещество. Атомная кристаллическая решетка. Полимер. (SiO2)n
- 19. Химические свойства оксида кремния (IV): I. Кислотный оксид 1) С основными оксидами: t SiO2 + CaO
- 20. II. Специфические: ? ? С водой не реагирует С солями более летучих кислот: SiO2 + CaCO3
- 21. Применение оксида кремния (IV) В стекольной промышленности. Строительный материал. Получение кварцевого стекла.
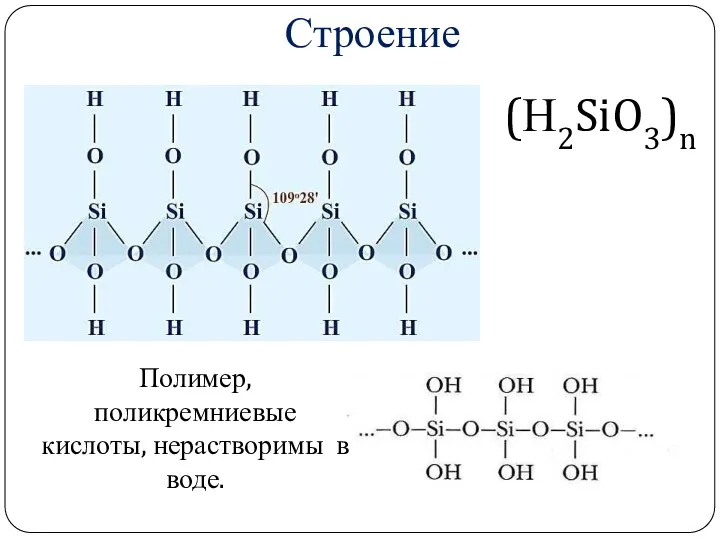
- 22. Кремниевая кислота (Н2SiO3)n
- 23. Строение Полимер, поликремниевые кислоты, нерастворимы в воде. (Н2SiO3)n
- 24. Получение кремниевой кислоты: Получение: действие сильных кислот на силикаты Na2SiO3 + 2HCl → 2NaCl + H2SiO3↓
- 25. Химические свойства кремниевой кислоты: H2SiO3 - очень слабая (слабее угольной), ? непрочная, в воде нерастворима (образует
- 26. Соли кремниевой кислоты: Силикаты: нерастворимые вещества (кроме силикатов щелочных металлов). С кислотами (качественная реакция на силикат-ион
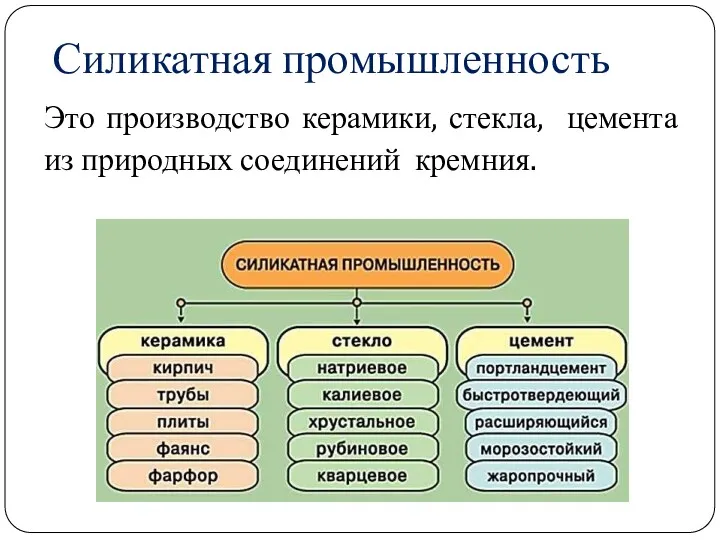
- 27. Силикатная промышленность Это производство керамики, стекла, цемента из природных соединений кремния.
- 28. Стекло Сырье: песок , сода и известняк
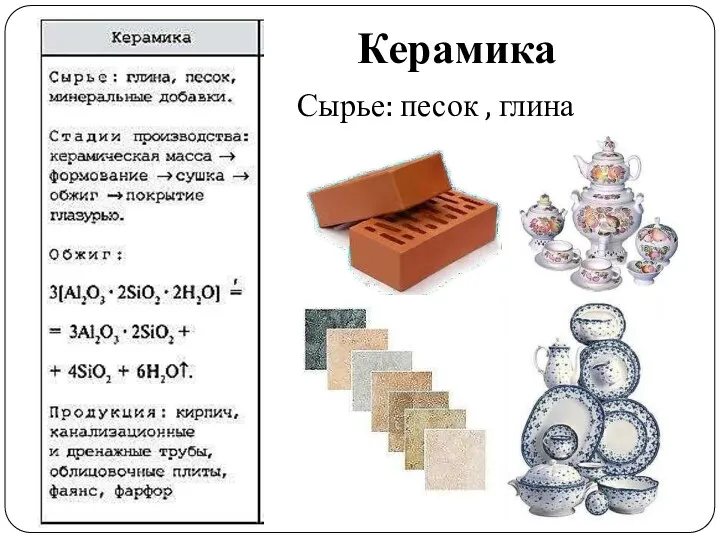
- 29. Керамика Сырье: песок , глина
- 31. Скачать презентацию






















 Основы химической термодинамики. Термохимические расчеты
Основы химической термодинамики. Термохимические расчеты Органикалық қосылыстар. Көмірсутектерден жасалған
Органикалық қосылыстар. Көмірсутектерден жасалған Теория строения органических соединений А.М. Бутлерова
Теория строения органических соединений А.М. Бутлерова Подгруппа углерода
Подгруппа углерода Основания. 8 класс
Основания. 8 класс Аурум
Аурум Химическая кинетика
Химическая кинетика Дисперсные системы: получение и свойства
Дисперсные системы: получение и свойства Обмоточные провода
Обмоточные провода Химия. 6я группа элементов. 9 класс
Химия. 6я группа элементов. 9 класс Органическая химия. Лекция - Гидроксикислоты
Органическая химия. Лекция - Гидроксикислоты Амин қышқылдар
Амин қышқылдар Минералогия литофильных редких элементов. Бериллий
Минералогия литофильных редких элементов. Бериллий Вклад М.В. Ломоносова в развитие науки химия
Вклад М.В. Ломоносова в развитие науки химия Азотная кислота и ее свойства
Азотная кислота и ее свойства Липолиз. Обмен кетоновых тел
Липолиз. Обмен кетоновых тел Материаловедение. Физические и химические структуры материалов
Материаловедение. Физические и химические структуры материалов Химическая промышленность
Химическая промышленность Химические формулы. 8 класс
Химические формулы. 8 класс Хімічний зв’язок. Ковалентний, йонний, металічний, водневий зв’язки, механізми їх утворення
Хімічний зв’язок. Ковалентний, йонний, металічний, водневий зв’язки, механізми їх утворення Натрий алкилсульфонаттарын алу. №4 лекция
Натрий алкилсульфонаттарын алу. №4 лекция Серебро. Нахождение в природе
Серебро. Нахождение в природе Уран – периодты жүйедегі атомдық номері 92 болатын химиялық элемент
Уран – периодты жүйедегі атомдық номері 92 болатын химиялық элемент Активационный анализ
Активационный анализ Свойства воды
Свойства воды Законы химической термодинамики. Часть 1. Физическая и коллоидная химия
Законы химической термодинамики. Часть 1. Физическая и коллоидная химия Классификация полимеров
Классификация полимеров Кислоты. Определение и классификация
Кислоты. Определение и классификация