Содержание
- 2. Химическая термодинамика. Фазовые равновесия. Учение о растворах. Электрохимия. Химическая кинетика. Поверхностные явления. Дисперсные системы. Коллоидное состояние
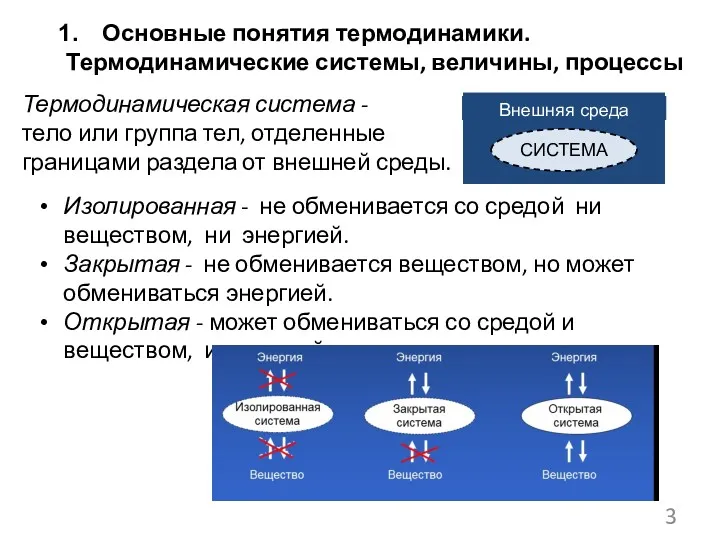
- 3. Основные понятия термодинамики. Термодинамические системы, величины, процессы Термодинамическая система - тело или группа тел, отделенные границами
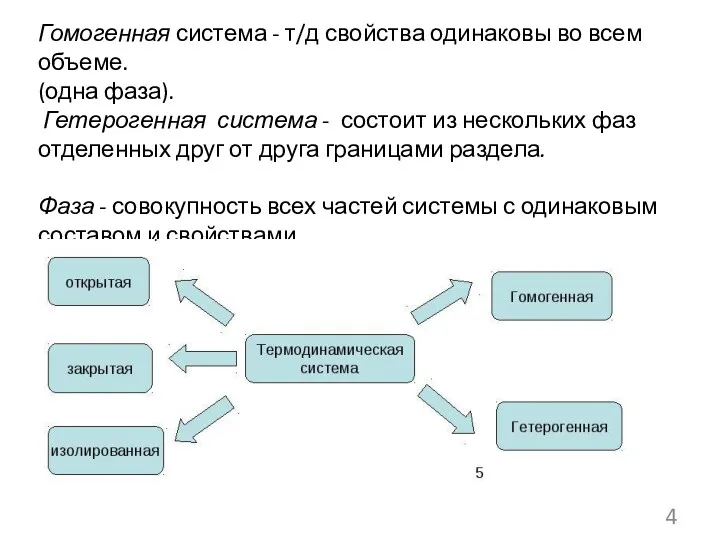
- 4. Гомогенная система - т/д свойства одинаковы во всем объеме. (одна фаза). Гетерогенная система - состоит из
- 5. Состояние системы - совокупность физических и химических свойств Свойства системы количественно выражаются т/д величинами. Экстенсивные –
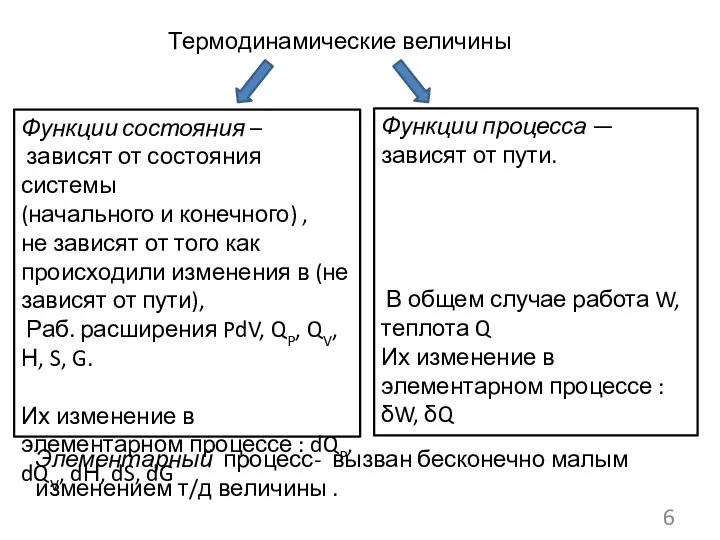
- 6. Термодинамические величины Функции состояния – зависят от состояния системы (начального и конечного) , не зависят от
- 7. Самопроизвольные процессы – происходят без внешних воздействий в результате можно получить полезную работу. в изолированной системе
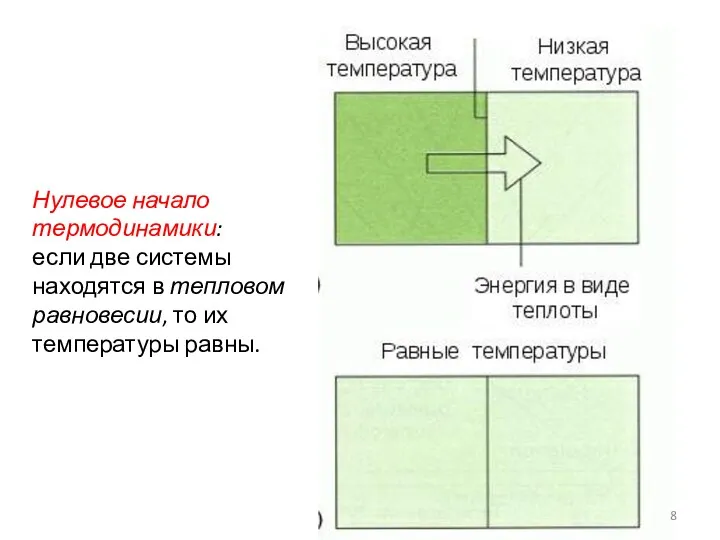
- 8. Нулевое начало термодинамики: если две системы находятся в тепловом равновесии, то их температуры равны.
- 9. Равновесный процесс система может вернуться в исходное состояние. Поэтому равновесные процессы в Т/Д называют обратимыми. Можно
- 10. Важнейшие процессы: изотермические — при постоянной температуре (T = const); изобарные – при постоянном давлении (P
- 11. 2*. Первый закон термодинамики. Теплота и работа как формы передачи энергии. Внутренняя энергия системы. Энтальпия. Теплоемкость
- 12. Не изолированные системы: формы передачи энергии - теплота Q и работа W. Теплота Q подводимая к
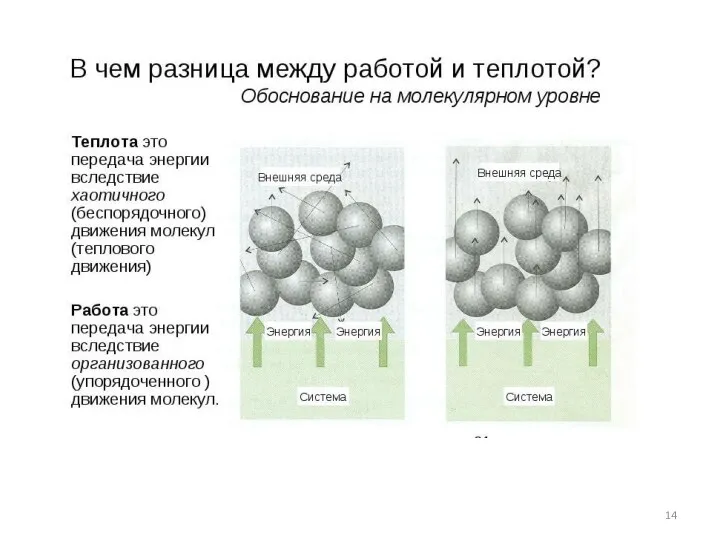
- 13. Работа W Виды W: механическая (работа расширения газа), электрическая (в гальваническом элементе), и т.д. В целом
- 15. Формулировка 2 первого закона Т/Д (одна их нескольких): Внутренняя энергия системы расходуется на выделяемое системой тепло
- 16. 3. Теплота и работа в изобарном и изохорном процессах. * Энтальпия Первое начало Т/Д ΔU =
- 17. В изобарном процессе (P = const) Работа dWрасш= – PdV dWрасш= – PdV Теплота QР QР
- 18. связь между QР и QV. QР = ΔU + PΔV, QV = ΔU тогда QV =
- 19. Зависимость теплоты от Т Qр = n СP (T2 – T1) QV = n СV (T2
- 20. Пример Вычислим количество теплоты, необходимое для нагревания 2 моль водяного пара от 273 до 373 К
- 21. Значения С0V в справочниках не приводятся С0V = C0P (для тв. и жидк.) С0V = C0P
- 22. 4. * Приложения первого начала термодинамики к химическим процессам. Закон Гесса и следствия из него Закон
- 23. Практическое значение закона Гесса - позволяет рассчитывать тепловые эффекты химических процессов и реакций. Стандартный тепловой эффект
- 24. Стандартная теплота (энтальпия) образования ΔНf0298 тепловой эффект реакции образования одного моль вещества из простых веществ, находящихся
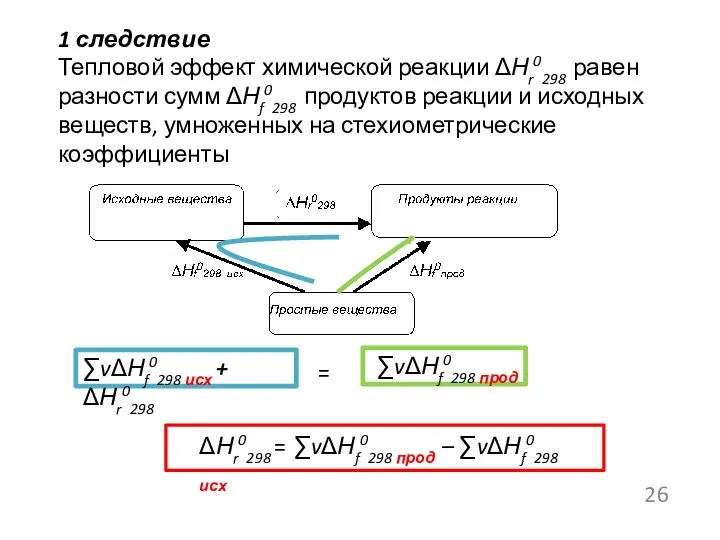
- 26. ΔНr0298 = ∑vΔНf0298 прод – ∑vΔНf0298 исх 1 следствие Тепловой эффект химической реакции ΔНr0298 равен разности
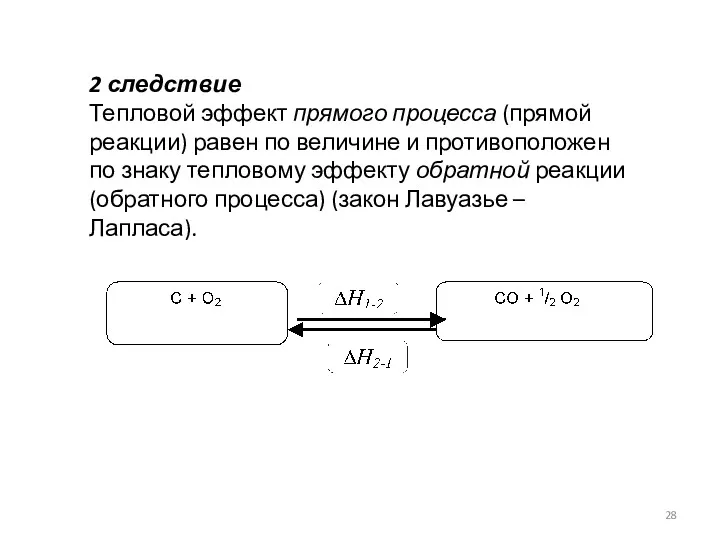
- 28. 2 следствие Тепловой эффект прямого процесса (прямой реакции) равен по величине и противоположен по знаку тепловому
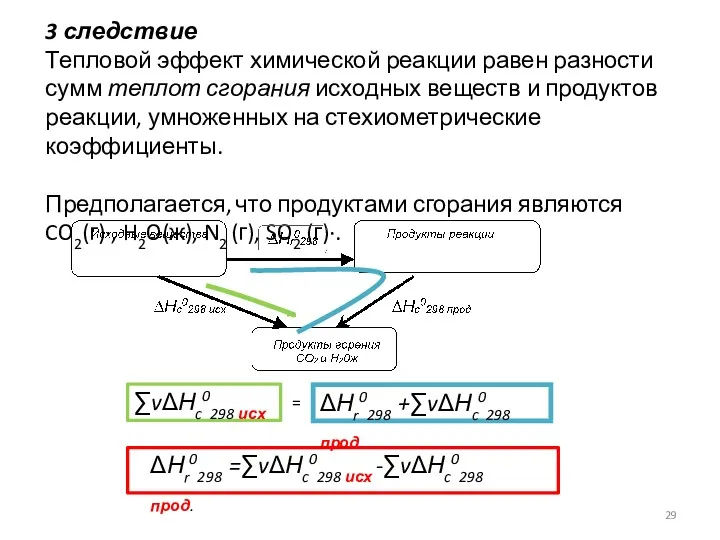
- 29. 3 следствие Тепловой эффект химической реакции равен разности сумм теплот сгорания исходных веществ и продуктов реакции,
- 30. Пример Определим тепловой эффект реакции по теплотам сгорания С2H5ОН(ж) + СН3СООН (ж) = СН3СООС2H5(ж) + Н2О
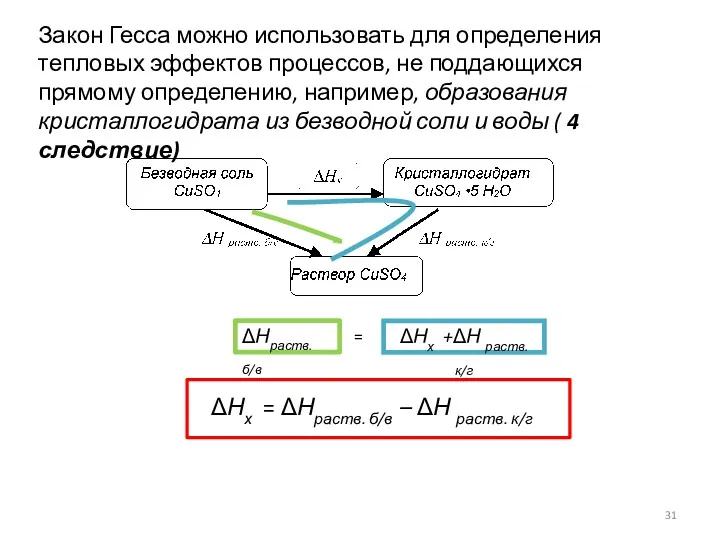
- 31. Закон Гесса можно использовать для определения тепловых эффектов процессов, не поддающихся прямому определению, например, образования кристаллогидрата
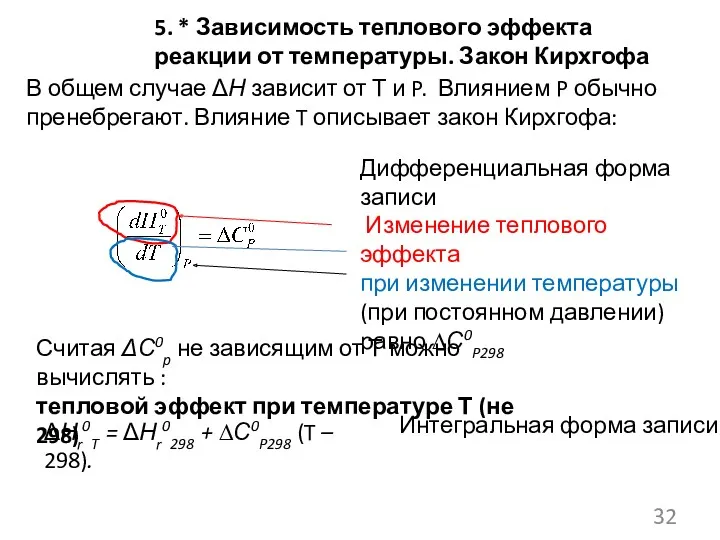
- 32. 5. * Зависимость теплового эффекта реакции от температуры. Закон Кирхгофа В общем случае ΔН зависит от
- 35. Скачать презентацию





















 Реакции элиминирование галогеналканов
Реакции элиминирование галогеналканов Одноатомные и многоатомные спирты
Одноатомные и многоатомные спирты Практическая работа по разделению смесей
Практическая работа по разделению смесей Химия пәні. Заттар және олардың қасиеттері
Химия пәні. Заттар және олардың қасиеттері Жиры и масла
Жиры и масла Непредельные углеводороды: алкены, олефины
Непредельные углеводороды: алкены, олефины Одноосновные ненасыщенные кислоты
Одноосновные ненасыщенные кислоты Электрохимические методы анализа
Электрохимические методы анализа Химическая связь
Химическая связь Введение в кристаллографию
Введение в кристаллографию Фосфор и его соединения
Фосфор и его соединения Углеводы. Урок по химии для 9 класса
Углеводы. Урок по химии для 9 класса Кислород
Кислород Растворы. Часть 2
Растворы. Часть 2 Общие способы получения металлов
Общие способы получения металлов Свойства и биологическая роль карбонильных соединений
Свойства и биологическая роль карбонильных соединений Основные сведения о строении атома
Основные сведения о строении атома Фенол қосылыстары
Фенол қосылыстары Загальні способи добування солей. Класифікація неорганічних речовин
Загальні способи добування солей. Класифікація неорганічних речовин Электронный помощник по химии 8 класс
Электронный помощник по химии 8 класс Экоэстафета. ученики 9 Б класса гимназии №6 г. Гродно
Экоэстафета. ученики 9 Б класса гимназии №6 г. Гродно Ядерное топливо
Ядерное топливо Альдегиды и кетоны
Альдегиды и кетоны Особенности строения твердых тел
Особенности строения твердых тел Циклические углеводороды
Циклические углеводороды D-элементы VII-В группы. Марганец
D-элементы VII-В группы. Марганец Аммиак: состав, строение, свойства, применение
Аммиак: состав, строение, свойства, применение Методика изучения галогенов, галогеноводородных кислот и их солей в курсе химии средней школы
Методика изучения галогенов, галогеноводородных кислот и их солей в курсе химии средней школы