Содержание
- 2. КОЛЛИГАТИВНЫЕ СВОЙСТВА РАСТВОРОВ Коллигативными свойствами называются свойства растворов, не зависящие от природы частиц растворенного вещества, а
- 3. Диффузией в растворе называется самопроизвольный направленный процесс переноса частиц растворенного вещества и растворителя, который приводит к
- 4. Осмос- односторонняя диффузия через полупроницаемую мембрану молекул растворителя под действием разности концентраций. Осмотическое давление - равно
- 5. Для растворов электролитов Р = i CRT i - изотонический коэффициент, показывает, во сколько раз осмотическое
- 6. 3 типа растворов по отношению к данному раствору: с меньшим осмотическим давлением — гипотонический с бóльшим
- 7. Осмотическая ячейка - это система, отделенная от окружающей среды мембраной с избирательной проницаемостью Эндоосмос происходит, если
- 8. Экзоосмос имеет место, если клетка оказывается в гипертонической среде Экзоосмос - движение растворителя из осмотической ячейки
- 9. Давление насыщенного пара растворителя над раствором всегда будет меньше давления насыщенного пара над чистым растворителем I
- 10. II закон Рауля: Повышение температуры кипения или понижение температуры, замерзания идеальных растворов нелетучих веществ прямо пропорционально
- 11. Водно-электролитный баланс В зависимости от содержания внеклеточной жидкости различают 6 состояний, приводящих к ⇑ или⇓внеклеточной жидкости:
- 12. 4. Гипертоническая гипергидратация Р осм ⇑ жидкость ⇑ клетка обезвоживается- если нет пресной воды 5. Изотоническая
- 13. Электролиты в организме человека: - участвуют в поддержании осмотического давления, - рН среды, - активируют ферменты,
- 14. Ионы организма можно разделить на антагонисты и синергисты. Те ионы, которые действуют совместно и усиливают действие
- 15. Гидролиз солей Взаимодействие солей с водой, с образованием слабых электролитов. KCl = K+ + Cl– непротолиты
- 16. Гидролиз солей ZnSO4 = Zn2+ + SO42– Zn2+ + HOН ZnOH+ + H+ Гидролиз по катиону,
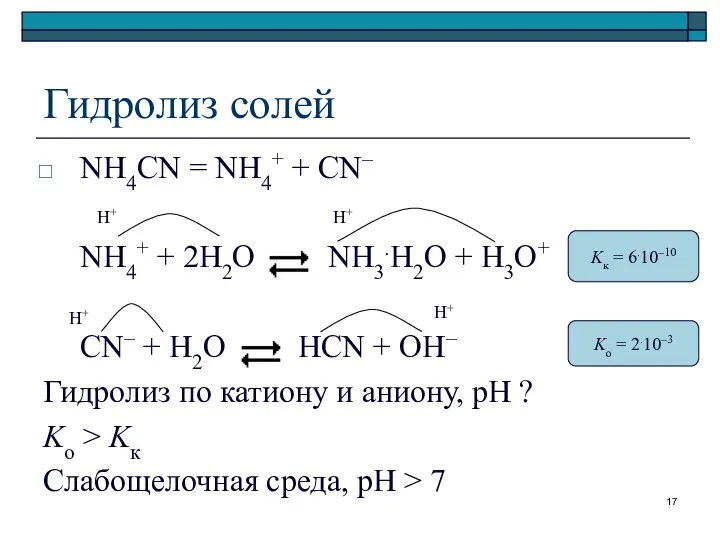
- 17. Гидролиз солей NH4CN = NH4+ + CN– NH4+ + 2H2O NH3.H2O + H3O+ CN– + H2O
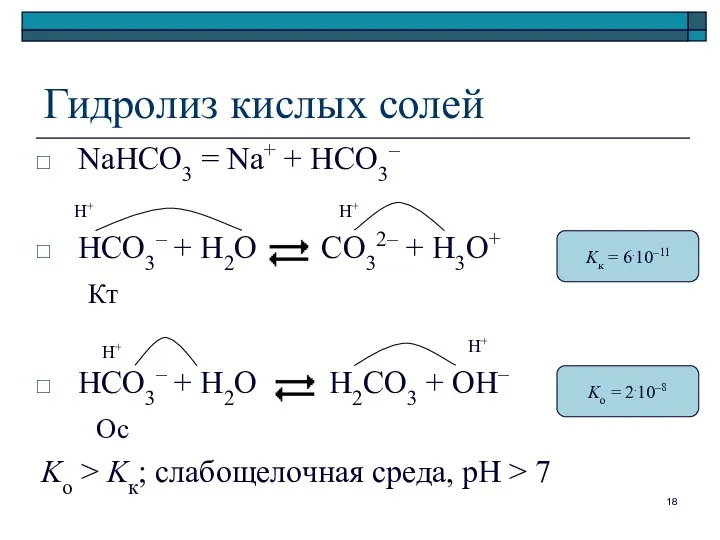
- 18. Гидролиз кислых солей NaHCO3 = Na+ + HCO3– HCO3– + H2O CO32– + H3O+ Кт HCO3–
- 19. Гидролиз солей Усиление (α↑) Повышение температуры Понижение концентрации Связывание одноименных ионов Ослабление (α↓) Понижение температуры Повышение
- 20. Необратимый гидролиз Al2S3(т) + 6H2O = 2Al(OH)3↓ + 3H2S↑ Совместный гидролиз: 2Al3+ +3S2– + 6H2O =
- 21. Буферные растворы
- 22. Буферными системами называются растворы, способные сохранять постоянство концентрации ионов водорода (рН) при добавлении кислот или щелочей
- 23. Общий механизм действия буферных растворов НА ↔ Н+ + А– а/ А– + Н+ → НА
- 24. рН буферных смесей. Ацетатный буфер (1 типа) СН3СООH + СН3СООNa Прологарифмируем и получим уравнение Гендерсона-Гассельбальха: рН
- 25. Аммиачный буфер (2 типа) - NH4ОН + NH4C1 рOН = рКВ + lg [соль] [основание] рН
- 26. При разбавлении буферных растворов концентрации всех компонентов уменьшаются. Но так как они изменяются одинаково, то их
- 27. Буферной емкостью (В) называется число моль-эквивалентов сильной кислоты или щелочи, которые нужно добавить к 1 литру
- 28. Какие факторы определяют буферную ёмкость? 1. Наибольшей буферной ёмкостью обладают концентрированные буферные растворы,. 2. Из двух
- 30. Скачать презентацию

























 Строение атома
Строение атома Кристаллические решетки. Кристаллические вещества
Кристаллические решетки. Кристаллические вещества Свойства алкадиенов и их получение
Свойства алкадиенов и их получение Chimia coordinativă
Chimia coordinativă Непредельные углеводороды
Непредельные углеводороды Гелий. Физико-химические свойства
Гелий. Физико-химические свойства Элемент свинец Рb
Элемент свинец Рb Классификация химических реакций
Классификация химических реакций Важнейшие минералы
Важнейшие минералы Электролитическая диссоциация
Электролитическая диссоциация Кинетика химических реакций. Химическое равновесие
Кинетика химических реакций. Химическое равновесие Электронные представления в химии
Электронные представления в химии Деятельность лабораторий контроля химических факторов. Внедрение политики импортозамещения
Деятельность лабораторий контроля химических факторов. Внедрение политики импортозамещения Атомы, молекулы и ионы. Вещества молекулярного и немолекулярного строения
Атомы, молекулы и ионы. Вещества молекулярного и немолекулярного строения Неорганические соединения галогенов
Неорганические соединения галогенов Азотная кислота и ее соли. 9 класс
Азотная кислота и ее соли. 9 класс Горючее, смазочные материалы и специальные жидкости
Горючее, смазочные материалы и специальные жидкости Тема 10- Гетроциклические соединения
Тема 10- Гетроциклические соединения Химический состав клетки. Неорганические вещества клетки
Химический состав клетки. Неорганические вещества клетки Классификация и свойства природных энергоносителей
Классификация и свойства природных энергоносителей Растворы. Дисперсные системы. Термодинамика процесса растворения. (Лекция 2)
Растворы. Дисперсные системы. Термодинамика процесса растворения. (Лекция 2) Углерод и его оксиды
Углерод и его оксиды Роль химии в жизни человека
Роль химии в жизни человека Физические и химические свойства алкенов
Физические и химические свойства алкенов Химия 20 века
Химия 20 века Номенклатура органических соединений
Номенклатура органических соединений Электрохимическая коррозия
Электрохимическая коррозия Пиролиз углеводородов
Пиролиз углеводородов