Содержание
- 2. Алкены (этиленовые углеводороды) это углеводороды, содержащие в молекуле одну двойную связь. CnH2n общая формула (n =
- 3. Физические свойства По физическим свойствам этиленовые углеводороды близки к алканам. При нормальных условиях углеводороды C2–C4 –
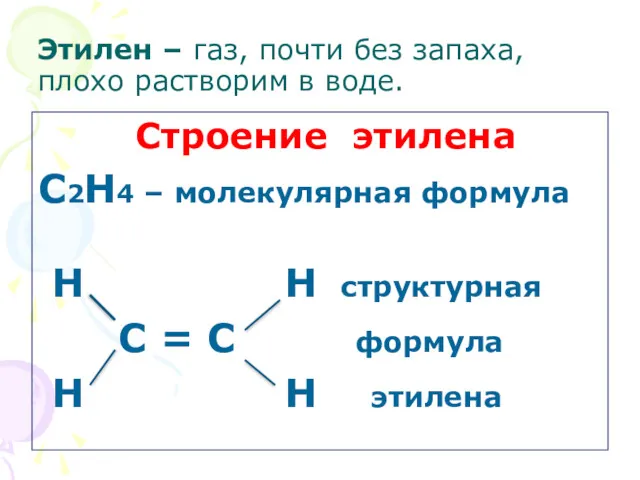
- 4. Этилен – газ, почти без запаха, плохо растворим в воде. Строение этилена С2Н4 – молекулярная формула
- 5. 1. Образование σ -связей Каждый атом С образует по 3 σ-связи (одну – с соседним атомом
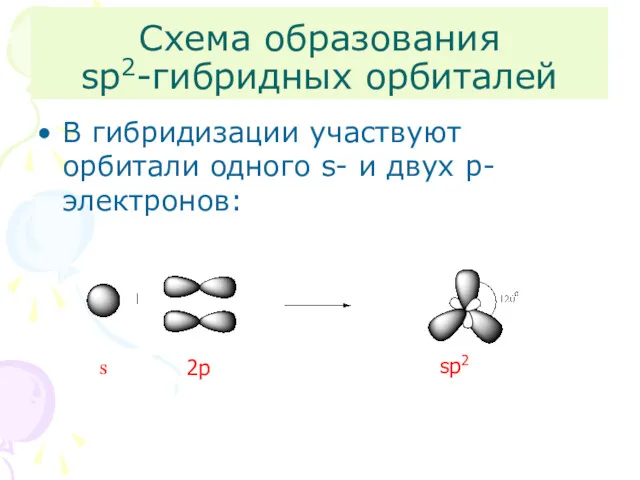
- 6. Схема образования sp2-гибридных орбиталей В гибридизации участвуют орбитали одного s- и двух p-электронов: s 2p sp2
- 7. 2. Образование π-связи У каждого атома С есть ещё по одному облаку, которые в гибридизации не
- 8. Запомните. Простая (ординарная) связь – это всегда σ-связь. В кратных (двойных или тройных) связях – одна
- 9. π- связь менее прочна, чем σ- связь. В связи с этим, π- связь легко разрывается и
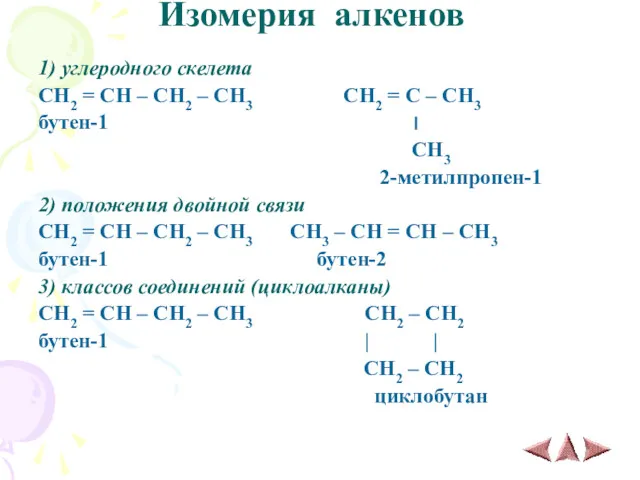
- 10. Изомерия алкенов 1) углеродного скелета CH2 = CH – CH2 – CH3 CH2 = C –
- 11. 4) пространственная (цис-транс-изомерия) CH3 H H H \ / \ / C = C C =
- 12. Номенклатура алкенов Название алкенов по систематической номенклатуре образуют из названий алканов, заменяя суффикс –ан на –ен,
- 13. Химические свойства алкенов 1) Горение При сжигании на воздухе алкены образуют углекислый газ и воду. C2
- 14. При окислении алкенов разбавленным раствором перманганата калия образуются двухатомные спирты – гликоли (реакция Е.Е.Вагнера). Реакция протекает
- 15. 3) Реакции присоединения. а) Присоединение галогенов - Галогенирование. Алкены при обычных условиях присоединяют галогены, приводя к
- 16. б) Гидрирование – присоединение водорода. Алкены легко присоединяют водород в присутствии катализаторов (Pt, Pd, Ni) образуя
- 17. Присоединение галогеноводородов к пропилену и другим несимметричным алкенам происходит в соответствии с правилом В.В.Марковникова (водород присоединяется
- 18. Гидратация. В присутствии минеральных кислот алкены присоединяют воду, образуя спирты. H+ CH3−C=CH2 + H2O → CH3−CH(CH3)−CH3
- 19. 4. Полимеризация - это процесс соединения многих маленьких одинаковых молекул в одну большую молекулу. При полимеризации
- 20. Вывод: Реакции присоединения, окисления и полимеризации алкенов идут за счет разрыва двойной связи ( π-связи).
- 21. Получение алкенов 1) Дегидрирование (отщепление водорода) алканов при повышенной температуре с катализатором. СН3 – СН3 →
- 22. Применение алкенов Алкены широко используются в промышленности в качестве исходных веществ для получения многих важнейших продуктов.
- 23. Этилен ускоряет созревание плодов
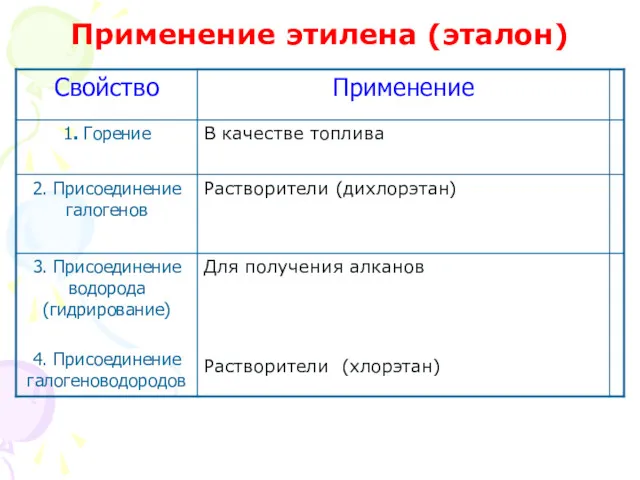
- 24. В качестве топлива
- 25. Для получения алканов
- 26. Этиленгликоль – для получения антифризов, тормозных жидкостей
- 27. Дихлорэтан – растворитель
- 28. Дихлорэтан – для борьбы с вредителями (окуривание зернохранилищ)
- 29. Дибромэтан – антидетонационная добавка в топливо
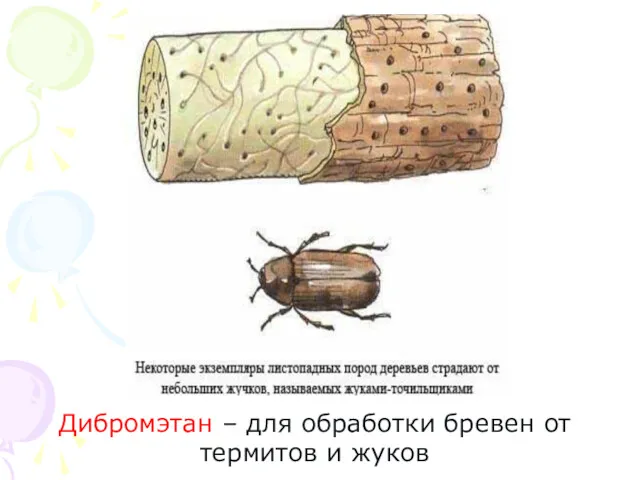
- 30. Дибромэтан – для обработки бревен от термитов и жуков
- 31. Хлорэтан, бромэтан – для наркоза при легких операциях
- 32. Этиловый спирт - растворитель, анти-септик в медицине , в производстве синтетического каучука…
- 33. Производство полиэтилена:
- 34. Содержание Алкены Номенклатура Изомерия Физические свойства Строение алкенов Химические свойстваХимические свойства (Химические свойства (реакцииХимические свойства (реакции
- 35. А) Пленка
- 36. Б) Тара
- 37. В) Трубы
- 38. Г) Сантехника
- 39. Д) Изоляция проводов и кабелей
- 40. Ж) Каркасы катушек
- 41. З) Бронепанели в бронежилетах
- 42. И) Предметы быта
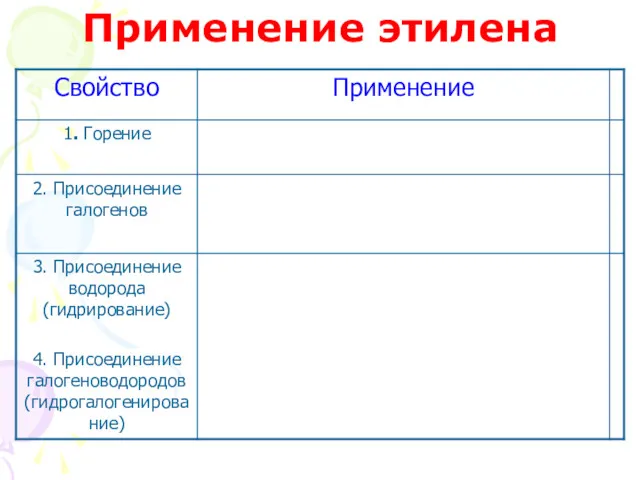
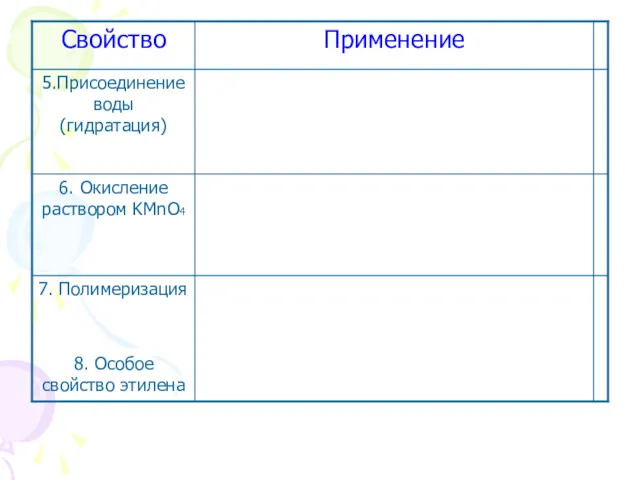
- 44. Применение этилена
- 46. Применение этилена (эталон)
- 48. Скачать презентацию




































 Возраст в геологии
Возраст в геологии Механические свойства минералов
Механические свойства минералов Карбонові кислоти
Карбонові кислоти Stirring in liquid media
Stirring in liquid media Правила работы в химической лаборатории
Правила работы в химической лаборатории Аминдердің химиялық қасиеттері
Аминдердің химиялық қасиеттері Химические свойства алканов
Химические свойства алканов Полимеры. Классификация. Строение
Полимеры. Классификация. Строение Способы выражения концентраций растворов, используемые в титриметрии
Способы выражения концентраций растворов, используемые в титриметрии Понятие о солях (8 класс)
Понятие о солях (8 класс) Жиры
Жиры Химиялық кинетика және химиялық тепе-теңдік
Химиялық кинетика және химиялық тепе-теңдік Гибридизация атомных орбиталей
Гибридизация атомных орбиталей Изменение активности катализатора в процессе эксплуатации
Изменение активности катализатора в процессе эксплуатации Химия в повседневной жизни человека
Химия в повседневной жизни человека Химический элемент и вещество
Химический элемент и вещество Синтетические моющие средства
Синтетические моющие средства Силикатная промышленность. 9 класс
Силикатная промышленность. 9 класс Металлы и их соединения
Металлы и их соединения Металл цирконий (ZR)
Металл цирконий (ZR) Основные законы и понятия химии
Основные законы и понятия химии Ауылшаруашылық дақылдарының тұқымдарын фунгецидтермен улау және химиялық қорғау тәсілдерінің биологиялық
Ауылшаруашылық дақылдарының тұқымдарын фунгецидтермен улау және химиялық қорғау тәсілдерінің биологиялық Історія відкриття періодичної системи хімічних елементів
Історія відкриття періодичної системи хімічних елементів Сульфиды — природные сернистые соединения металлов и некоторых неметаллов
Сульфиды — природные сернистые соединения металлов и некоторых неметаллов Этилен. Углеводороды ряда этилена
Этилен. Углеводороды ряда этилена Азот. Нахождение азота в природе
Азот. Нахождение азота в природе Положение металлов в Периодической системе Д.И. Менделеева. Особенности строения атомов, свойства
Положение металлов в Периодической системе Д.И. Менделеева. Особенности строения атомов, свойства Азот. Строение атома и молекулы
Азот. Строение атома и молекулы