Содержание
- 2. Требования к установочным веществам вещество должно быть химически чистым; состав вещества должен строго соответствовать его химической
- 3. Требования к реакциям, используемым для титрования реакция должна протекать строго в соответствии с единственным стехиометрическим уравнением
- 4. Обозначения, принятые в аналитической химии для расчетов в титриметрии и для обозначения концентраций растворов с(1/1HCl) –
- 5. Основные способы выражения концентраций растворов, используемые в титриметрии:
- 6. Титр по определяемому веществу показывает сколько граммов определяемого вещества оттитровывается одним миллилитром титранта 2HCl + Na2CO3
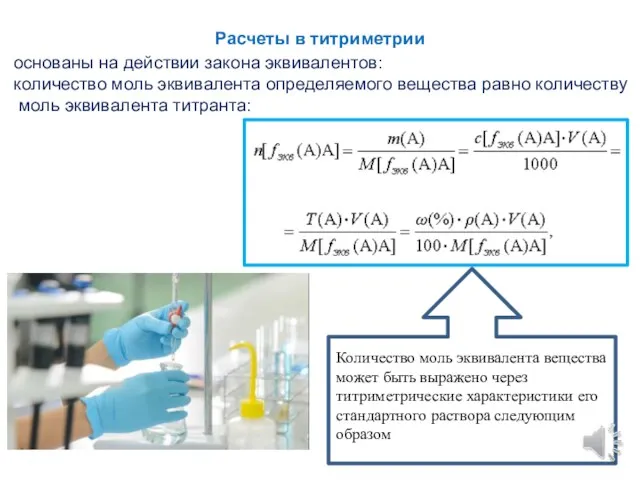
- 7. Расчеты в титриметрии основаны на действии закона эквивалентов: количество моль эквивалента определяемого вещества равно количеству моль
- 8. Способы титрования: прямое титрование обратное титрование титрование по заместителю Прямое титрование – способ титрования, когда определяемое
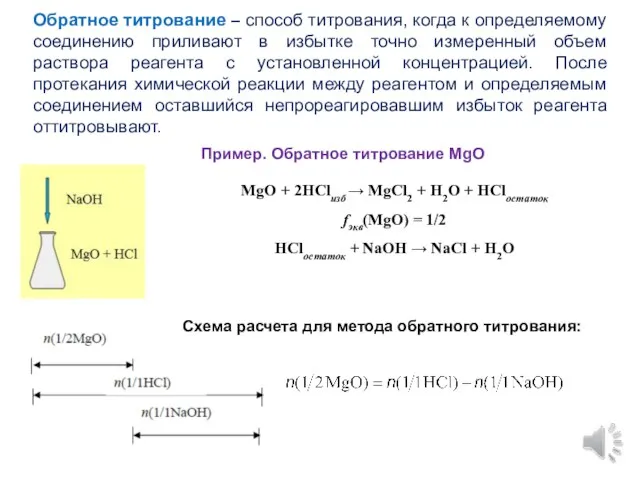
- 9. Обратное титрование – способ титрования, когда к определяемому соединению приливают в избытке точно измеренный объем раствора
- 10. Заместительное титрование – способ титрования когда к титруемому соединению приливают реагент, в результате реакции которого с
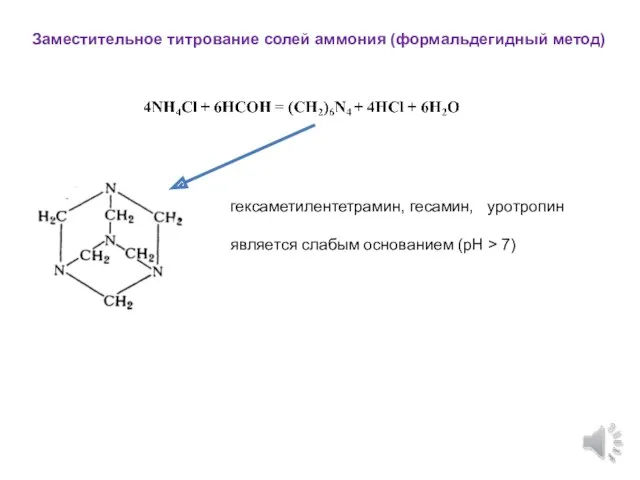
- 11. Заместительное титрование солей аммония (формальдегидный метод) гексаметилентетрамин, гесамин, уротропин является слабым основанием (рН > 7)
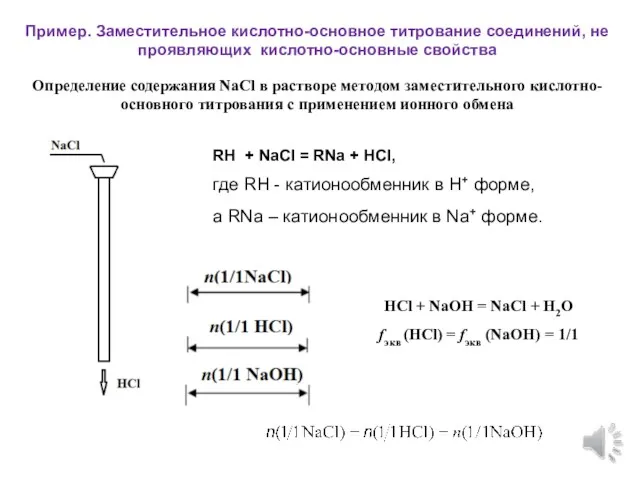
- 12. Определение содержания NaCl в растворе методом заместительного кислотно-основного титрования с применением ионного обмена Пример. Заместительное кислотно-основное
- 14. Скачать презентацию







 Оксид водорода (H2O)
Оксид водорода (H2O) Аллотропные модификации кремния
Аллотропные модификации кремния Способи очищення води в побуті
Способи очищення води в побуті Неметаллы. Общая характеристика
Неметаллы. Общая характеристика Синтетические каучуки: хлоропреновый каучук
Синтетические каучуки: хлоропреновый каучук Химические элементы. Строение вещества. Химическая связь
Химические элементы. Строение вещества. Химическая связь Химическая кинетика
Химическая кинетика Металлы и неметаллы
Металлы и неметаллы Химическая посуда и лабораторное оборудование
Химическая посуда и лабораторное оборудование Органикалық қосылыстар
Органикалық қосылыстар Химическая кинетика. Часть II. Скорость химической реакции - развитие реакции во времени
Химическая кинетика. Часть II. Скорость химической реакции - развитие реакции во времени Знакомство с лабораторным оборудованием
Знакомство с лабораторным оборудованием Закон сохранения массы веществ. Химические уравнения
Закон сохранения массы веществ. Химические уравнения Химические свойства серной кислоты
Химические свойства серной кислоты Лекция 1 эквивалент 2
Лекция 1 эквивалент 2 Алканы. Состав, строение, свойства и химические превращения. Экологические последствия. Синтезы генетическая связь
Алканы. Состав, строение, свойства и химические превращения. Экологические последствия. Синтезы генетическая связь Реакции ионного обмена
Реакции ионного обмена Introduction in bioorganic chemistry. Isomerism and structure of organic compounds
Introduction in bioorganic chemistry. Isomerism and structure of organic compounds Классификация химических реакций. Признаки химических реакций
Классификация химических реакций. Признаки химических реакций Классы неорганических соединений
Классы неорганических соединений Химическая промышленность России
Химическая промышленность России Галогенопроизводные углеводородов
Галогенопроизводные углеводородов ПВХ
ПВХ Вугдеводи. Моносахариди
Вугдеводи. Моносахариди Геохимические поиски. Региональные работы
Геохимические поиски. Региональные работы Соединения алюминия
Соединения алюминия Альтернативная бытовая химия
Альтернативная бытовая химия Непредельные углеводороды. Алкены
Непредельные углеводороды. Алкены