Содержание
- 2. Оксид алюминия. Очень твердый порошок белого цвета. Образуется: а) при окислении или горении алюминия: 4Al +
- 3. Химические свойства оксида алюминия Взаимодействует: а) с кислотами: Al2O3 + 3H2SO4 = Al2(SO4)3 + 3H2O Al2O3
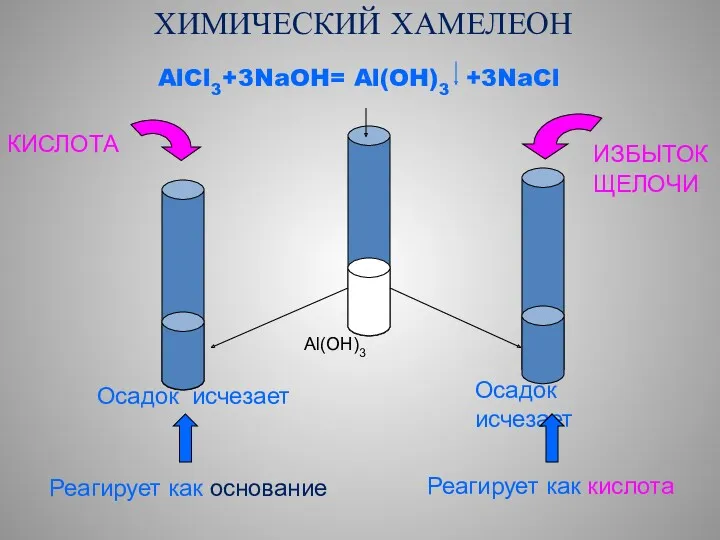
- 4. ХИМИЧЕСКИЙ ХАМЕЛЕОН AlCl3+3NaOH= Al(OH)3 +3NaCl Al(OH)3 КИСЛОТА ИЗБЫТОК ЩЕЛОЧИ Осадок исчезает Реагирует как основание Осадок исчезает
- 5. Амфотерный гидроксид Как основание: Al(OH)3 + 3HCl → AlCl3 + 3H2O Как кислота Al(OH)3 + NaOH
- 6. Гель из гидроксида алюминия входит в состав лекарст для лечения болезней желудка. Гидроксид алюминия используется для
- 8. Скачать презентацию




 Теория химического строения органических соединений
Теория химического строения органических соединений Plastic is one of the challenges of the 21st century
Plastic is one of the challenges of the 21st century Непредельные углеводороды ряда этилена. Олефины
Непредельные углеводороды ряда этилена. Олефины Почвенный раствор. Химический состав почвенных растворов. Водный режим почв. Кислотность и щелочность почвенных растворов
Почвенный раствор. Химический состав почвенных растворов. Водный режим почв. Кислотность и щелочность почвенных растворов Фазовые равновесия в растворах
Фазовые равновесия в растворах Сера. Аллотропные модификации
Сера. Аллотропные модификации Carbohydrates and their metabolism. Digestion of carbohydrates
Carbohydrates and their metabolism. Digestion of carbohydrates Правила работы в лаборатории и приёмы обращения с лабораторным оборудованием (8 класс)
Правила работы в лаборатории и приёмы обращения с лабораторным оборудованием (8 класс) Химическая связь
Химическая связь Термическая и химико-термическая обработка
Термическая и химико-термическая обработка Обчислення за хімічними рівняннями відносного виходу продукту реакції. Урок №19. 11 клас
Обчислення за хімічними рівняннями відносного виходу продукту реакції. Урок №19. 11 клас Методические подходы к решению химических задач. Задание 34
Методические подходы к решению химических задач. Задание 34 Методика обучения решению задач на соотношение атомов в школьном курсе химии
Методика обучения решению задач на соотношение атомов в школьном курсе химии Химические уравнения
Химические уравнения Аммиак
Аммиак Техника безопасности в кабинете химии
Техника безопасности в кабинете химии Виды камней
Виды камней Альдегиды, свойства, получение, применение
Альдегиды, свойства, получение, применение Соли. 11 класс
Соли. 11 класс CaSO4 кристаллының ас жазықтығына проекциясының құрылымдық моделі
CaSO4 кристаллының ас жазықтығына проекциясының құрылымдық моделі Обмен жиров в организме
Обмен жиров в организме Введение в органическую химию
Введение в органическую химию Фосфор и его соединения. Урок по химии для 9 класса
Фосфор и его соединения. Урок по химии для 9 класса Электролиттік диссоциациялану теориясы тұрғысынан қышқыл, негіз, тұздардың химиялық қасиеттері
Электролиттік диссоциациялану теориясы тұрғысынан қышқыл, негіз, тұздардың химиялық қасиеттері Элементы группы галогенов
Элементы группы галогенов Кислород, его характеристика, получение и свойства
Кислород, его характеристика, получение и свойства Спирти. 3агальна характеристика спиртів
Спирти. 3агальна характеристика спиртів Щелочи
Щелочи