Содержание
- 2. План урока 1. Нахождение кислорода в природе. 2. История открытия кислорода. 3. Кислород, как элемент 4.
- 3. 1. Нахождение кислорода в природе.
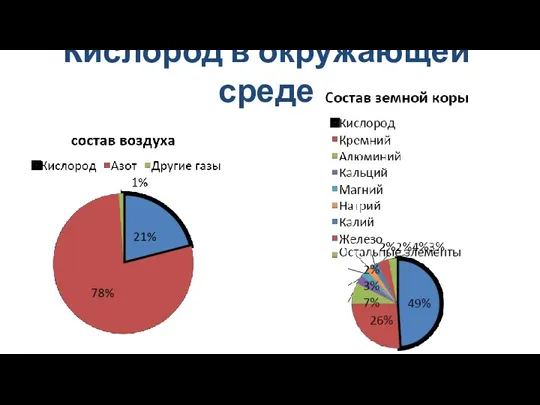
- 4. Кислород в окружающей среде
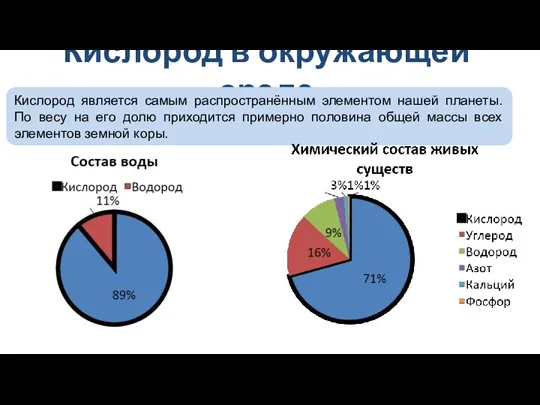
- 5. Кислород в окружающей среде Кислород является самым распространённым элементом нашей планеты. По весу на его долю
- 6. 2. История открытия кислорода.
- 7. Английский ученый. В 1774 году разложением oксида ртути ( II ) получил кислород и изучил его
- 8. Шведский ученый. В 1771 году провел опыты по разложению оксида ртути ( II ), изучил свойства
- 9. 1743 - 1794 С целью проверки опытов Шееле и Пристли в 1774 году получил кислород, установил
- 10. КОРНЕЛИУС ДРЕББЕЛЬ Голландский алхимик и технолог. Получил кислород примерно за 150 лет до Пристли и Шееле
- 11. 3. Кислород, как элемент
- 12. В какой группе, подгруппе и периоде находится элемент кислород? Какой он имеет порядковый номер? Какая атомная
- 13. Элемент кислород находится в VI группе, главной подгруппе, II периоде, порядковый номер №8, Ar = 16.
- 14. 4. Свойства кислорода.
- 15. Газ - без цвета, вкуса и запаха; в 100V H2O растворяется 3V O2 (н.у.); t°кип= -183°С;
- 16. С неметаллами C + O2 → CO2 S + O2 → SO2 2H2 + O2 →
- 17. 5. Получение кислорода в лаборатории.
- 18. Способы получения кислорода 1) разложение перманганата калия 2KMnO4 = K2MnO4 + MnO2 + O2↑
- 19. 2) разложение пероксида водорода 2H2O2 = 2H2O + O2↑ Катализаторы – это вещества, которые ускоряют ход
- 20. 3) разложение хлората калия 2KClO3 = 2KCl + 3O2↑ 4) разложение оксида ртути (II) 2HgO =
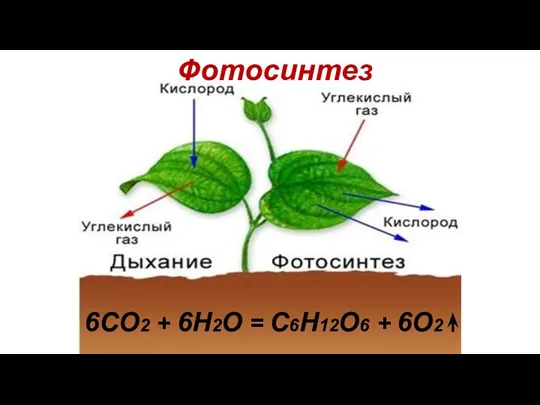
- 21. Фотосинтез 6CO2 + 6H2O = C6H12O6 + 6O2
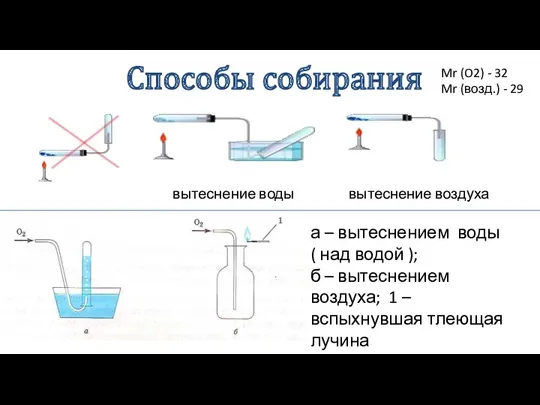
- 22. Способы собирания вытеснение воды вытеснение воздуха а – вытеснением воды ( над водой ); б –
- 23. 6. Применение кислорода.
- 24. Находит широкое применение в медицине и промышленности. При высотных полётах лётчиков снабжают специальными приборами с кислородом.
- 25. 7. Домашнее задание конспект данной информации!
- 26. 8. Закрепление
- 27. 1. Соединения, состоящие из двух элементов, одним из которых является кислород ЭхОу О К С И
- 29. Скачать презентацию






















 Сущность процесса электролитической диссоциации
Сущность процесса электролитической диссоциации Типы химических реакций. Тепловой эффект (11 класс)
Типы химических реакций. Тепловой эффект (11 класс) Азотсодержащие гетероциклические соединения
Азотсодержащие гетероциклические соединения Crystal defects
Crystal defects Классификация минералов по химическому принципу. Кварц, магнетит
Классификация минералов по химическому принципу. Кварц, магнетит Інгібіювання та регуляція ензимів
Інгібіювання та регуляція ензимів Аммиак. Состав вещества
Аммиак. Состав вещества Le trasformazioni fisiche della materia. Tema 3
Le trasformazioni fisiche della materia. Tema 3 Введение в химию
Введение в химию Обмен нуклеотидов
Обмен нуклеотидов Основні технологічні процеси очистки води. Знезараження води. Знезараження води хлором
Основні технологічні процеси очистки води. Знезараження води. Знезараження води хлором Возраст в геологии
Возраст в геологии Соединения щелочных металлов
Соединения щелочных металлов Оксиди: поняття, склад і назви, фізичні властивості, поширеність у природі, використання
Оксиди: поняття, склад і назви, фізичні властивості, поширеність у природі, використання Аммиак. Образование молекулы аммиака
Аммиак. Образование молекулы аммиака Химическая связь. (Лекция 4, 5)
Химическая связь. (Лекция 4, 5) Гетерофункциональные производные бензольного ряда как лекарственные средства
Гетерофункциональные производные бензольного ряда как лекарственные средства Кислородные соединения азота
Кислородные соединения азота Закон сохранения массы веществ. Химические уравнения
Закон сохранения массы веществ. Химические уравнения Метаболизм кетоновых тел. Метаболизм холестерина
Метаболизм кетоновых тел. Метаболизм холестерина Предельные углеводороды
Предельные углеводороды Теория электролитической диссоциации (ТЭД)
Теория электролитической диссоциации (ТЭД) Массообменные процессы
Массообменные процессы Снежинки. Рождение снежинки
Снежинки. Рождение снежинки Аномальные свойства воды
Аномальные свойства воды Алмастырылмайтын аминқышқылды алу биотехнологиясы
Алмастырылмайтын аминқышқылды алу биотехнологиясы Промежуточные фазы в металлических сплавах
Промежуточные фазы в металлических сплавах Моющие и чистящие средства
Моющие и чистящие средства