Содержание
- 2. 1789г. Роберт Бойль 1673г. 1748г. М. В. Ломоносов Антуан Лавуазье
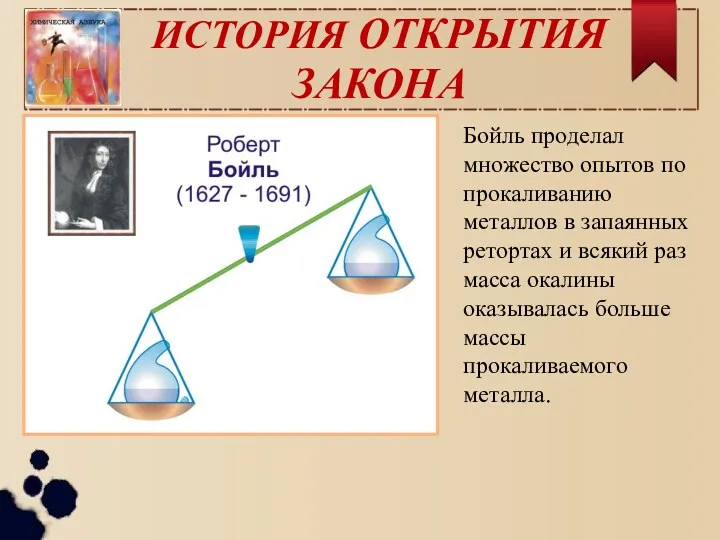
- 3. ИСТОРИЯ ОТКРЫТИЯ ЗАКОНА Бойль проделал множество опытов по прокаливанию металлов в запаянных ретортах и всякий раз
- 4. ИСТОРИЯ ОТКРЫТИЯ ЗАКОНА Русский учёный М.В. Ломоносов предположил, что чувственный опыт обманывает нас. 5 июля 1748
- 5. М.В Ломоносов сформулировал закон сохранения массы в 1748 г., а экспериментально подтвердил в 1756 г. Закон
- 6. История открытия закона Значительно позже этот закон, независимо от М.В. Ломоносова, был открыт французским ученым А.Лавуазье.
- 7. Химические уравнения Химическое уравнение – условная запись химической реакции с помощью химических формул и коэффициентов Исходные
- 8. Алгоритм составления уравнений 1. В левой части уравнения записываем химические формулы реагентов (веществ, вступающих в реакцию).
- 9. Алгоритм составления уравнений 3. Согласно закону сохранения массы веществ число атомов до и после реакции должно
- 10. Закрепление 1. Cu + O2 → CuO 2. HCl → H2 +Cl2 3. Ag2O + C
- 12. Скачать презентацию








 Простые и сложные полиэфиры. Пентапласт
Простые и сложные полиэфиры. Пентапласт Нефть. Способы её переработки. Фракции нефти
Нефть. Способы её переработки. Фракции нефти Методика изучения и описание вулканогенных обломочных пород
Методика изучения и описание вулканогенных обломочных пород Алкены. Ненасыщенные углеводороды, непредельные углеводороды, этиленовые углеводороды. Олефины (10 класс)
Алкены. Ненасыщенные углеводороды, непредельные углеводороды, этиленовые углеводороды. Олефины (10 класс) Общая характеристика физико-химических методов анализа лекарственных веществ
Общая характеристика физико-химических методов анализа лекарственных веществ Химическая связь
Химическая связь Химическая связь. Ковалентная связь
Химическая связь. Ковалентная связь Типы химических соединений, номенклатура, свойства
Типы химических соединений, номенклатура, свойства Аминокислоты. Химические свойства
Аминокислоты. Химические свойства Химические свойства толуола
Химические свойства толуола Моющие средства
Моющие средства Теория резонанса в неорганической химии
Теория резонанса в неорганической химии Основы кристаллохимии
Основы кристаллохимии fosfor_i_ego_soedineniya
fosfor_i_ego_soedineniya Prezentatciya
Prezentatciya Химическая термодинамика. Лекция 5
Химическая термодинамика. Лекция 5 Cross-section sample preparation using focused ion beam system (FIB) for transmission electron microscopy (TEM)
Cross-section sample preparation using focused ion beam system (FIB) for transmission electron microscopy (TEM) Химия и война. Альманах
Химия и война. Альманах Метангидратное ружье. Задача 3. Команда: Когнитивная машина
Метангидратное ружье. Задача 3. Команда: Когнитивная машина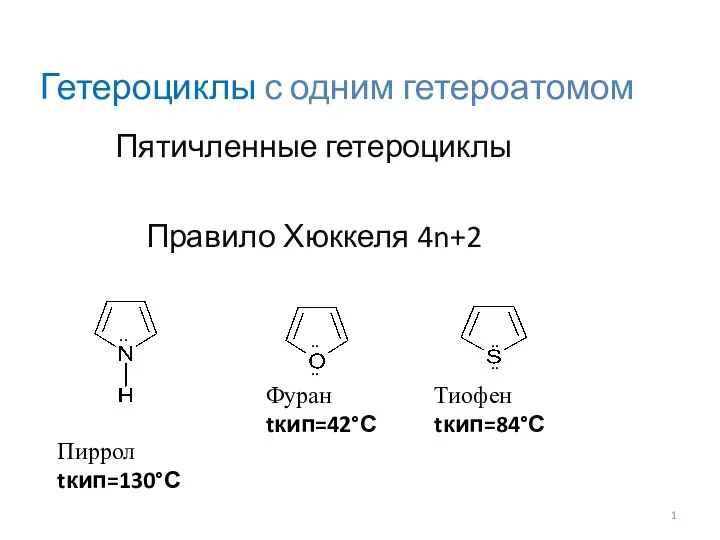 Гетероциклы с одним гетероатомом
Гетероциклы с одним гетероатомом Углеводы. Моносахариды
Углеводы. Моносахариды Подготовка к ГИА. А14. Определение характера среды раствора кислот и щелочей с помощью индикаторов. Реакции на ионы в растворе
Подготовка к ГИА. А14. Определение характера среды раствора кислот и щелочей с помощью индикаторов. Реакции на ионы в растворе Водород
Водород Фенолы. Классификация фенолов
Фенолы. Классификация фенолов Полімери. Природні полімери
Полімери. Природні полімери Основные типы фуллероидных наночастиц
Основные типы фуллероидных наночастиц Мир кристаллов. Изучение теоретического материала по теме Кристалл
Мир кристаллов. Изучение теоретического материала по теме Кристалл Хром. Хром в организме человека
Хром. Хром в организме человека