Содержание
- 2. Определять понятие химическая связь (характеристику связи). 2. Рассматривать классификацию ХС. 3. Рассматривать общий механизм образования ковалентной
- 3. «Вопрос о природе химической связи – сердце всей химии» Брайк Кроунфорд-мл.
- 4. От берега до берега Можно сделать мост. Соединить два атома В молекулу – вопрос…
- 5. Почему атомы соединяются друг с другом? Всегда ли молекулы образованы по одному механизму? Зависит ли прочность
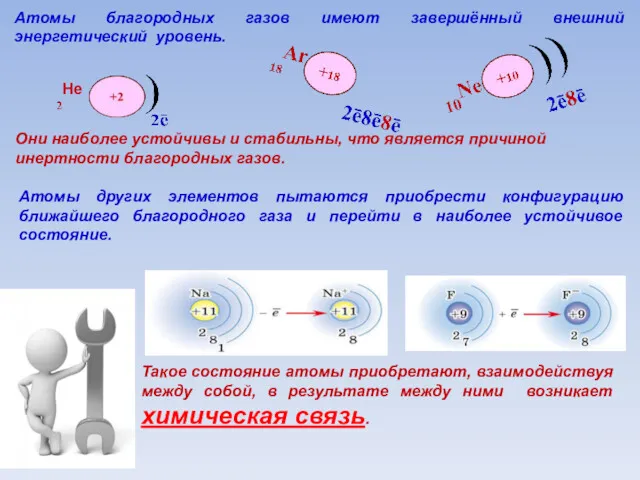
- 6. Атомы благородных газов имеют завершённый внешний энергетический уровень. Атомы других элементов пытаются приобрести конфигурацию ближайшего благородного
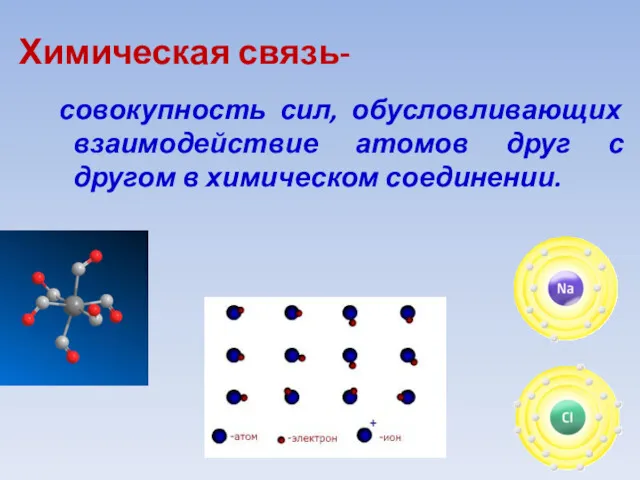
- 7. Химическая связь- совокупность сил, обусловливающих взаимодействие атомов друг с другом в химическом соединении.
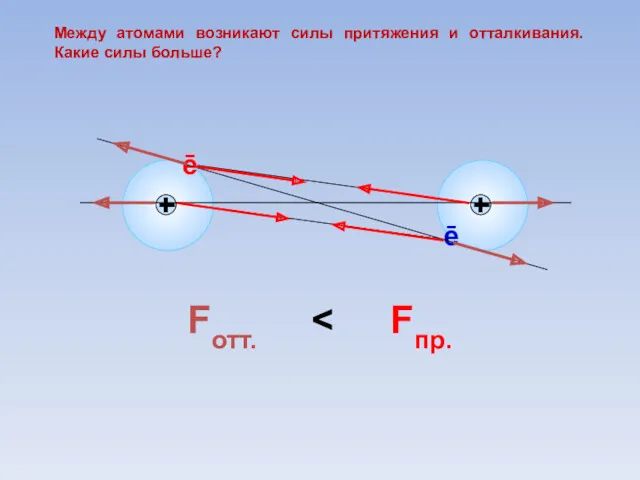
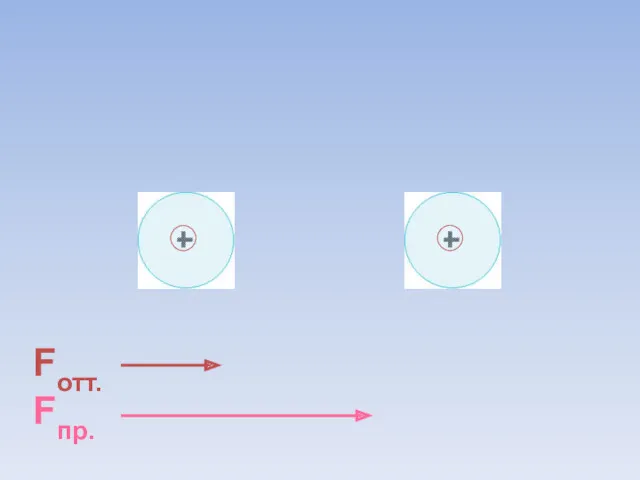
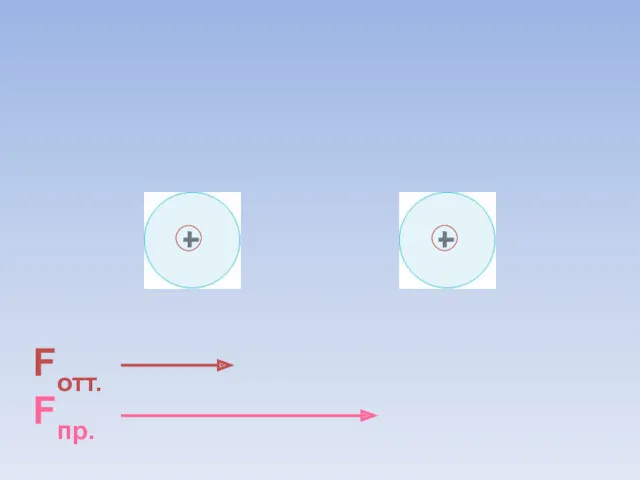
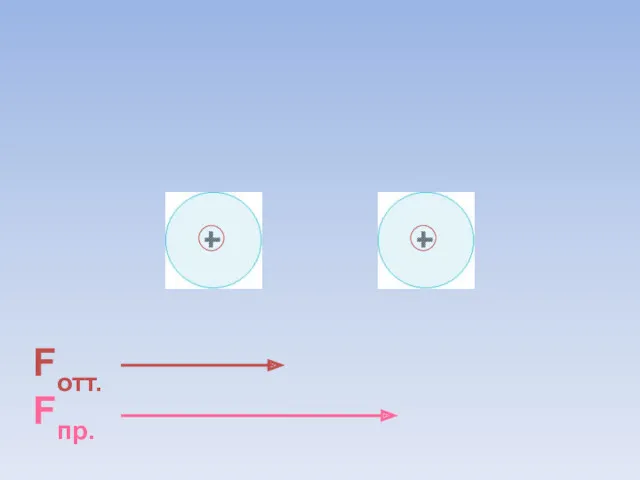
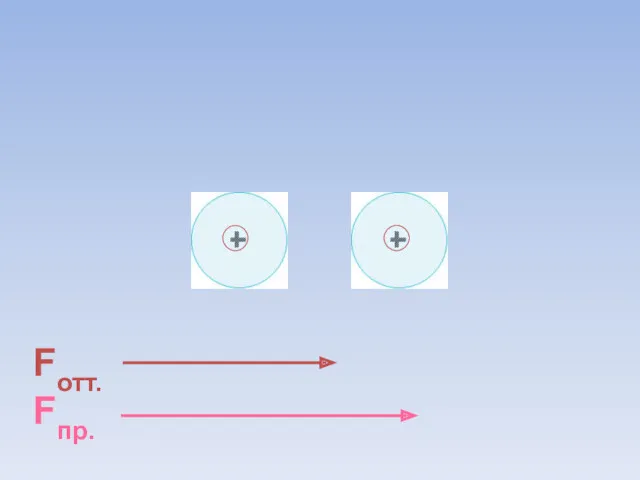
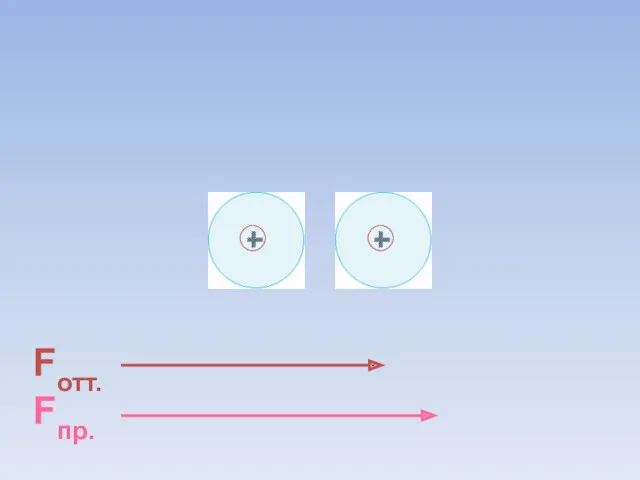
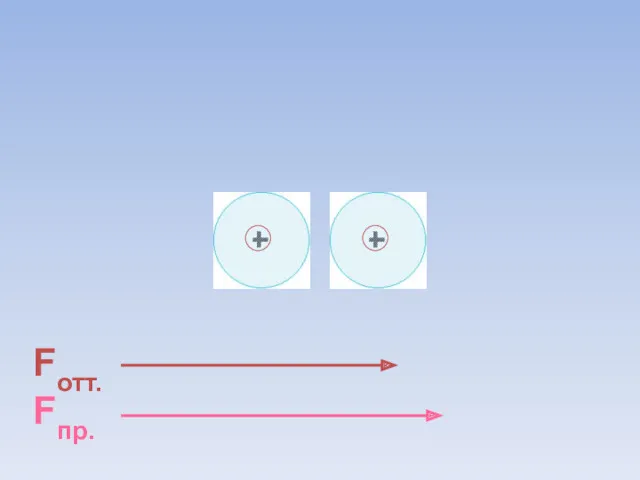
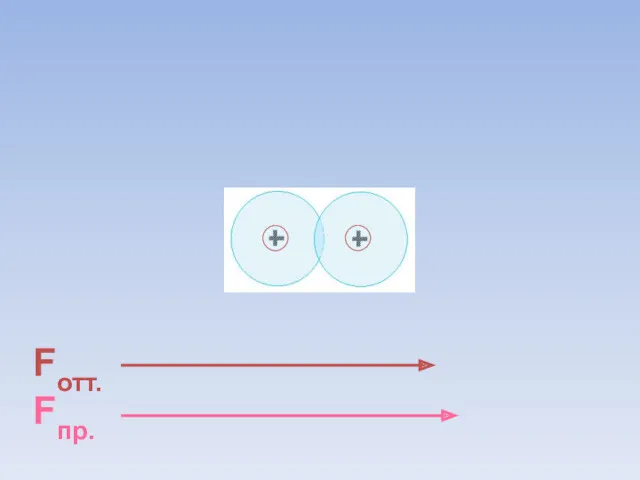
- 8. Fотт. Fпр. ē ē Между атомами возникают силы притяжения и отталкивания. Какие силы больше?
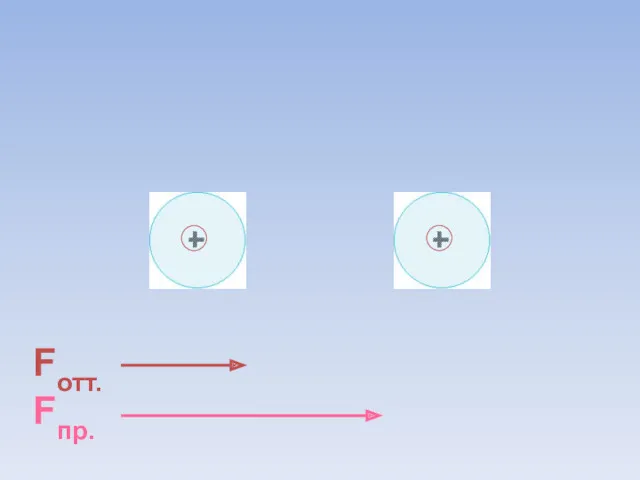
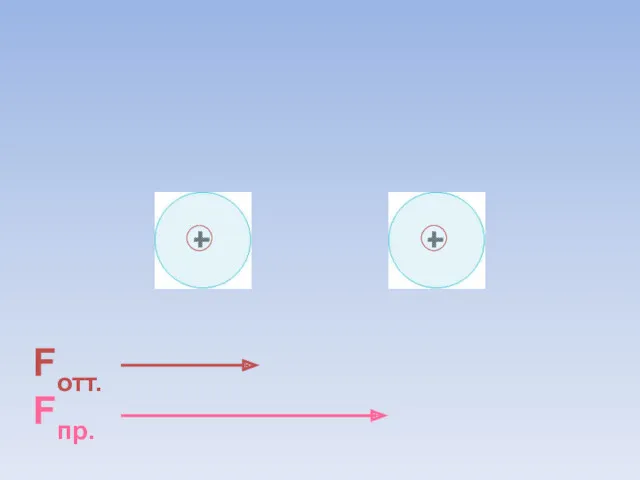
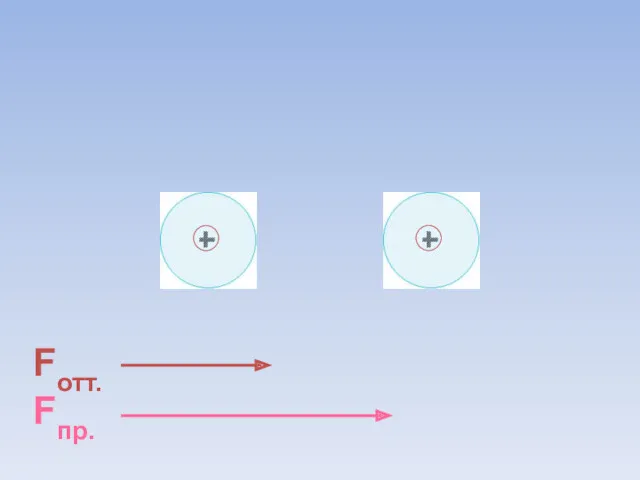
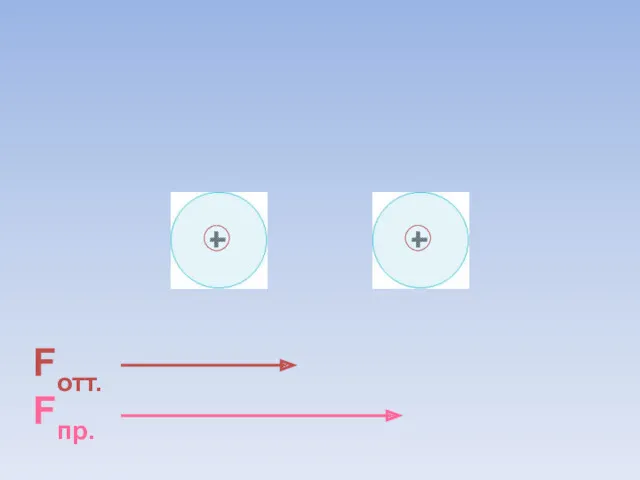
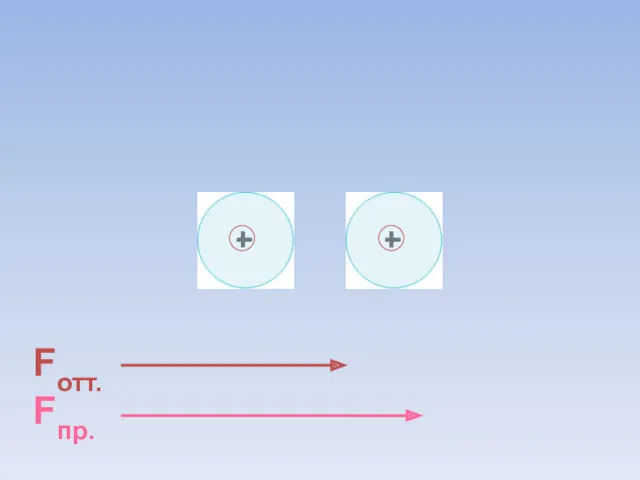
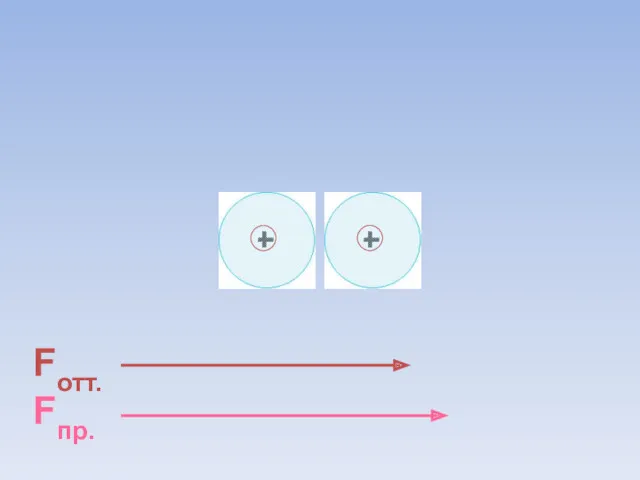
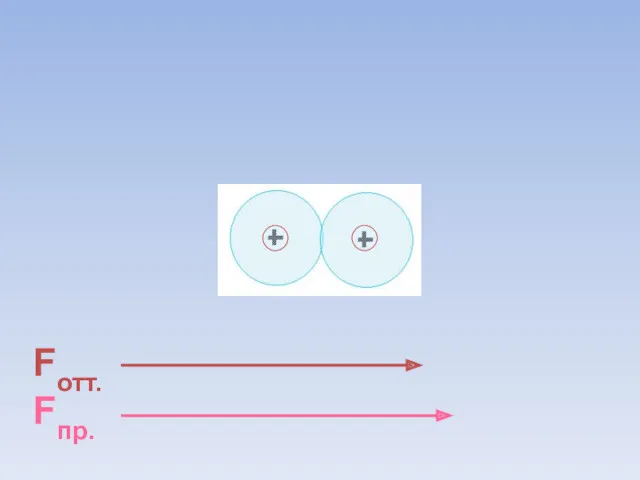
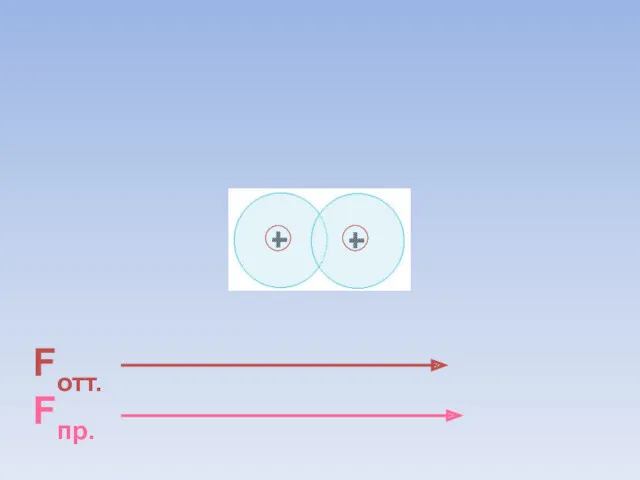
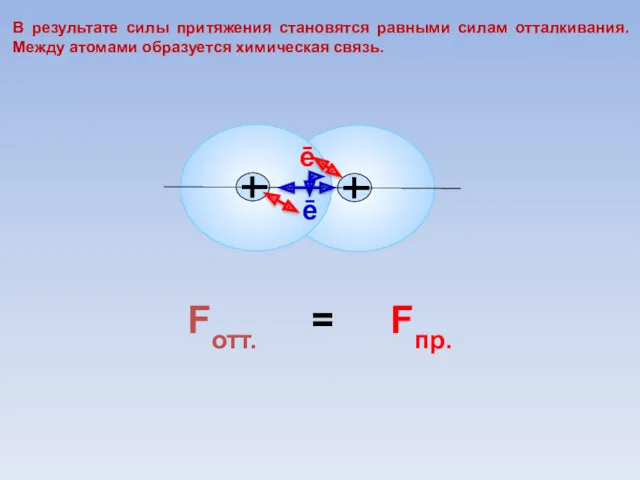
- 30. Fотт. Fпр. = ē ē В результате силы притяжения становятся равными силам отталкивания. Между атомами образуется
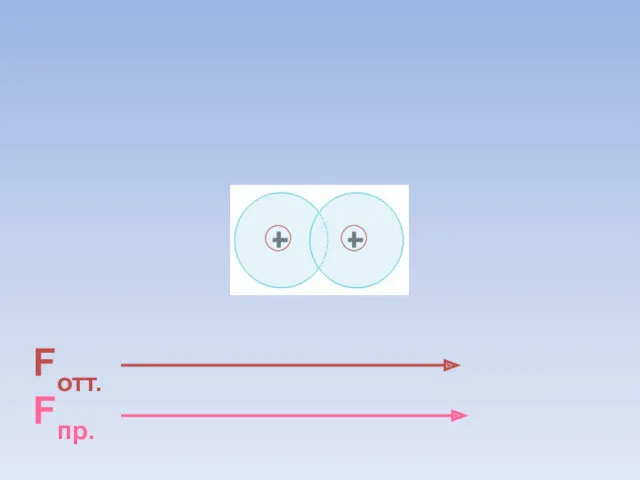
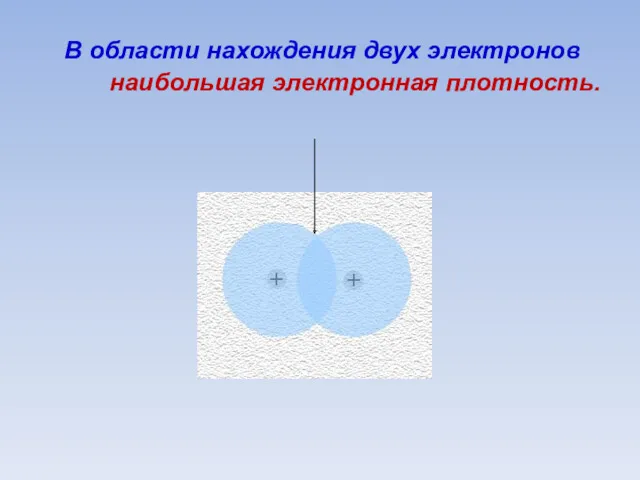
- 31. В области нахождения двух электронов наибольшая электронная плотность.
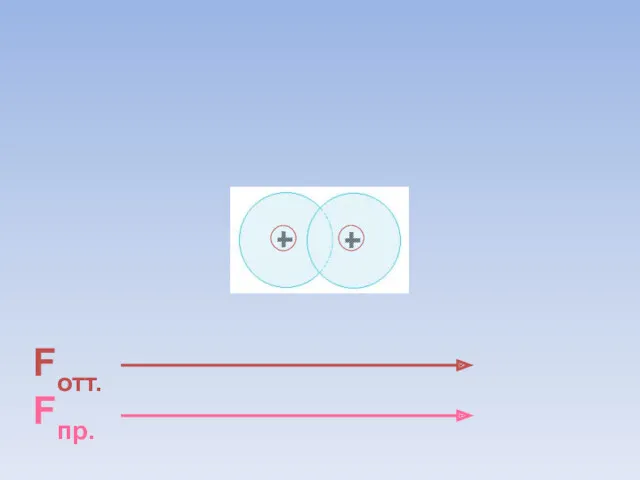
- 32. Химическая связь -это связь между атомами Химическая связь - это силы взаимодействия, которые соединяют отдельные атомы
- 33. Понятия, необходимые для определения типа химической связи: Электроотрицательность - свойство атомов данного элемента оттягивать на себя
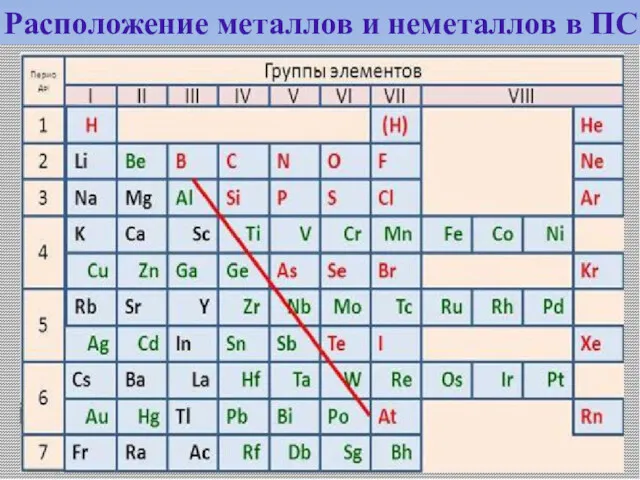
- 34. Расположение металлов и неметаллов в ПС
- 35. ВЗАИМОДЕЙСТВИЯ АТОМОВ Для атомов присуще стремление приобрести более устойчивую и энергетически выгодную электронную конфигурацию, характерную для
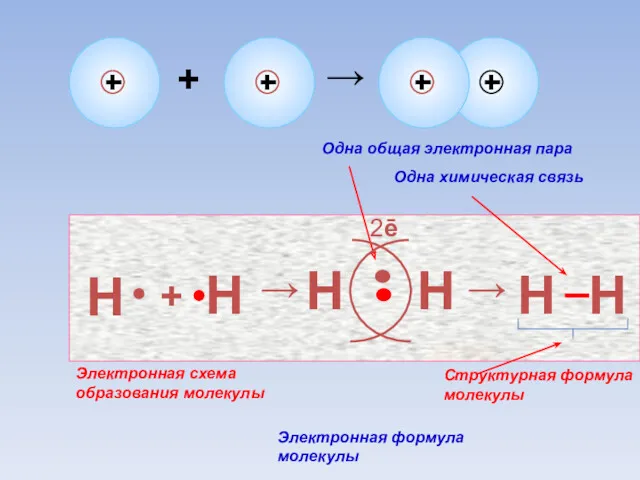
- 36. Н + Н → Н Н 2ē Одна общая электронная пара Электронная формула молекулы Электронная схема
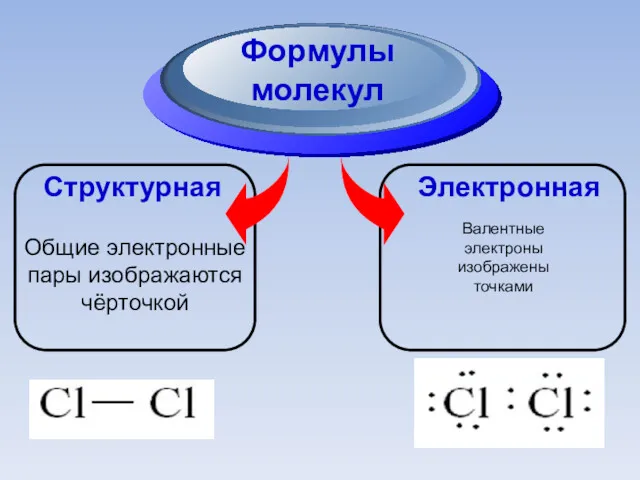
- 37. Структурная Формулы молекул Электронная Общие электронные пары изображаются чёрточкой Валентные электроны изображены точками
- 39. Тест Задание №1 Что такое электроотрицательность? Пользуясь ПСХЭ распределите перечисленные элементы в порядке возрастания значений электроотрицательности:
- 40. 3. В ряду элементов F→ Cl→ Br→ I с увеличением порядкового номера химического элемента ЭО Увеличивается
- 41. Тест Задание №1 Ответ:Cl,O,I,S,Br 4.В приведенных ниже формулах подчеркните атомы наиболее ЭО элементов KCl ; Na2O;
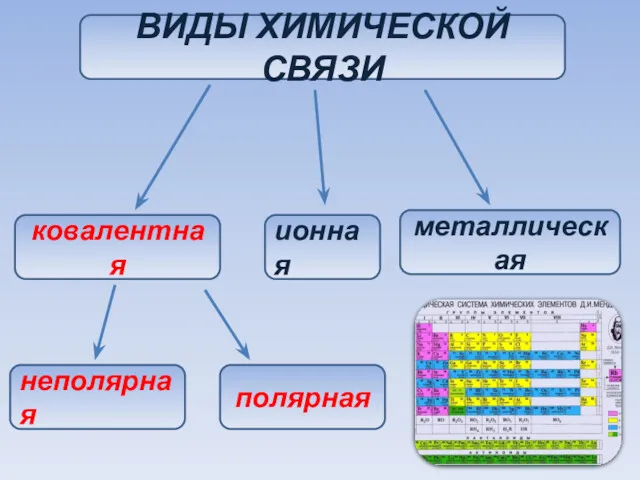
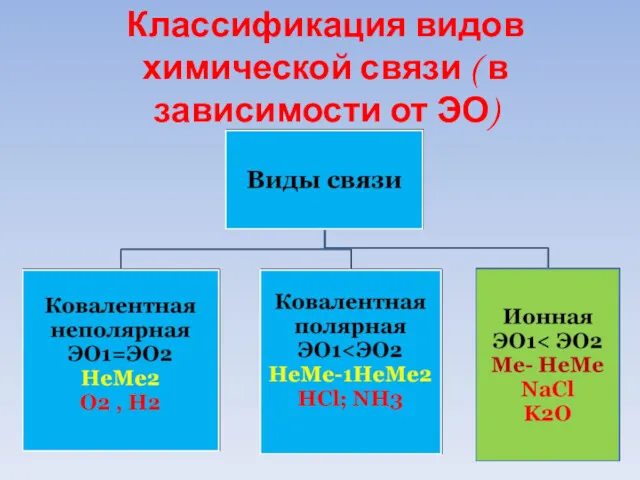
- 42. ВИДЫ ХИМИЧЕСКОЙ СВЯЗИ ковалентная ионная металлическая неполярная полярная
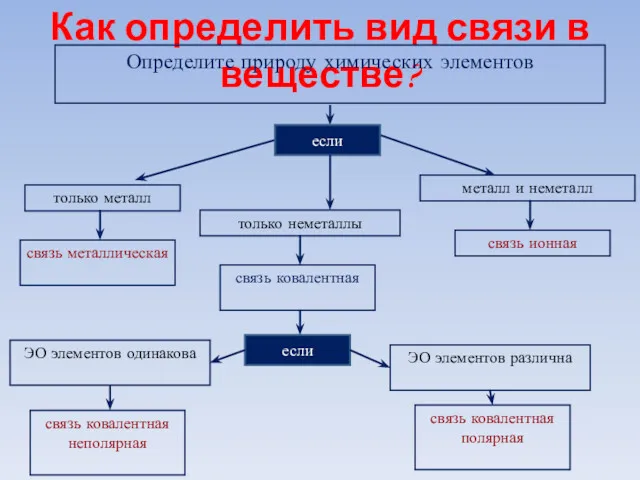
- 43. Как определить вид связи в веществе? Определите природу химических элементов если только металл только неметаллы металл
- 44. Классификация видов химической связи ( в зависимости от ЭО)
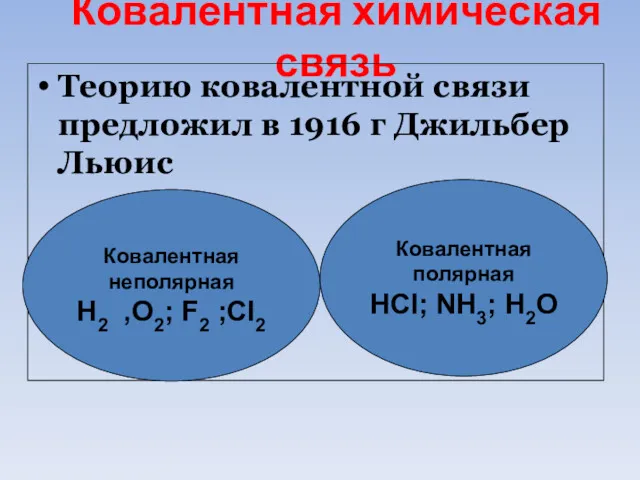
- 45. Ковалентная связь: - это связь между атомами, в результате образования общих электронных пар.
- 46. Ковалентная химическая связь Теорию ковалентной связи предложил в 1916 г Джильбер Льюис Ковалентная неполярная Н2 ,О2;
- 47. Механизм образования ковалентной связи: В общем виде: А . В . А : В + Неспаренные
- 48. Виды ковалентной связи Образуется между атомами с одинаковой ЭО Например: H2 Cl2 O2 N2 Общая электронная
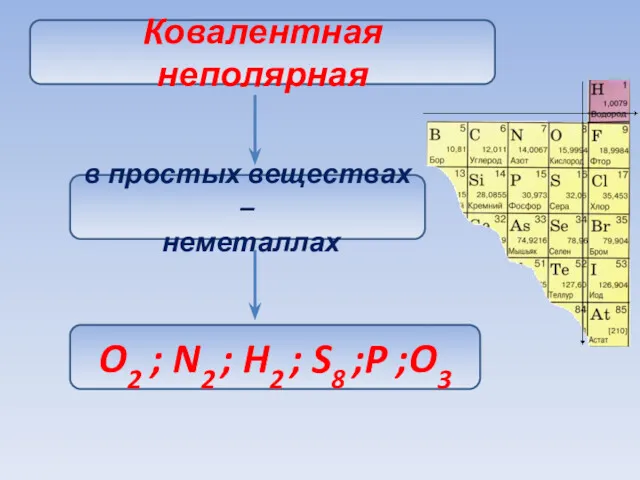
- 49. Ковалентная неполярная в простых веществах – неметаллах O2 ; N2 ; H2 ; S8 ;P ;O3
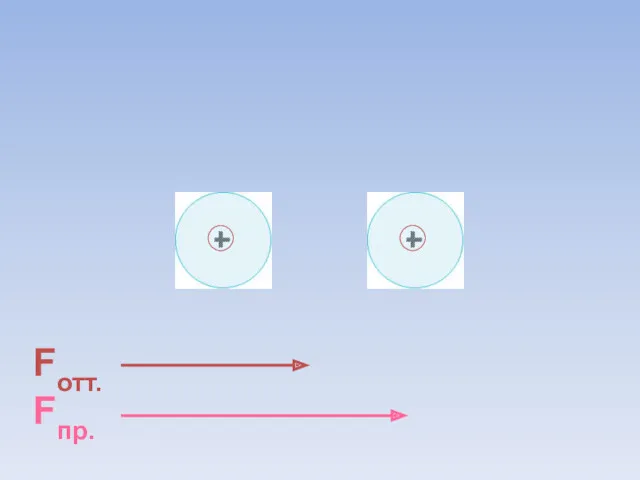
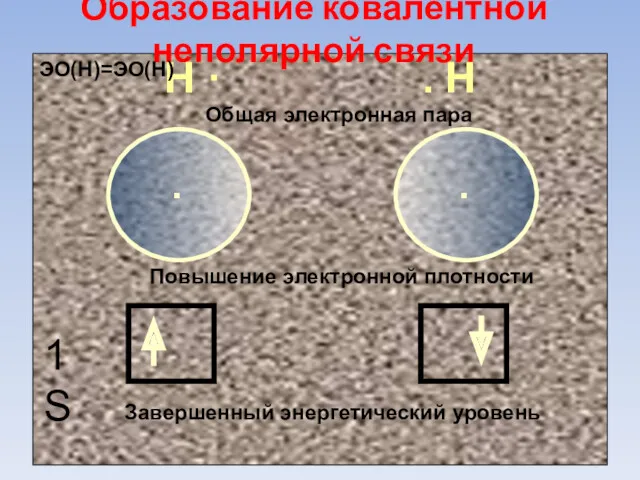
- 50. Образование ковалентной неполярной связи в молекуле H2
- 51. Образование ковалентной неполярной связи Н · . Н . . 1S Повышение электронной плотности Завершенный энергетический
- 52. КНС образуют атомы одного и того же химического элемента. Механизм образования связи. Каждый атом неметалла отдает
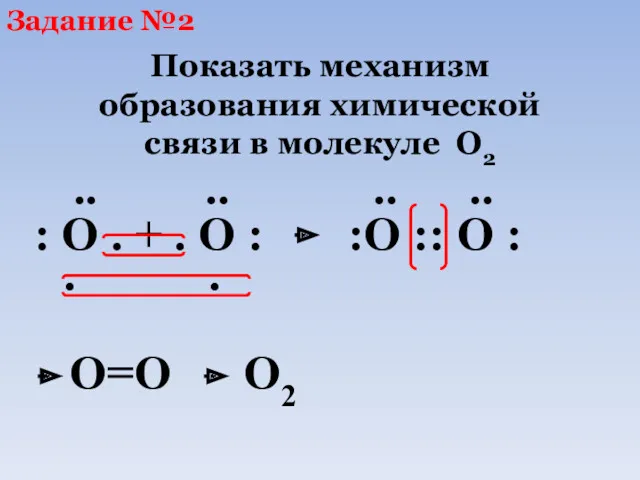
- 53. .. .. .. .. : O . + . O : :O :: O : •
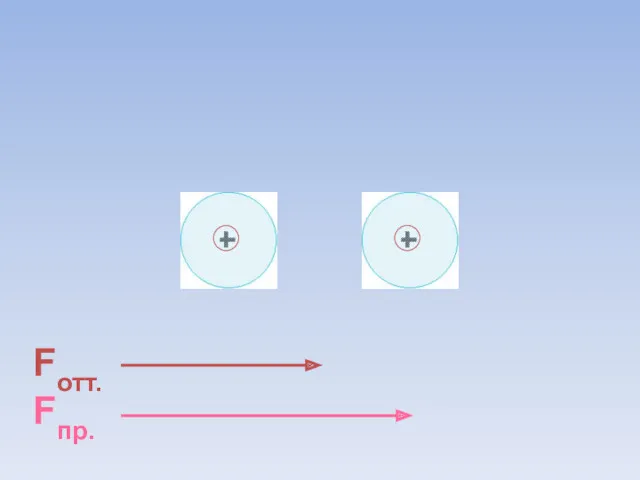
- 54. Образование ковалентной неполярной связи в молекуле O2
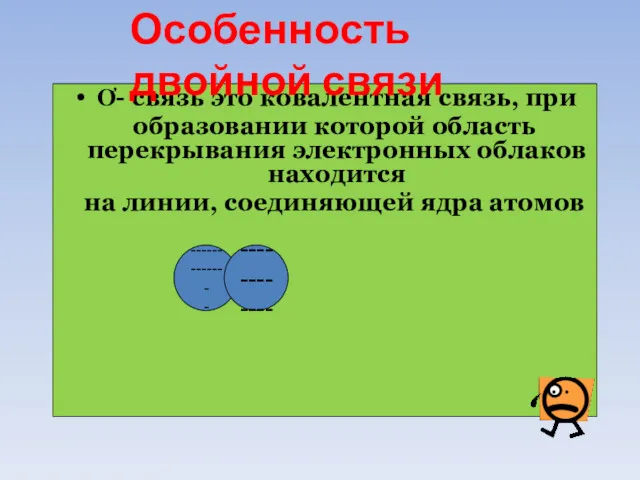
- 55. Ơ- связь это ковалентная связь, при образовании которой область перекрывания электронных облаков находится на линии, соединяющей
- 56. Особенность двойной связи ɲ - это связь , при образовании которой область перекрывания электронных облаков находится
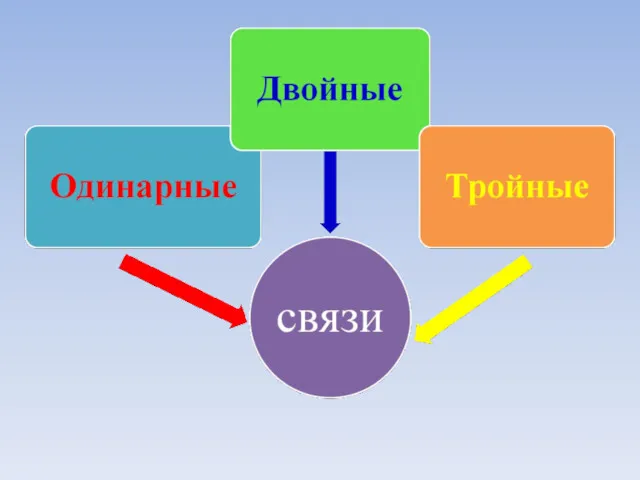
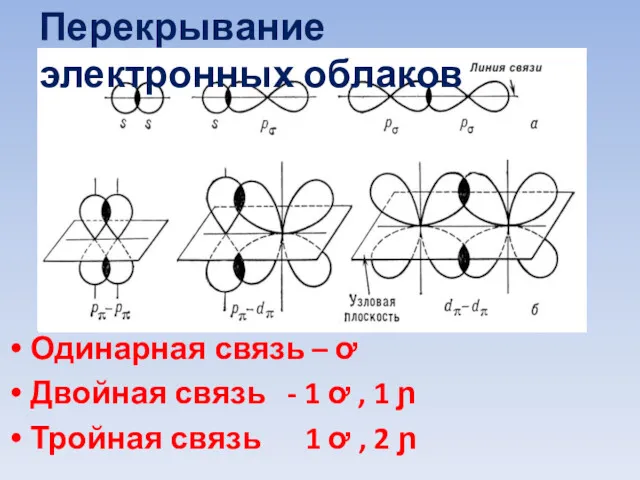
- 57. Перекрывание электронных облаков Одинарная связь – ơ Двойная связь - 1 ơ , 1 ɲ Тройная
- 58. Задание №3 Показать механизм образования химической связи в молекуле N2
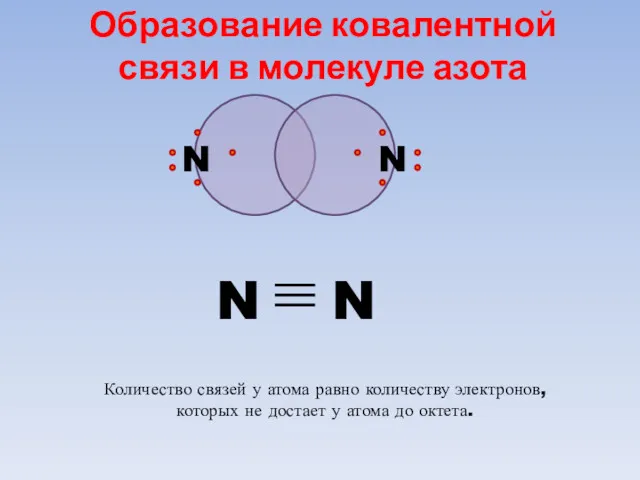
- 59. N N Образование ковалентной связи в молекуле азота Количество связей у атома равно количеству электронов, которых
- 60. Образование ковалентной неполярной связи в молекуле N2
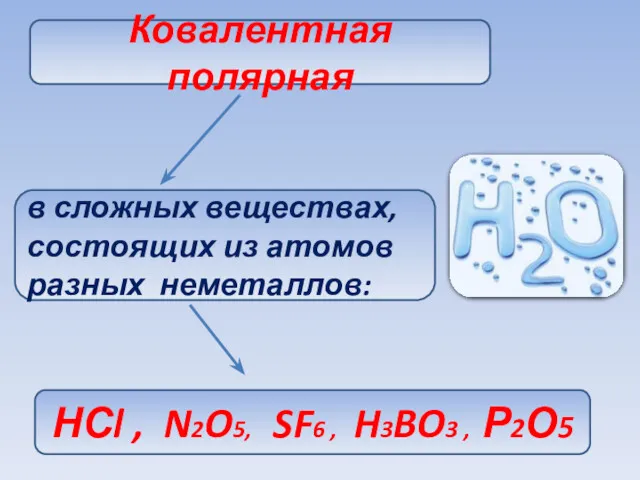
- 61. Ковалентная полярная в сложных веществах, состоящих из атомов разных неметаллов: НСl , N2O5, SF6 , H3BO3
- 62. КПС образуют атомы разных неметаллов (с разной электороотрицательностью). Самый электроотрицательный элемент – F. Механизм образования связи.
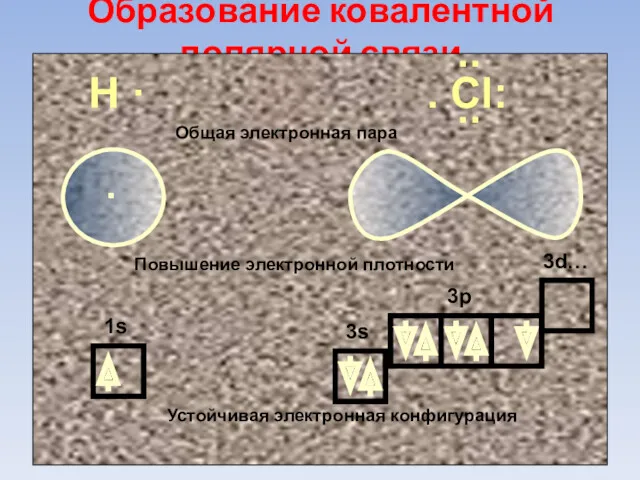
- 63. Образование ковалентной полярной связи Н · . Сl: . Повышение электронной плотности Устойчивая электронная конфигурация Общая
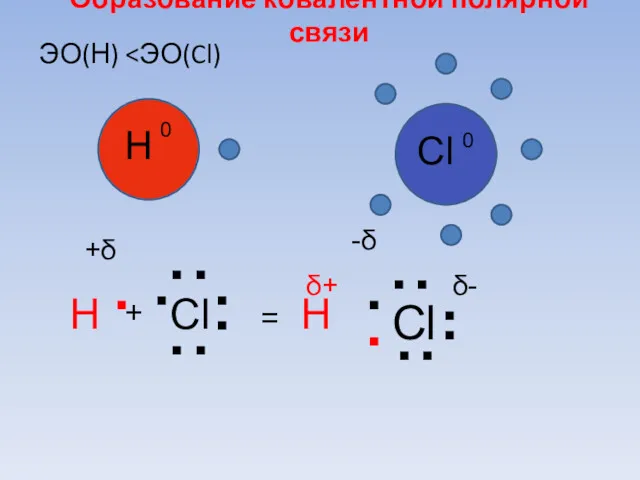
- 64. . . Образование ковалентной полярной связи .. Cl ЭО(Н) H Сl +δ 0 -δ 0 Н
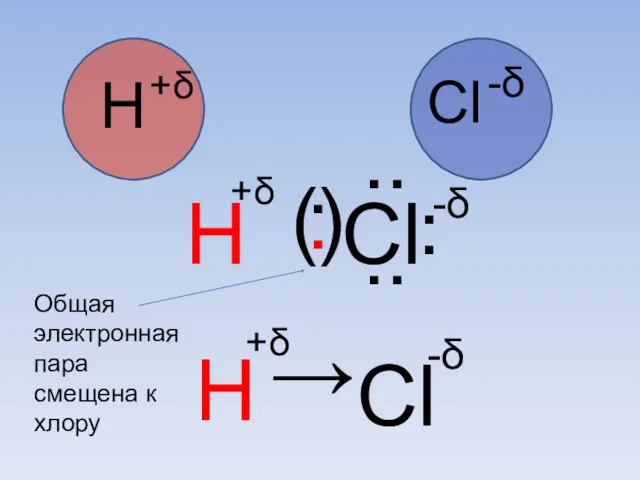
- 65. . ( . ) .. Cl H +δ Cl -δ H . . .. H →
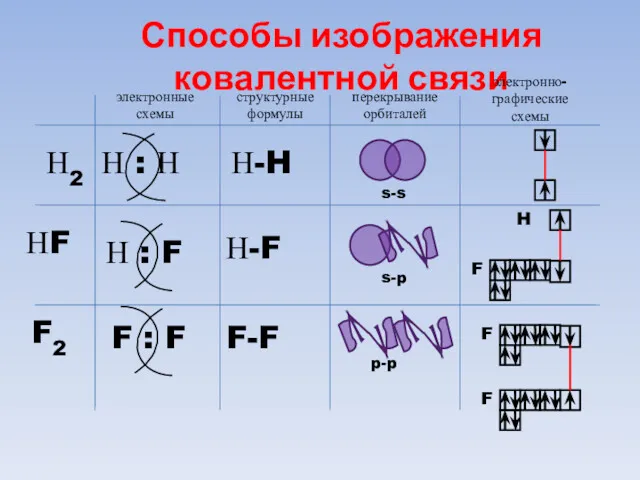
- 66. Способы изображения ковалентной связи электронные схемы структурные формулы перекрывание орбиталей электронно-графические схемы Н2 НF F2 Н-F
- 67. Энергия связи Энергия, которую надо затратить на разрыв связи ( мера ее прочности) Измеряется в кдж/моль
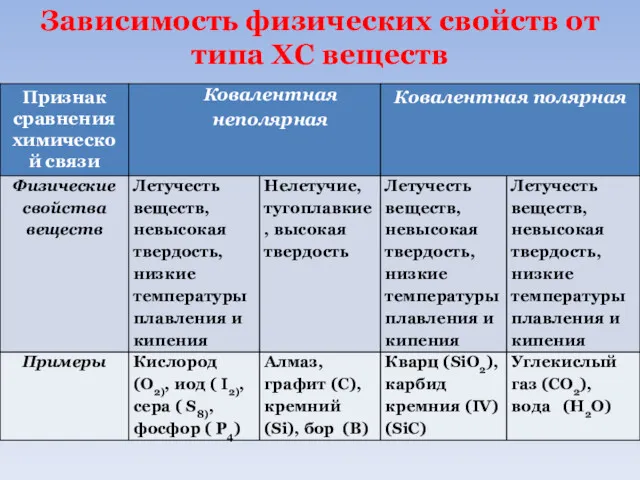
- 68. Зависимость физических свойств от типа ХС веществ
- 69. ТЕСТ №2 CaO H2O
- 70. Задание №1. Связь, идущая с образованием общих электронных пар: ионная; 2) ковалентная; 3) металлическая?
- 71. Задание №2. Ковалентная полярная связь возникает между: одинаковыми атомами неметаллов; одинаковыми атомами металлов; 3) разными атомами
- 72. Задание №3. Электроотрицательность – это способность атомов: образовывать общие электронные пары; 2) принимать электроны; 3) отдавать
- 73. Задание № 4. При образовании ковалентной полярной связи общая электронная пара смещается: к более ЭО элементу;
- 74. Задание № 5. Наиболее ЭО элементом является: 1) хлор; 2) азот; 3) фтор; 4) фосфор
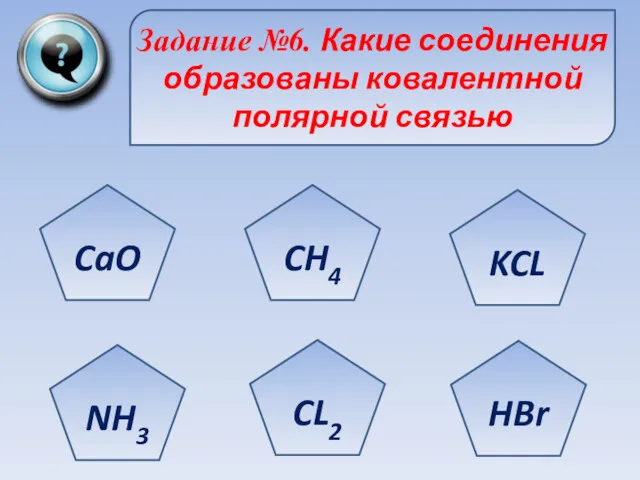
- 75. Задание №6. Какие соединения образованы ковалентной полярной связью CaO NH3 CL2 HBr KCL CH4
- 76. Задание №7. Из перечня веществ выберите формулы с ковалентной неполярной связью Cl2 CO2 Mg H2O O3
- 77. Задание №8. Выберите группу веществ, в состав которой входят только вещества с ковалентной неполярной связью: N2
- 78. Задание №9. Выберите группу веществ, в состав которой входят только вещества с ковалентной полярной связью: N2
- 79. Задание №10. Распределите вещества KF H2 H2O Al2О3 О3 NH3 N2 LiBr NaCl CO2 Cl2 NaI
- 80. СПАСИБО ЗА ВНИМАНИЕ!!!
- 81. Рефлексия 1.На уроке я работал… 2.Своей работой на уроке я… 3.Урок для меня показался… 4.За урок
- 83. Скачать презентацию

































 Подгруппа серы и ее соединения
Подгруппа серы и ее соединения Галогены. Фтор, хлор, бром, йод, астат
Галогены. Фтор, хлор, бром, йод, астат Results of lab test NG RO: Bypass, UV-lamp, membrane Toray 3012 800-1000 GPD
Results of lab test NG RO: Bypass, UV-lamp, membrane Toray 3012 800-1000 GPD Строение и электрический заряд коллоидных частиц. Электрокинетические явления
Строение и электрический заряд коллоидных частиц. Электрокинетические явления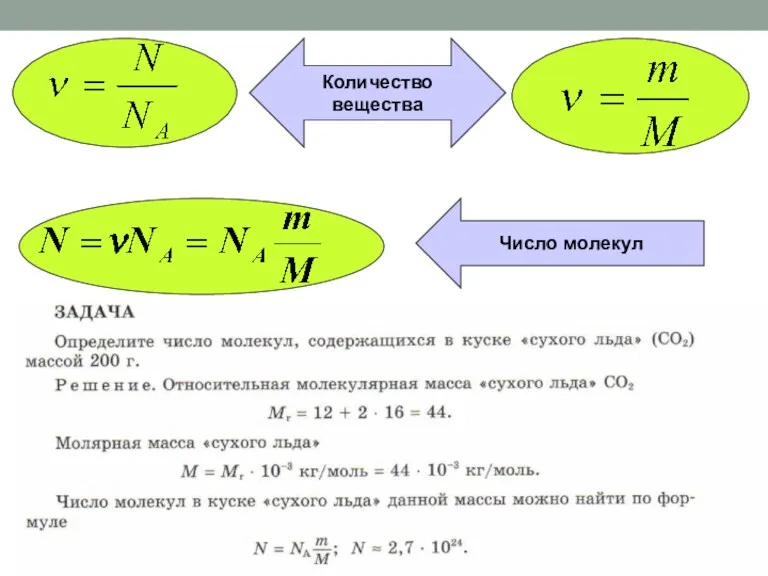 Количество вещества
Количество вещества Физические методы стабилизации масел
Физические методы стабилизации масел Химический элемент кремний
Химический элемент кремний Поверхностные явления. Типы поверхностных явлений
Поверхностные явления. Типы поверхностных явлений Нанотехнологии и Наноматериалы
Нанотехнологии и Наноматериалы Правила по технике безопасности в химической лаборатории
Правила по технике безопасности в химической лаборатории Железо, его физические и химические свойства. Урок химии в 9 классе
Железо, его физические и химические свойства. Урок химии в 9 классе Влияние газированных напитков на организм человека
Влияние газированных напитков на организм человека ПРИРОДНЫЕ ИСТОЧНИКИ УГЛЕВОДОРОДОВ
ПРИРОДНЫЕ ИСТОЧНИКИ УГЛЕВОДОРОДОВ Химический факультет
Химический факультет Химиялық элемент оттегі
Химиялық элемент оттегі Сплавы железа с углеродом: стали и чугуны
Сплавы железа с углеродом: стали и чугуны Ауыр металлдар
Ауыр металлдар ООО Ангарский Азотно-туковый завод. Основы производства аммиака
ООО Ангарский Азотно-туковый завод. Основы производства аммиака Основания. Номенклатура оснований
Основания. Номенклатура оснований Железо. Соединения железа
Железо. Соединения железа Біріншілік алкилсульфаттар және алкилэтоксисульфаттар немесе біріншілік спирттегі сульфоэфирдің тұздары. 4 Лекция
Біріншілік алкилсульфаттар және алкилэтоксисульфаттар немесе біріншілік спирттегі сульфоэфирдің тұздары. 4 Лекция Воздух и его состав
Воздух и его состав Тепловой эффект химической реакции, термохимические уравнения, экзо- и эндотермические реакции
Тепловой эффект химической реакции, термохимические уравнения, экзо- и эндотермические реакции Химия в повседневной жизни человека
Химия в повседневной жизни человека Главная подгруппа IV группы
Главная подгруппа IV группы Периодический закон и периодическая система химических элементов Д.И. Менделеева
Периодический закон и периодическая система химических элементов Д.И. Менделеева Кинетика химических реакций. Химическое равновесие
Кинетика химических реакций. Химическое равновесие Свойства и биологическая роль карбонильных соединений
Свойства и биологическая роль карбонильных соединений