Содержание
- 2. Предпосылки открытия периодического закона Периодический закон Д.И. Менделеева Значение периодического закона Периодическая система химических элементов Д.И.
- 3. Первые попытки систематизации элементов и веществ Перечень «простых веществ, не разложимых никакими известными процессами анализа» Первая
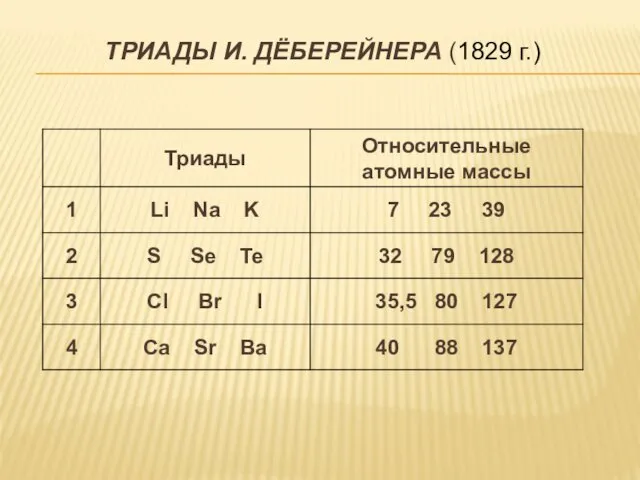
- 4. ТРИАДЫ И. ДЁБЕРЕЙНЕРА (1829 г.)
- 5. ЧАСТЬ РАСПРЕДЕЛЕНИЯ ЭЛЕМЕНТОВ ПО «ОКТАВАМ» Д. НЬЮЛЕНДСА (1863 г.)
- 6. ПОЛНАЯ ТАБЛИЦА ЭЛЕМЕНТОВ – ПРООБРАЗ СОВРЕМЕННОЙ ПЕРИОДИЧЕСКОЙ СИСТЕМЫ ХИМИЧЕСКИХ ЭЛЕМЕНТОВ Д.И. МЕНДЕЛЕЕВА Авторский вариант полной таблицы
- 7. ПЕРИОДИЧЕСКИЙ ЗАКОН Д.И. МЕНДЕЛЕЕВА (1 марта 1869 г.) («закон периодичности» по Д.И. Менделееву) Формулировка Д.И. Менделеева:
- 8. – объективное отражение периодического закона Д.И. Менделеева; – естественная классификация химических элементов по электронным структурам их
- 9. СТРУКТУРА ПЕРИОДИЧЕСКОЙ СИСТЕМЫ ХИМИЧЕСКИХ ЭЛЕМЕНТОВ (ПСХЭ) Период – горизонтальный ряд химических элементов, расположенных в порядке возрастания
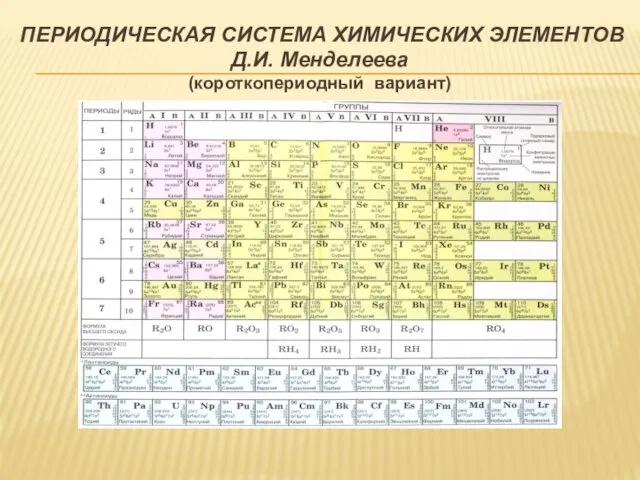
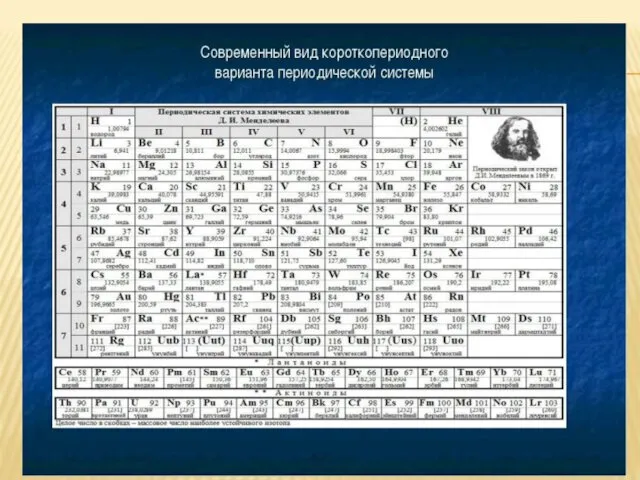
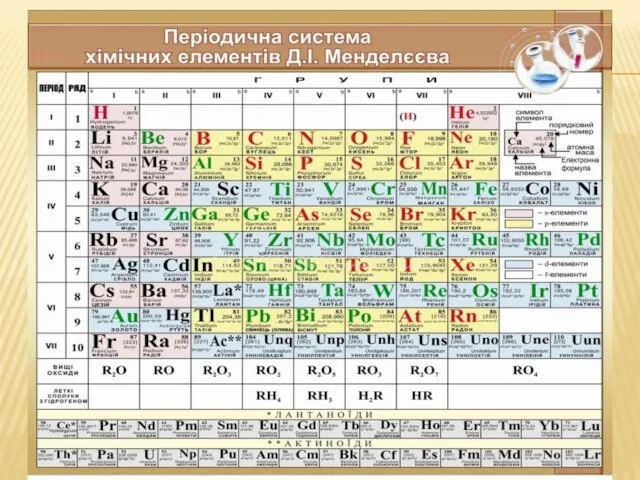
- 10. ПЕРИОДИЧЕСКАЯ СИСТЕМА ХИМИЧЕСКИХ ЭЛЕМЕНТОВ Д.И. Менделеева (короткопериодный вариант)
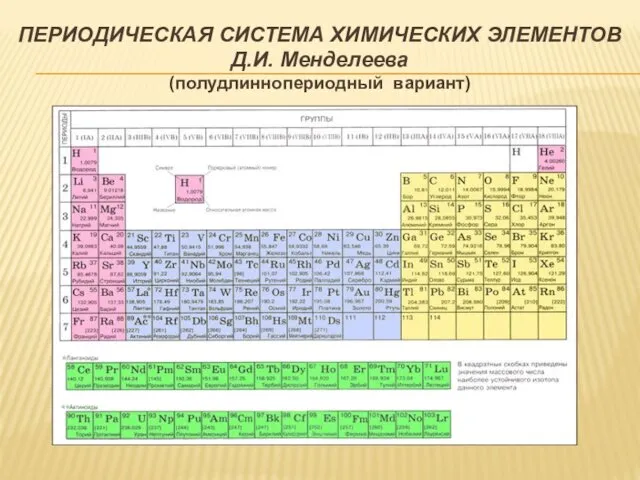
- 13. ПЕРИОДИЧЕСКАЯ СИСТЕМА ХИМИЧЕСКИХ ЭЛЕМЕНТОВ Д.И. Менделеева (полудлиннопериодный вариант)
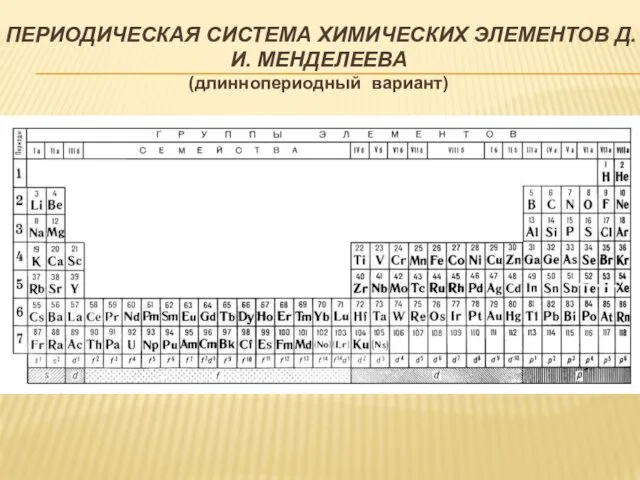
- 14. ПЕРИОДИЧЕСКАЯ СИСТЕМА ХИМИЧЕСКИХ ЭЛЕМЕНТОВ Д.И. МЕНДЕЛЕЕВА (длиннопериодный вариант)
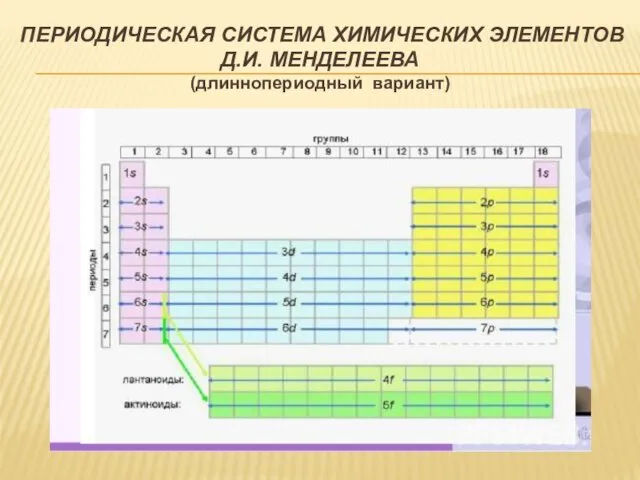
- 15. ПЕРИОДИЧЕСКАЯ СИСТЕМА ХИМИЧЕСКИХ ЭЛЕМЕНТОВ Д.И. МЕНДЕЛЕЕВА (длиннопериодный вариант)
- 16. ПЕРИОДИЧЕСКАЯ СИСТЕМА ХИМИЧЕСКИХ ЭЛЕМЕНТОВ Д.И. МЕНДЕЛЕЕВА (длиннопериодный вариант)
- 19. СТРУКТУРА ПЕРИОДИЧЕСКОЙ СИСТЕМЫ ХИМИЧЕСКИХ ЭЛЕМЕНТОВ (ПСХЭ) Группа – вертикальный ряд химических элементов, расположенных в порядке возрастания
- 20. ЕСТЕСТВЕННОНАУЧНОЕ И ФИЛОСОФСКОЕ ЗНАЧЕНИЕ ПЕРИОДИЧЕСКОГО ЗАКОНА (ПЗ) 1. ПЗ позволил рассматривать все элементы в их взаимосвязи
- 21. 4. ПЗ – научная основа химии, главным образом неорганической; он помогает решать задачи синтеза веществ с
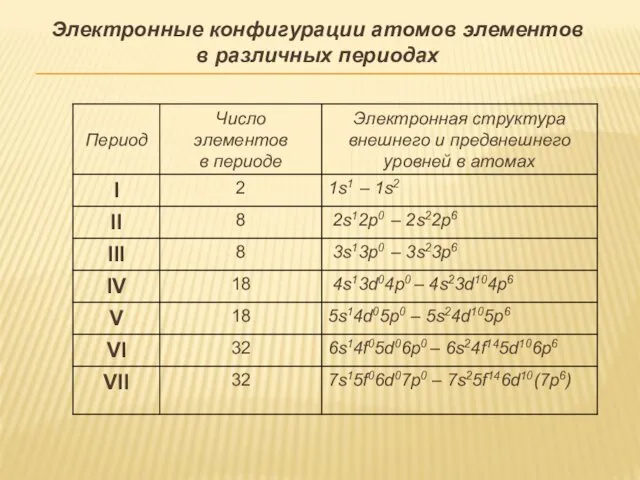
- 22. Электронные конфигурации атомов элементов в различных периодах
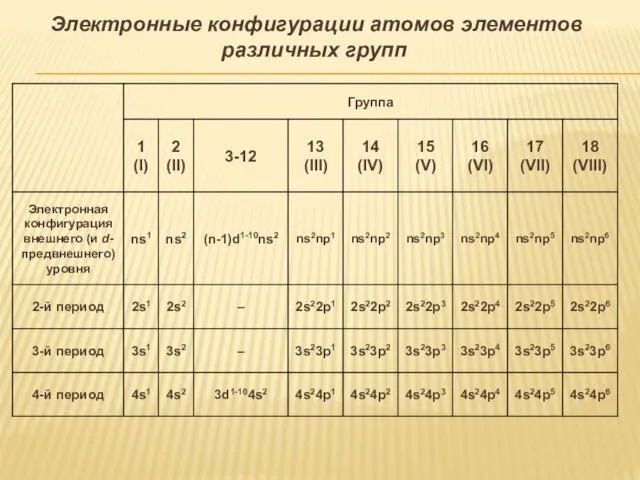
- 23. Электронные конфигурации атомов элементов различных групп
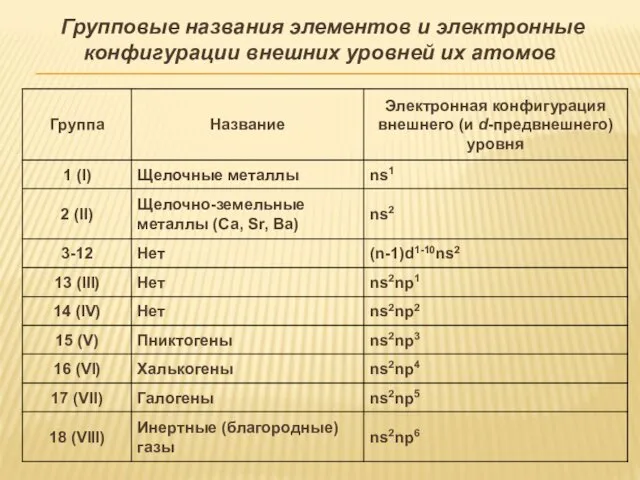
- 24. Групповые названия элементов и электронные конфигурации внешних уровней их атомов
- 25. Периодическое изменение свойств атомов, элементов и их соединений Атомный (ионный) радиус, rа (ri) – расстояние (м,
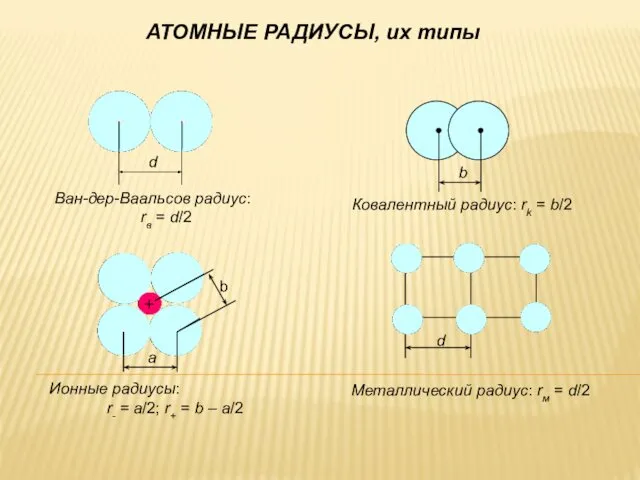
- 26. АТОМНЫЕ РАДИУСЫ, их типы
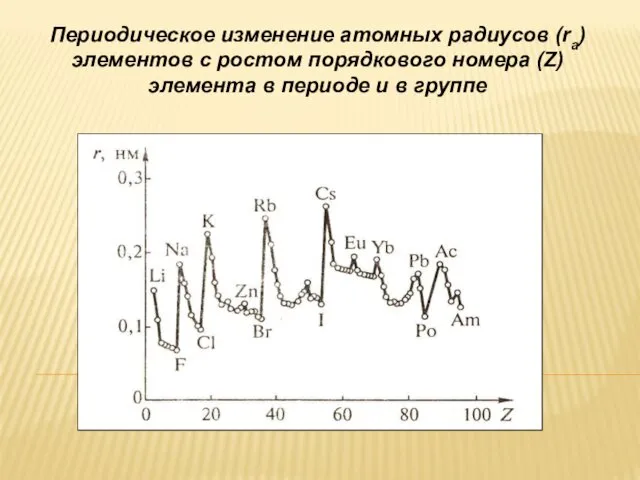
- 27. Периодическое изменение атомных радиусов (rа) элементов с ростом порядкового номера (Z) элемента в периоде и в
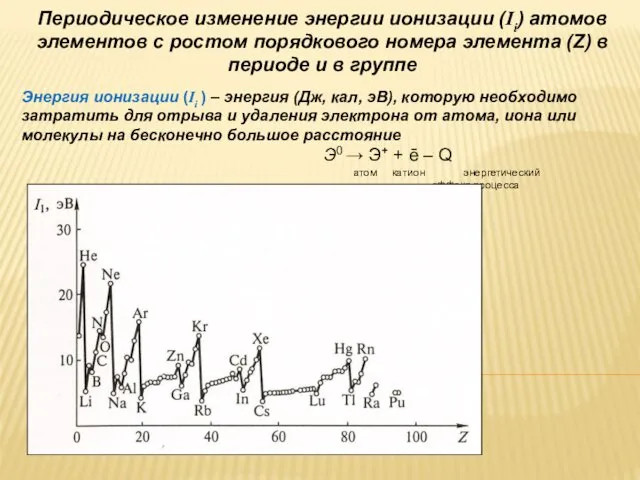
- 28. Периодическое изменение энергии ионизации (Ii) атомов элементов с ростом порядкового номера элемента (Z) в периоде и
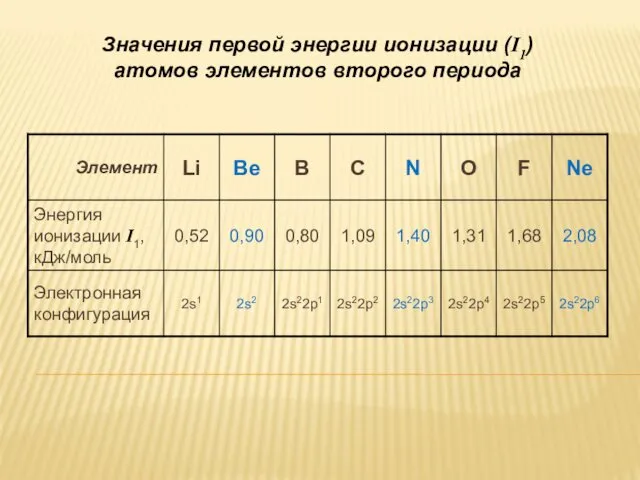
- 29. Значения первой энергии ионизации (I1) атомов элементов второго периода
- 30. Сродство к электрону, Еаē Сродство к электрону – энергия, которая выделяется (или поглощается) при присоединении электрона
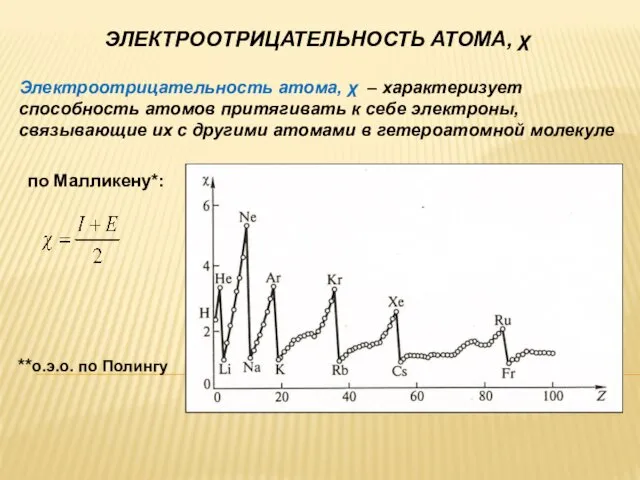
- 31. ЭЛЕКТРООТРИЦАТЕЛЬНОСТЬ АТОМА, χ Электроотрицательность атома, χ – характеризует способность атомов притягивать к себе электроны, связывающие их
- 32. Изменение свойств простых веществ, образованных элементами 2 периода Li Be B C N O F Ne
- 33. Закономерности в изменении химических свойств непереходных элементов (главных подгрупп ) элементы со сходными химическими свойствами в
- 34. Закономерности в изменении характера связи в соединениях, образованных элементами 2-го и 3-го периодов Уменьшение электроотрицательности
- 35. Восстановительные свойства металлов проявляются в реакциях: Взаимодействие с воздухом или кислородом: 2Mg + O2 = 2MgO
- 36. Окислительные свойства неметаллов проявляются в реакциях: Взаимодействие с водородом: Н2 + Cl2 = 2HCl Cl2 +
- 37. Окислительно-восстановительные свойства неметаллов Взаимодействие серы с кислородом: S + O2 = SO2 Взаимодействие азота с кислородом:
- 38. Изменение кислотно-основных свойств оксидов элементов 3 периода Na2+O Mg+2O Al2+3O3 Si+4O2 P2+5O5 S+6O3 Cl2+7O7 оснόвные амфотерный
- 39. Изменение кислотно-основных свойств гидроксидов, образованных элементами 3 периода NaOH Mg(OH)2 Al(OH)3 H2SiO3 H3PO4 H2SO4 HClO4 оснόвные
- 40. Изменение свойств водородных соединений элементов в группах (↓) и в периодах (→)
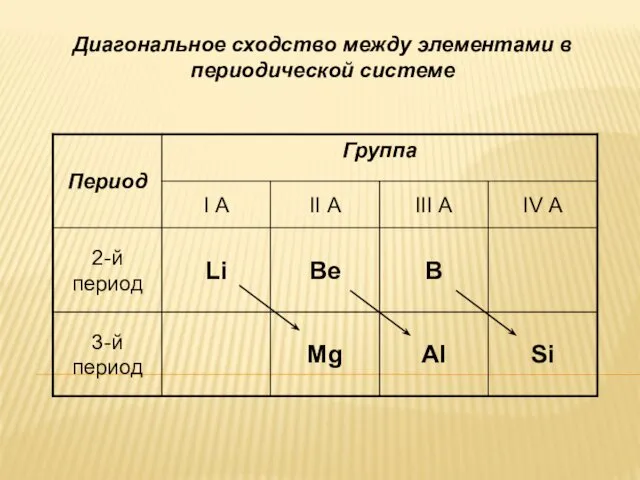
- 41. Диагональное сходство между элементами в периодической системе
- 43. Скачать презентацию
























 Автомобильные бензины
Автомобильные бензины Експлуатаційні матеріали. Пальне для карбюраторних, дизельних двигунів. Змащувальні масла, пластичні мастила військової техніки
Експлуатаційні матеріали. Пальне для карбюраторних, дизельних двигунів. Змащувальні масла, пластичні мастила військової техніки Уран – периодты жүйедегі атомдық номері 92 болатын химиялық элемент
Уран – периодты жүйедегі атомдық номері 92 болатын химиялық элемент Р-элементы VI A группы. Свойства их соединений
Р-элементы VI A группы. Свойства их соединений Basic concepts and laws of chemical thermodynamics
Basic concepts and laws of chemical thermodynamics Металдар. металдардың периодтық жүйедегі орны. Металдардың құрылысы
Металдар. металдардың периодтық жүйедегі орны. Металдардың құрылысы Щелочные металлы
Щелочные металлы Химические свойства серной кислоты
Химические свойства серной кислоты Поддержание заданного качества свинцового теплоносителя для энергетических ядерных реакторов
Поддержание заданного качества свинцового теплоносителя для энергетических ядерных реакторов Природный каучук
Природный каучук История открытия химических веществ
История открытия химических веществ Реакция Бэйлиса Хиллмана-Мориты
Реакция Бэйлиса Хиллмана-Мориты Метод окислительно-восстановительного титрования (лекция 7)
Метод окислительно-восстановительного титрования (лекция 7) Вищі карбонові кислоти. Мила. Синтетичні миючі засоби
Вищі карбонові кислоти. Мила. Синтетичні миючі засоби Аурум
Аурум Атомно-кристаллическое строение материалов
Атомно-кристаллическое строение материалов Алкены
Алкены Бензол. Бензол гомологтары. Фенолдар және ароматты аминдер
Бензол. Бензол гомологтары. Фенолдар және ароматты аминдер Природный газ и его свойства. Раздел 1
Природный газ и его свойства. Раздел 1 Сероводород. Сульфиды
Сероводород. Сульфиды Силикаты. Гранат. Берилл
Силикаты. Гранат. Берилл Получение и приминение этилена
Получение и приминение этилена Экспертные системы распознавания химических веществ. Тест
Экспертные системы распознавания химических веществ. Тест Xимия. Cr, Cu, Fe, Zn
Xимия. Cr, Cu, Fe, Zn Сероводород. Сульфиды
Сероводород. Сульфиды Маңызды мұнай өнімдері
Маңызды мұнай өнімдері Разнообразие неметаллов
Разнообразие неметаллов Химическая термодинамика. Кинетика химических реакций. Химическое равновесие
Химическая термодинамика. Кинетика химических реакций. Химическое равновесие