Слайд 2

Положение в периодической таблице:
Zn –элемент 2 группы,
побочной подгруппы, 4 периода
Zn
+ 30 )2 )8 )18 )2 1s2 2s22p6 3s23p63d10 4s2
Степень окисления +2 ZnSO4 ZnO
Слайд 3

Нахождение в природе
По содержанию в земной коре – 23 место.
Содержится
в полиметаллических рудах.
ZnS – цинковая обманка. Известно 66 минералов цинка, в частности цинкит, сфалерит, виллемит, каламин, смитсонит, франклинит. Наиболее распространенный минерал — сфалерит, или цинковая обманка. Основной компонент минерала — сульфид цинка ZnS, а разнообразные примеси придают этому веществу всевозможные цвета.
ZnCO3 – цинковый шпат
Жезказганская область, Рудный Алтай.
Слайд 4

ZnS – цинковая обманка
(сфалерит)
Слайд 5

ZnCO3 – цинковый шпат
(смитсонит)
Слайд 6

Получение
Для получения металлического цинка используют гидро- и пирометаллургический процесс.
При переработке цинковых
руд в результате их обогащения получают цинковый концентрат, который подвергают обжигу:
2ZnS + 3O2 = 2ZnO + 2SO2
затем из оксида цинка получают металлический цинк двумя способами.
Слайд 7

1. Пирометаллургический процесс
Оксид цинка сплавляют с коксом при температуре 1250–1350°С в
огнеупорных ретортах:
ZnO + C = Zn + CO;
пары цинка конденсируются.
2. Гидрометаллургический процесс
Оксид цинка растворяют в серной кислоте:
ZnO + H2SO4 = ZnSO4 + H2O;
полученный раствор сульфата цинка подвергают электролизу, на катоде выделяется цинк:
2ZnSO4 + 2H2O ?2Zn + O2 + 2H2SO4.
Для получения цинка высокой чистоты используют дистилляцию в инертной атмосфере или в вакууме.
Слайд 8

Физические свойства
Металл, серебристо-серого цвета, плотность 7,13, легкоплавкий ( 419 С)
Во
влажном воздухе покрывается оксидной пленкой.
Слайд 9

Химические свойства.
1. Взаимодействует с неметаллами
Zn + CI2 = ZnCI2
2Zn + O2
= 2 ZnO
Zn + S = ZnS
2. С водой при нагревании
Zn + H2O = ZnO + H2
3. С соляной кислотой.
Zn + 2HCI = ZnCI2 + H2
4. С серной кислотой
Zn + 2H2SO4 (K) = ZnSO4 + SO2 + 2H2O
3Zn + 4H2SO4 = 3ZnSO4 + S + 4H2O
4Zn + H2SO4 = 4ZnSO4 + H2S + 4H2O
Слайд 10

5. Взаимодействие со щелочами.
Реагирует с растворами щелочей с образованием гидроксокомплексов:
Zn +
2NaOH + 2H2O = Na2[Zn(OH)4] + H2
при сплавлении образует цинкаты:
Zn + 2KOH = K2ZnO2 + H2.
6. Взаимодействие с аммиаком
С газообразным аммиаком при 550–600°С образует нитрид цинка:
3Zn + 2NH3 = Zn3N2 + 3H2;
растворяется в водном растворе аммиака, образуя гидроксид тетраамминцинка:
Zn + 4NH3 + 2H2O = [Zn(NH3)4](OH)2 + H2.
7. Взаимодействие с оксидами и солями
Цинк вытесняет металлы, стоящие в ряду напряжения правее него, из растворов солей и оксидов:
Zn + CuSO4 = Cu + ZnSO4;
Zn + CuO = Cu + ZnO.
Слайд 11

Большая его часть находится в коже, печени, почках.
Цинк входит в состав ферментов,
обеспечивающих важнейшие физиологические функции организма:
- образование, рост и метаболизм клеток, синтез белков, заживление ран;
- активизацию иммунных реакций, направленных против бактерий, вирусов, опухолевых клеток;
- усвоение углеводов и жиров;
- поддержание и улучшение памяти;
- поддержание вкусовой и обонятельной чувствительности;
- обеспечение стабильности сетчатки и прозрачности хрусталика глаза;
- нормальное развитие и функционирование половых органов.
Человек получает цинк главным образом с пищей. Организму необходимо 10-20 мг этого минерала в день.










 Водород. Химические свойства
Водород. Химические свойства III А – топтың элементтері
III А – топтың элементтері Газовые смеси
Газовые смеси Описание основных типов магматических горных пород
Описание основных типов магматических горных пород Хлороводород, соляная кислота. Химические свойства соляной кислоты
Хлороводород, соляная кислота. Химические свойства соляной кислоты Золото. История открытия
Золото. История открытия Предмет органической химии. Органические вещества
Предмет органической химии. Органические вещества Практическое занятие по основам биохимии с методами клинико-биохимических исследований
Практическое занятие по основам биохимии с методами клинико-биохимических исследований Липолиз. Обмен кетоновых тел
Липолиз. Обмен кетоновых тел Окислительно-восстановительные реакции. (лекция №10)
Окислительно-восстановительные реакции. (лекция №10)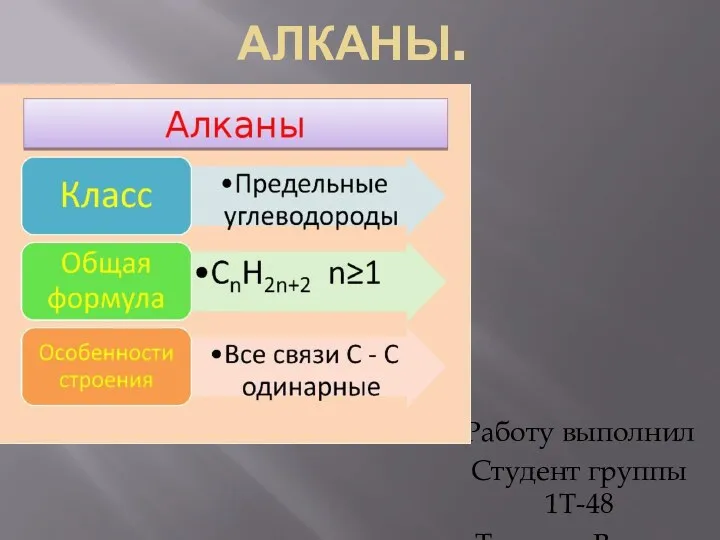 Алканы. Гомологический ряд и изомерия
Алканы. Гомологический ряд и изомерия Электролитическая диссоциация
Электролитическая диссоциация Свойства кислот в свете теории электролитической диссоциации
Свойства кислот в свете теории электролитической диссоциации Щелочноземельные металлы. Металлы II А подгруппы
Щелочноземельные металлы. Металлы II А подгруппы Кальций и его соединения
Кальций и его соединения Химические свойства основных оксидов
Химические свойства основных оксидов Типы химических реакций
Типы химических реакций Расчеты по химическим уравнениям
Расчеты по химическим уравнениям Синтез и химические модификации индиго
Синтез и химические модификации индиго Источники углеводородов
Источники углеводородов Granite
Granite Тема: хімія та їжа
Тема: хімія та їжа Сложные эфиры. Жиры. Мыла
Сложные эфиры. Жиры. Мыла Химическое кафе Кислоты
Химическое кафе Кислоты Закон сохранения массы веществ. Химические уравнения
Закон сохранения массы веществ. Химические уравнения Химический элемент алюминий
Химический элемент алюминий Хімічні властивості кисню
Хімічні властивості кисню 20230315_prezentatsiya_k_uroku_elementy_ivgruppy_glavnoy_podgruppy_
20230315_prezentatsiya_k_uroku_elementy_ivgruppy_glavnoy_podgruppy_