Слайд 2

ЦВЕТНЫЕ РЕАКЦИИ
Цветные реакции применяются для установления белковой природы вещества, идентификации белков
и определения их аминокислотного состава в различных биологических жидкостях. В клинической лабораторной практике эти методы используются для определения количества белка в плазме крови, аминокислот в моче и крови, для выявления наследственных или приобретенных нарушений обмена веществ у новорожденных.
Слайд 3

Реакция №1 «Биуретовая реакция на пептидную связь»
Принцип: в основе биуретовой реакции
лежит способность пептидных связей (-CO-NH-) образовывать с сульфатом меди в щелочной среде окрашенные комплексные соединения, интенсивность окраски которых зависит от длины полипептидной цепи.
Раствор белка дает сине-фиолетовое окрашивание.
Слайд 4

Реактивы:
1) яичный белок, 1% раствор (белок куриного яйца фильтруют через
марлю и разводят дистиллированной водой 1:10);
2) гидроокись натрия, 10% раствор;
3) сульфат меди, 1% раствор.
Слайд 5
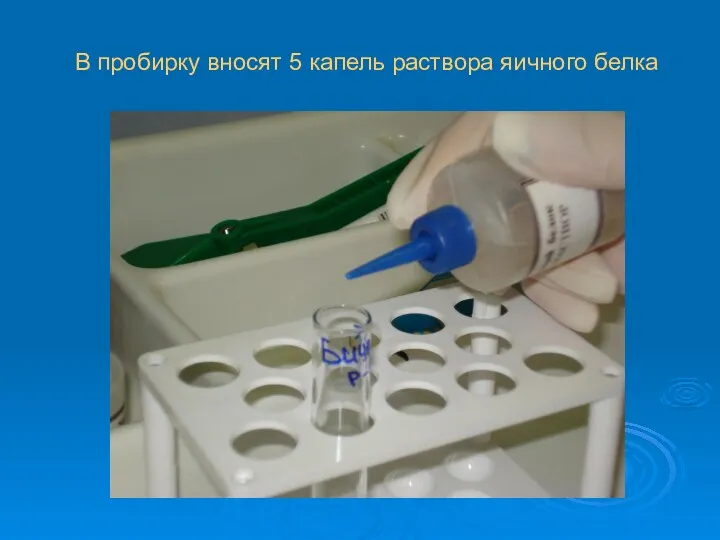
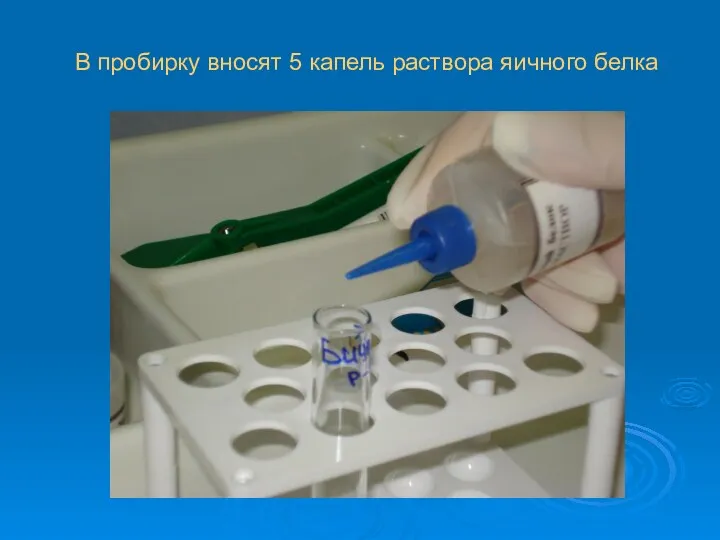
В пробирку вносят 5 капель раствора яичного белка
Слайд 6

Добавляют 3 капли гидроокиси натрия (NaOH 10%)
Слайд 7

К содержимому в пробирке добавляют 1 каплю сульфата меди (CuSO4 1%)
Слайд 8

Содержимое пробирки перемешивают
Слайд 9

В результате содержимое пробирки приобретает сине-фиолетовое окрашивание
Слайд 10

Реакция №2
«Нингидриновая реакция»
Принцип: сущность реакции состоит в образовании соединения, окрашенного
в сине-фиолетовый цвет, состоящего из нингидрина и продуктов гидролиза аминокислот.
Эта реакция характерна для аминогрупп в α-положении, которые присутствуют в природных аминокислотах и белках.
Слайд 11

Реактивы:
1) яичный белок, 1% раствор (белок куриного яйца фильтруют через
марлю и разводят дистиллированной водой 1:10);
2) нингидрин, 0,5% водный раствор.
Слайд 12
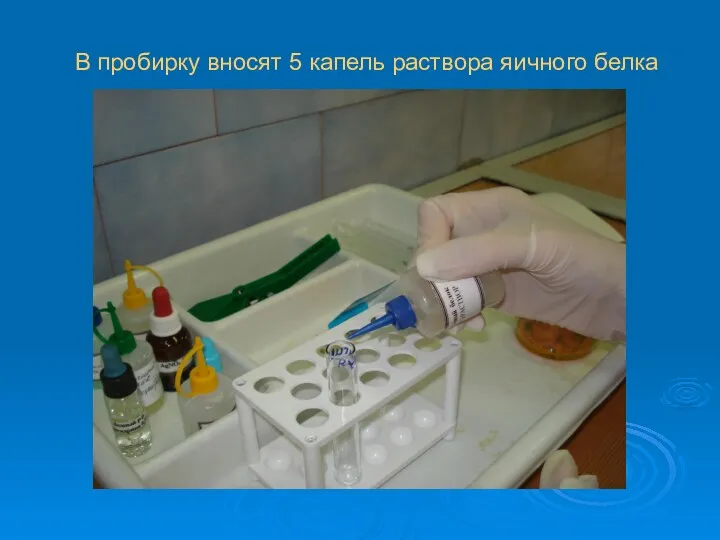
В пробирку вносят 5 капель раствора яичного белка
Слайд 13

Добавляют 5 капель раствора нингидрина
Слайд 14

Содержимое пробирки перемешивают
Слайд 15

Содержимое пробирки нагревают до кипения
Слайд 16

Развивается розово-фиолетовое окрашивание, переходящее с течением времени в сине-фиолетовое.
Слайд 17

Реакция №3
«Ксантопротеиновая реакция»
Принцип: при добавлении к раствору белка концентрированной азотной
кислоты и нагревании появляется желтое окрашивание, которое в присутствии щелочи переходит в оранжевое. Сущность реакции заключается в нитровании бензольного кольца циклических аминокислот азотной кислотой с образованием нитросоединений, выпадающих в осадок.
Реакция выявляет наличие в белке циклических аминокислот (фенилаланин, тирозин, триптофан).
Слайд 18

Реактивы:
1) яичный белок, 1% раствор (белок куриного яйца фильтруют через
марлю и разводят дистиллированной водой 1:10);
2) концентрированная азотная кислота;
3) гидроокись натрия, 10% раствор.
Слайд 19
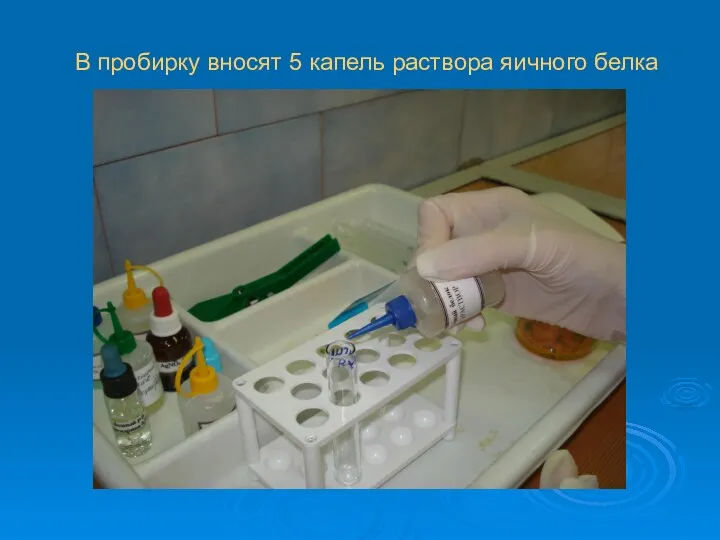
В пробирку вносят 5 капель раствора яичного белка
Слайд 20

К содержимому пробирки добавляют 3 капели концентрированной азотной кислоты (HNO3)
Слайд 21

Содержимое пробирки перемешивают
Слайд 22

Содержимое пробирки осторожно
нагревают до кипения
Слайд 23

Появляется осадок желтого цвета
Слайд 24
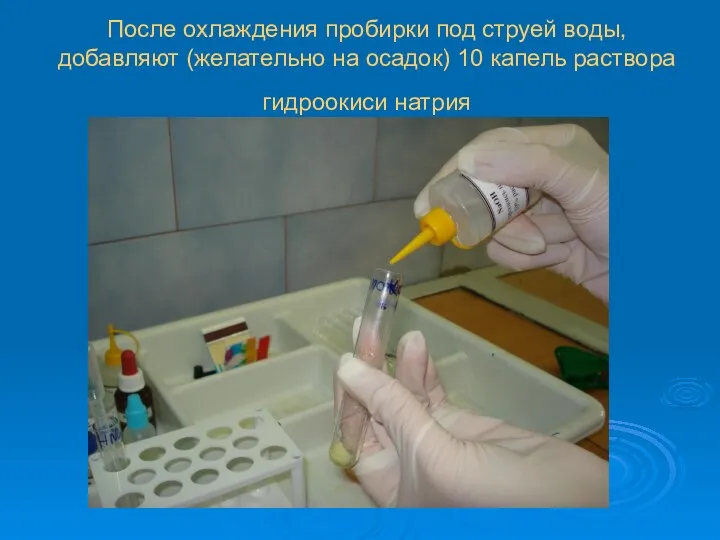
После охлаждения пробирки под струей воды, добавляют (желательно на осадок) 10
капель раствора гидроокиси натрия
Слайд 25

Появляется оранжевое окрашивание.
Слайд 26

Реакция №4
«Реакция Адамкевича»
Принцип: аминокислота триптофан в кислой среде, взаимодействуя с
альдегидами кислот, образует продукты конденсации красно-фиолетового цвета.
Слайд 27

Реактивы:
1) неразбавленный яичный белок;
2) концентрированная (ледяная) уксусная кислота;
3)
концентрированная серная кислота.
Слайд 28

В пробирку вносят 1 каплю
яичного белка (неразбавленного)
Слайд 29

Добавляют 10 капель уксусной кислоты (СН3СООН)
Слайд 30

Наклонив пробирку, осторожно по стенке добавляют каплями около 0, 5мл серной
кислоты (H2SO4) так, чтобы жидкости не смешивались.
Слайд 31

При стоянии пробирки на границе жидкостей появляется красно-фиолетовое кольцо.
Слайд 32

Реакция №5
«Реакция Фоля»
Принцип: аминокислоты, содержащие сульфгидрильные группы – SH, подвергаются щелочному
гидролизу с образованием сульфида натрия Na2S. Последний, взаимодействуя с плюмбитом натрия (образуется в ходе реакции между ацетатом свинца и гидроокисью натрия), образует осадок сульфида свинца PbS черного или бурого цвета.
Слайд 33

Реактивы:
1) неразбавленный яичный белок;
2) реактив Фоля (к 5% раствору
ацетата свинца прибавляют равный объем 30% раствора гидроокиси натрия до растворения образовавшегося осадка).
Слайд 34
В пробирку вносят 5 капель раствора яичного белка
Слайд 35

Добавляют 5 капель реактива Фоля
Слайд 36

Пробирку ставят на водяную баню и кипятят 2-3 минуты
Слайд 37

После отстаивания 1-2 минуты появляется
черный или бурый осадок.
Слайд 38

Надеемся, что наша инструкция поможет вам не сделать ошибок в практической
работе.
Желаем удачи!





































 Склад та властивості основних класів неорганічних сполук
Склад та властивості основних класів неорганічних сполук Дисперсные системы. (Лекция 6)
Дисперсные системы. (Лекция 6) Тағамдық және биологиялық белсенді қоспалар туралы жалпы мағлұматтар
Тағамдық және биологиялық белсенді қоспалар туралы жалпы мағлұматтар Физико-химические методы анализа. Лекция 3
Физико-химические методы анализа. Лекция 3 Иондық және ковалентті байланысы бар қосылыстардың электролиттік диссоциациясы
Иондық және ковалентті байланысы бар қосылыстардың электролиттік диссоциациясы Липиды. Составные части липидов
Липиды. Составные части липидов Термодинамика химического равновесия
Термодинамика химического равновесия Лаборатория красивых волос
Лаборатория красивых волос Метаболизм углеводов
Метаболизм углеводов Углерод. Аллотропные модификации
Углерод. Аллотропные модификации Квантовые процессы и химия в космосе
Квантовые процессы и химия в космосе Источники углеводородов
Источники углеводородов Керамика на основе Al2O3
Керамика на основе Al2O3 9 Амины
9 Амины Алюминий. Схема расположения электронов на энергетических подуровнях
Алюминий. Схема расположения электронов на энергетических подуровнях Минералогия литофильных редких элементов. Бор
Минералогия литофильных редких элементов. Бор Химические свойства металлов. Урок химии в 9 классе
Химические свойства металлов. Урок химии в 9 классе Химическая идентификация
Химическая идентификация Бораты и силикаты как матрицы лазеров. Свойства и методы выращивания
Бораты и силикаты как матрицы лазеров. Свойства и методы выращивания Закономерность изменений в строении электронных оболочек атома
Закономерность изменений в строении электронных оболочек атома Положение в ПСХЭ водорода, лантаноидов, актиноидов и искусственно полученных элементов
Положение в ПСХЭ водорода, лантаноидов, актиноидов и искусственно полученных элементов Электролитическая диссоциация. Степень и константа диссоциации
Электролитическая диссоциация. Степень и константа диссоциации Химическая связь и строение химических соединений
Химическая связь и строение химических соединений Классификация конструкционных материалов. Особенности атомно-кристаллического строения металлов. Лекции №1
Классификация конструкционных материалов. Особенности атомно-кристаллического строения металлов. Лекции №1 Циклоалканы
Циклоалканы Кобальт. Химический элемент
Кобальт. Химический элемент Биохимия и молекулярная биология. Биосинтез мембранных липидов. Лекция 9
Биохимия и молекулярная биология. Биосинтез мембранных липидов. Лекция 9 Мир первозданной красоты. Природные уникумы Урала
Мир первозданной красоты. Природные уникумы Урала