Содержание
- 2. 8. Концентрация дегеніміз не? 9. Масалық үлесті қалай анықтаймыз? 10. Неге су мен бензин араласпайды?
- 3. Диссоциация деген не? Электролиттер деген не? Бейэлектролиттер деген не? Катион және анион деген не? Диссоциациялану теориясын
- 4. Мына теңдеулерді аяқтаңдар: Na2CO3 + HCI K3PO4 + H2SO4 Au+H2SO4 NaOH + HCI Fe(OH)3 + HNO3
- 5. Сабақтың тақырыбы: Лабораториялық жұмыс №2 «Иондық және ковалентті байланысы бар қосылыстардың электролиттік диссоциациясы».
- 6. Сабақтың мақсаты 9.3.4.7 H+(сулы)және OH-(сулы) иондарын түзуге бейім заттардың иондалуын білу; 9.3.4.8 сулы ерітіндіде H+(сулы) ионының
- 7. Бағалау критерийлері: -өз әрекеті мен нәтижелер кестесіндегі бақылауларды айқындайды; -қышқылдық және негіздік ортаны сипаттайтын иондарды анықтайды;
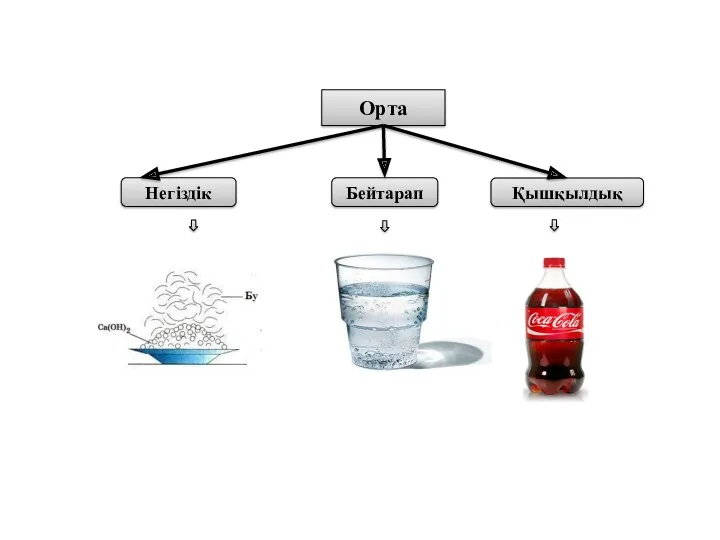
- 9. Орта Негіздік Бейтарап Қышқылдық
- 10. Индикатор
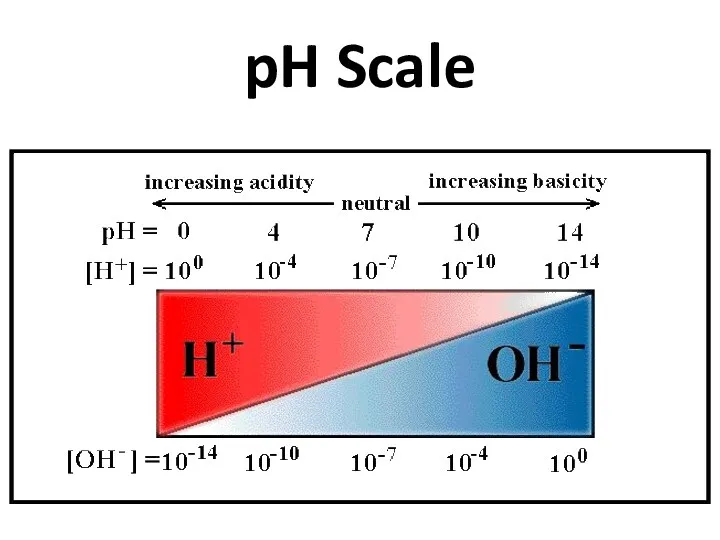
- 11. Индикатордың түсі Индикатор – ерітіндінің ортасына байланысты түсін өзгертетін заттар Кез – келген ортаның сандық көрсеткішін
- 12. pH Scale
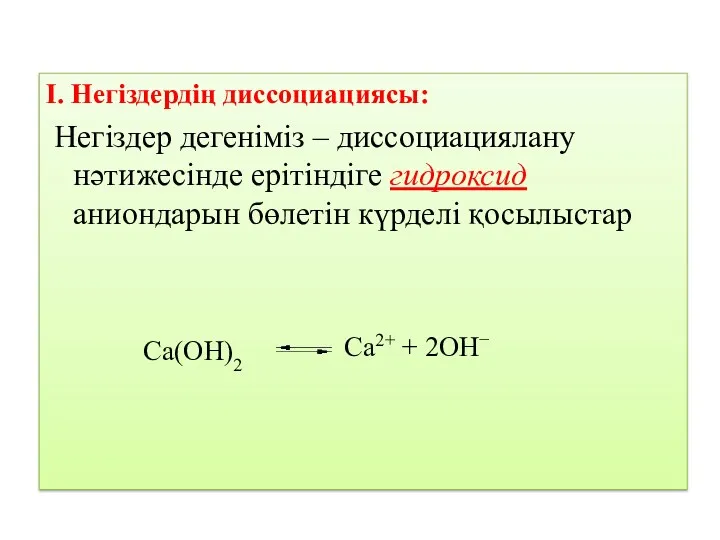
- 13. І. Негіздердің диссоциациясы: Негіздер дегеніміз – диссоциациялану нәтижесінде ерітіндіге гидроксид аниондарын бөлетін күрделі қосылыстар Ca(OH)2 Ca2+
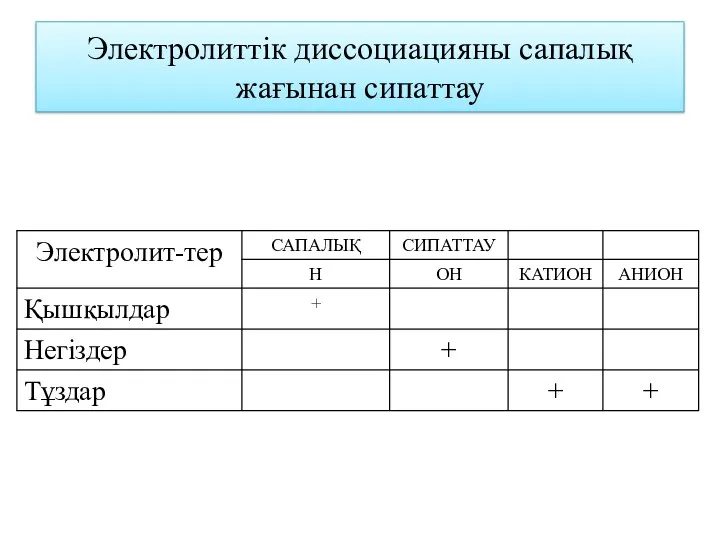
- 14. ІІ. Қышқылдардың диссоциациялануы Қышқылдар дегеніміз – диссоциациялану нәтижесінде ерітіндіге сутек катиондарын бөлетін күрделі заттар H2SO4 2H+
- 15. ІІІ. Тұздардың диссоциациялану Тұздар дегеніміз – диссоциациялану нәтижесінде ерітіндіге металл катиондары мен қышқыл қалдығының аниондарын бөлетін
- 16. Электролиттік диссоциацияны сапалық жағынан сипаттау
- 17. ТАПСЫРМА МЫНА ҚОСЫЛЫСТАРДЫҢ ДИССОЦИАЦИЯЛАНУЫ ТЕҢДЕУЛЕРІН ЖАЗЫҢДАР: Na2CO3, HCL Fe( OH)2 HNO3 AlCl3, H2CO3 Na3PO4, H2SO4 AlCL3,
- 19. Скачать презентацию












 Effect of anodizing parameters on growth of selfordering TiO2
Effect of anodizing parameters on growth of selfordering TiO2 Мұнайды өңдеудің химиялық процестерінің теориялық негіздері
Мұнайды өңдеудің химиялық процестерінің теориялық негіздері Аминокислоты
Аминокислоты Открытие Периодического закона
Открытие Периодического закона Химические свойства алкенов. Получение
Химические свойства алкенов. Получение Видалення забруднень органічного походження з поверхні тканини
Видалення забруднень органічного походження з поверхні тканини Строение атома, изотопы
Строение атома, изотопы 20230306_vodorod_ego_fizicheskie_svoystva
20230306_vodorod_ego_fizicheskie_svoystva Токсическое действие диоксинов и диоксиноподоных соединений
Токсическое действие диоксинов и диоксиноподоных соединений Analytical methods in modern research. Chromatography
Analytical methods in modern research. Chromatography Аномальные свойства воды – основа жизни на Земле
Аномальные свойства воды – основа жизни на Земле Алюміній. Загальна характеристика, властивості. Алюміній оксид, алюміній гідроксид, їх амфотерність
Алюміній. Загальна характеристика, властивості. Алюміній оксид, алюміній гідроксид, їх амфотерність Металлогеническая периодизация истории Земли. Геолого-металлогенические ранги
Металлогеническая периодизация истории Земли. Геолого-металлогенические ранги Железо, его физические и химические свойства
Железо, его физические и химические свойства Неомыляемые липиды. Изопреноиды
Неомыляемые липиды. Изопреноиды Тепловой эффект химических реакций
Тепловой эффект химических реакций Спирти. Феноли. Етери
Спирти. Феноли. Етери Химия переходных элементов IV – V группы
Химия переходных элементов IV – V группы Инструментальные методы исследования органических веществ
Инструментальные методы исследования органических веществ Зародження періодичної системи елементів Менделєєва
Зародження періодичної системи елементів Менделєєва Свойства воды
Свойства воды Коллигативные свойства растворов
Коллигативные свойства растворов Валентность и степень окисления
Валентность и степень окисления Спирты, фенолы, тиолы
Спирты, фенолы, тиолы Каталитический риформинг бензинов
Каталитический риформинг бензинов Вплив хімічних сполук на довкілля
Вплив хімічних сполук на довкілля Понятия про синтетические лекарственные средства
Понятия про синтетические лекарственные средства Волшебница - вода
Волшебница - вода