Содержание
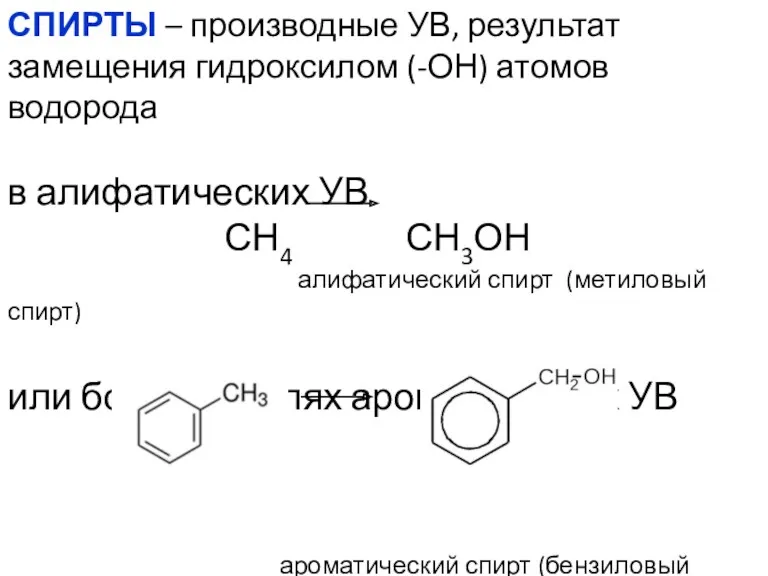
- 2. СПИРТЫ – производные УВ, результат замещения гидроксилом (-ОН) атомов водорода в алифатических УВ СН4 СН3ОН алифатический
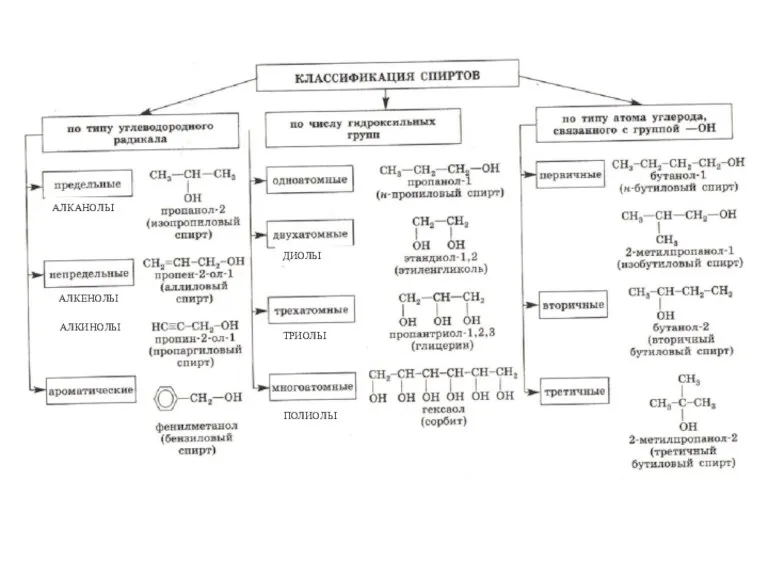
- 3. АЛКАНОЛЫ АЛКЕНОЛЫ АЛКИНОЛЫ ДИОЛЫ ТРИОЛЫ ПОЛИОЛЫ
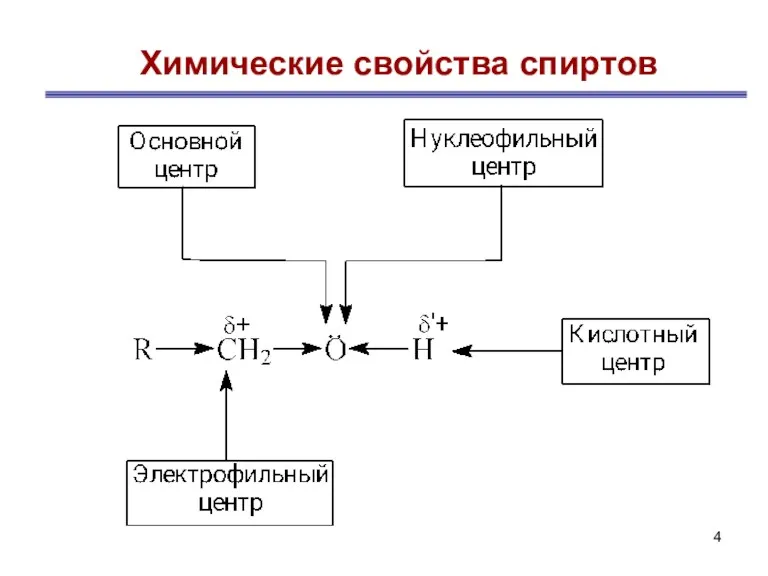
- 4. Химические свойства спиртов
- 5. Химические свойства одноатомных спиртов Химические свойства спиртов связаны с наличием в их молекуле группы –ОН. Для
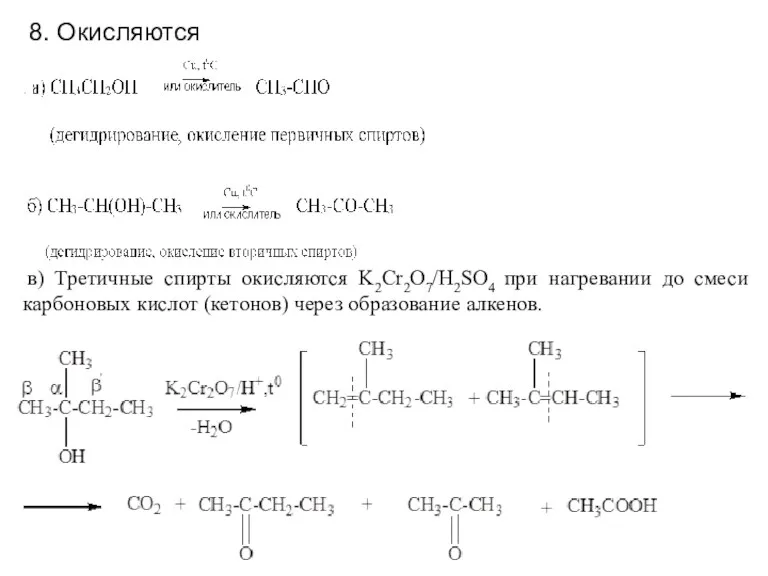
- 6. в) Третичные спирты окисляются K2Cr2O7/H2SO4 при нагревании до смеси карбоновых кислот (кетонов) через образование алкенов. 8.
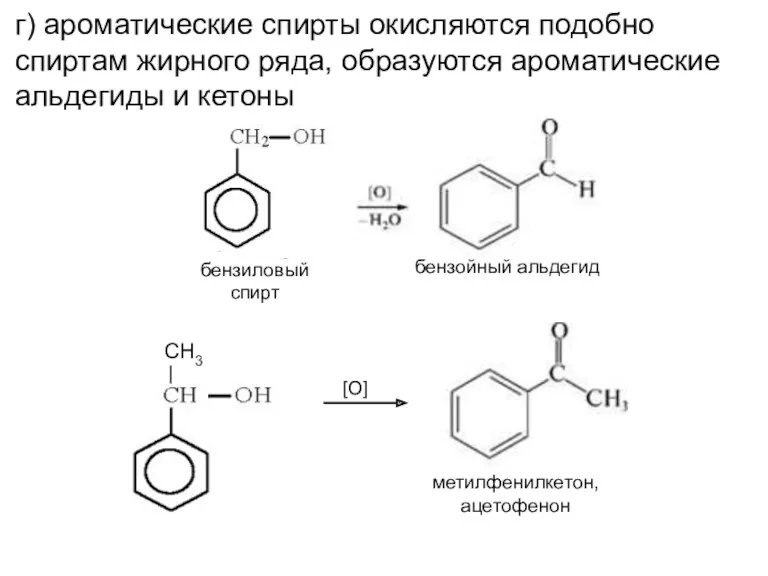
- 7. г) ароматические спирты окисляются подобно спиртам жирного ряда, образуются ароматические альдегиды и кетоны метилфенилкетон, ацетофенон [O]
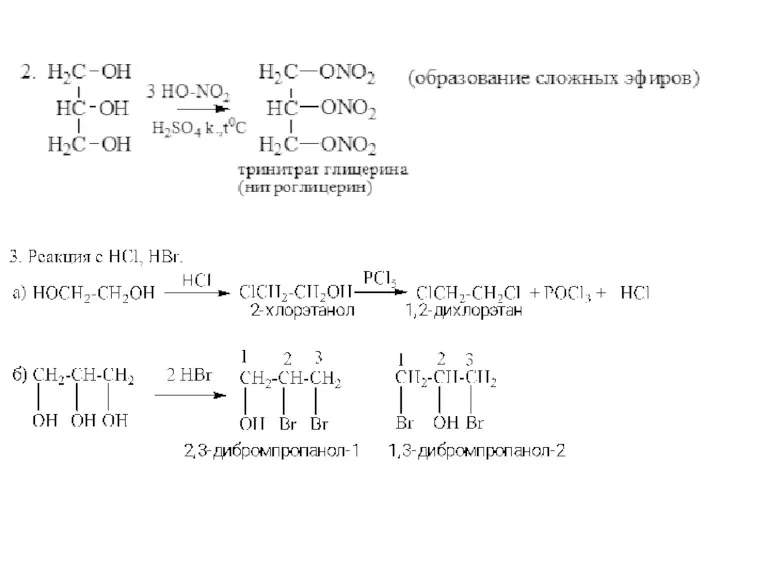
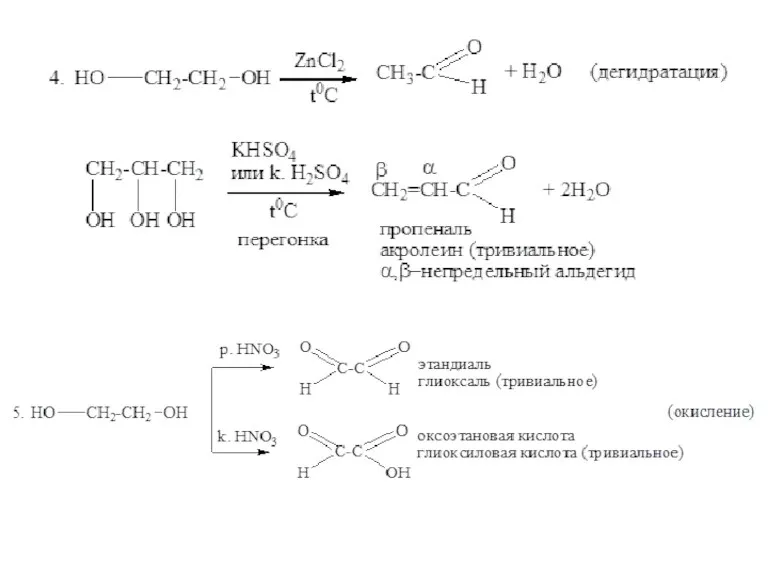
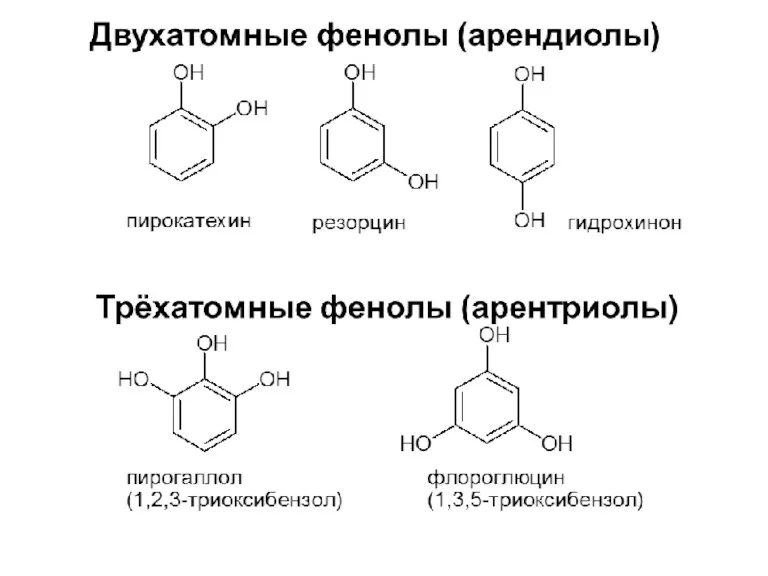
- 8. Химические свойства многоатомных спиртов 1. Многоатомные спирты более сильные кислоты, чем одноатомные спирты. Гликоли и глицерины
- 11. Отдельные представители Метанол (метиловый спирт). Принятие внутрь вызывает опьянение и тяжелое отравление, потерю зрения и часто
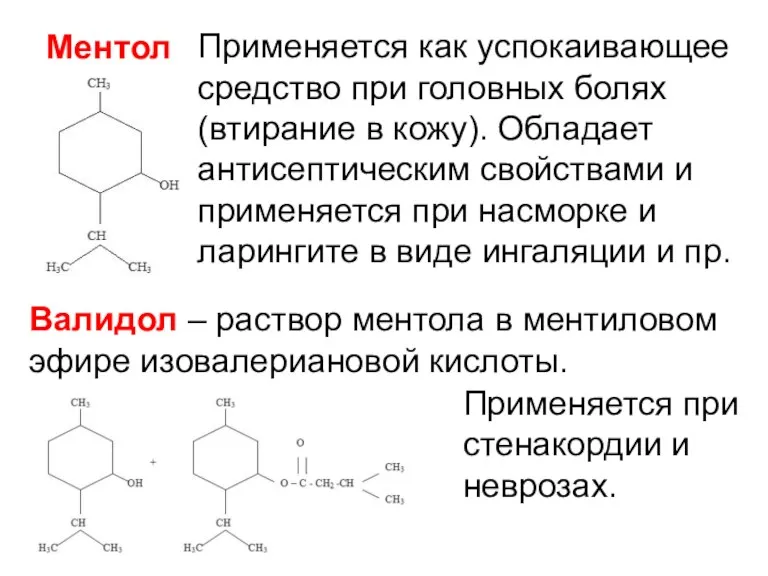
- 13. Ментол Применяется как успокаивающее средство при головных болях (втирание в кожу). Обладает антисептическим свойствами и применяется
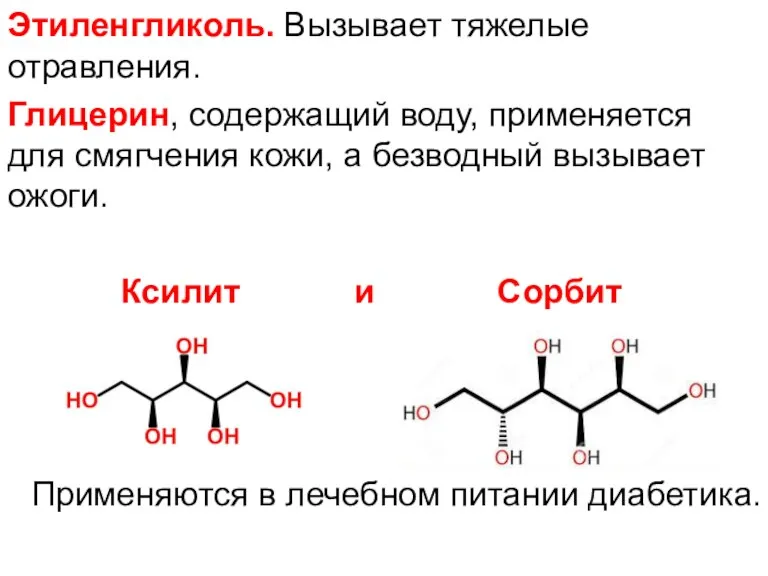
- 14. Этиленгликоль. Вызывает тяжелые отравления. Глицерин, содержащий воду, применяется для смягчения кожи, а безводный вызывает ожоги. Ксилит
- 15. ОКСИСОЕДИНЕНИЯ ФЕНОЛЫ
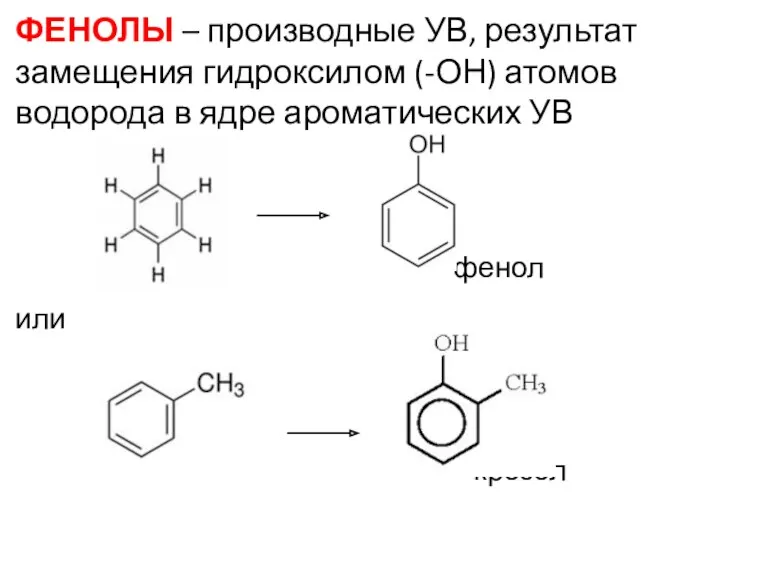
- 16. ФЕНОЛЫ – производные УВ, результат замещения гидроксилом (-ОН) атомов водорода в ядре ароматических УВ фенол или
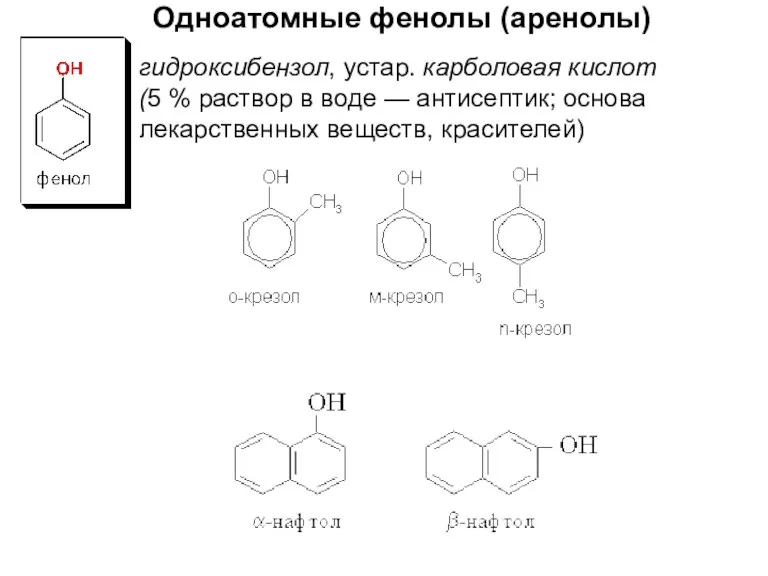
- 17. гидроксибензол, устар. карболовая кислот (5 % раствор в воде — антисептик; основа лекарственных веществ, красителей) Одноатомные
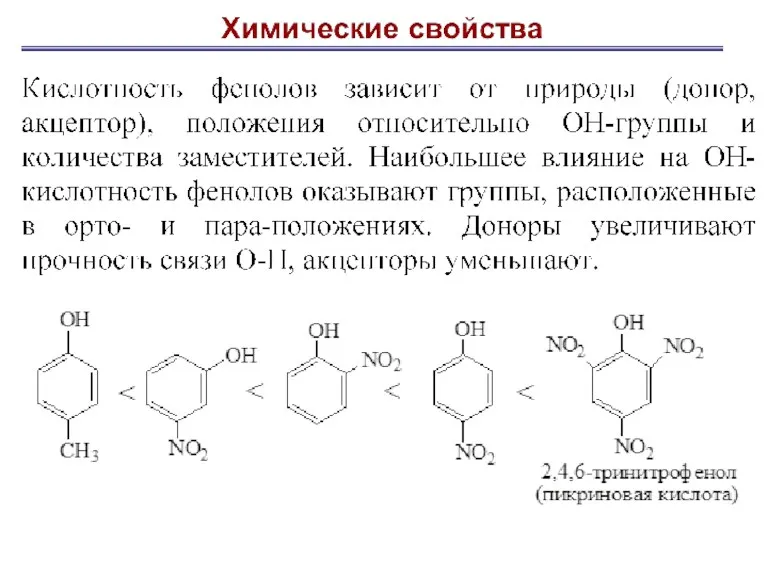
- 20. Гидроксильная группа – ориентант I рода, облегчает реакции по бензольному кольцу, направляя атаку электрофильного реагента в
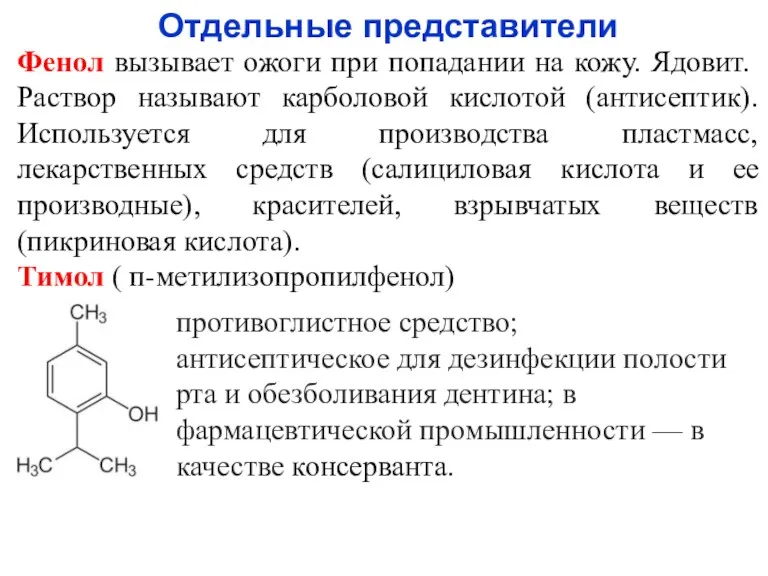
- 21. Отдельные представители Фенол вызывает ожоги при попадании на кожу. Ядовит. Раствор называют карболовой кислотой (антисептик). Используется
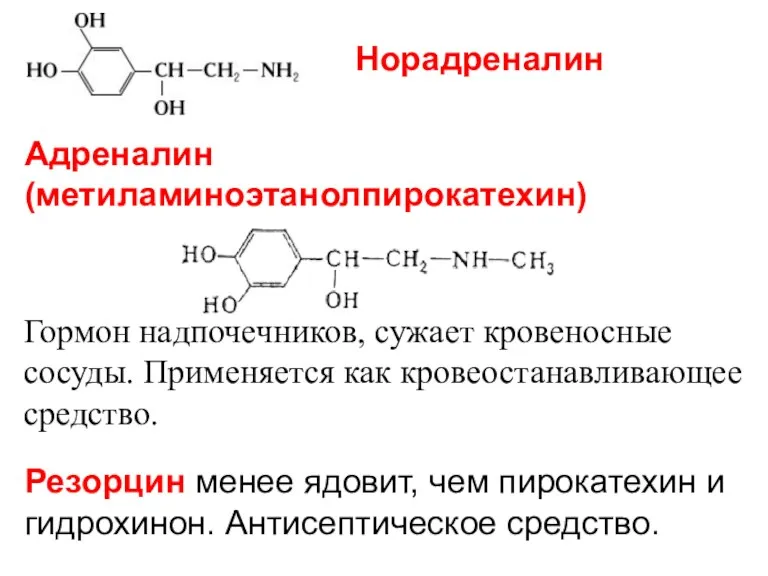
- 22. Адреналин (метиламиноэтанолпирокатехин) Гормон надпочечников, сужает кровеносные сосуды. Применяется как кровеостанавливающее средство. Резорцин менее ядовит, чем пирокатехин
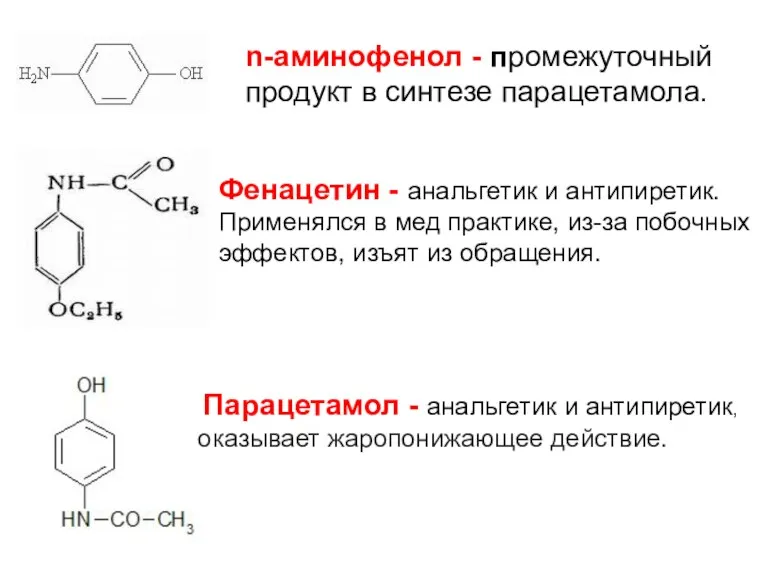
- 23. n-аминофенол - промежуточный продукт в синтезе парацетамола. Парацетамол - анальгетик и антипиретик, оказывает жаропонижающее действие. Фенацетин
- 24. ТИОЛЫ
- 25. ХИМИЧЕСКИЕ СВОЙСТВА Тиолы проявляют слабые кислотные свойства (на 5-6 порядков больше, чем у спиртов) С2Н5SH +
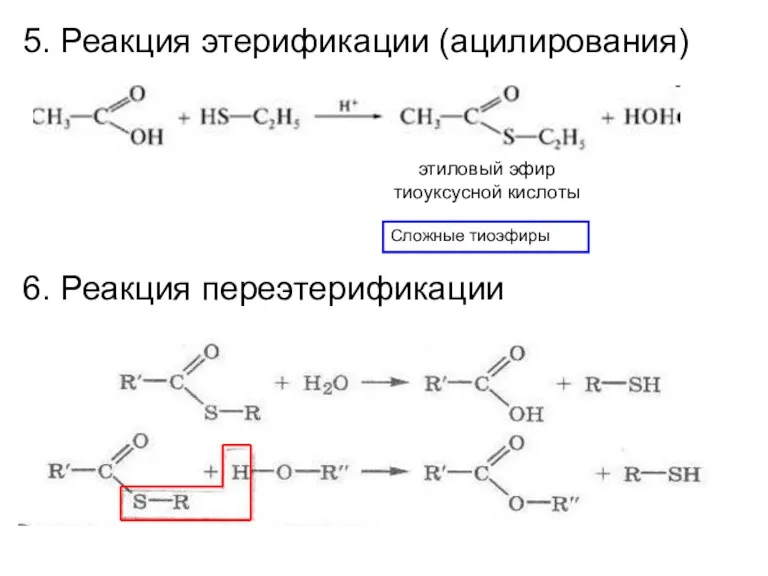
- 26. 5. Реакция этерификации (ацилирования) Сложные тиоэфиры этиловый эфир тиоуксусной кислоты 6. Реакция переэтерификации
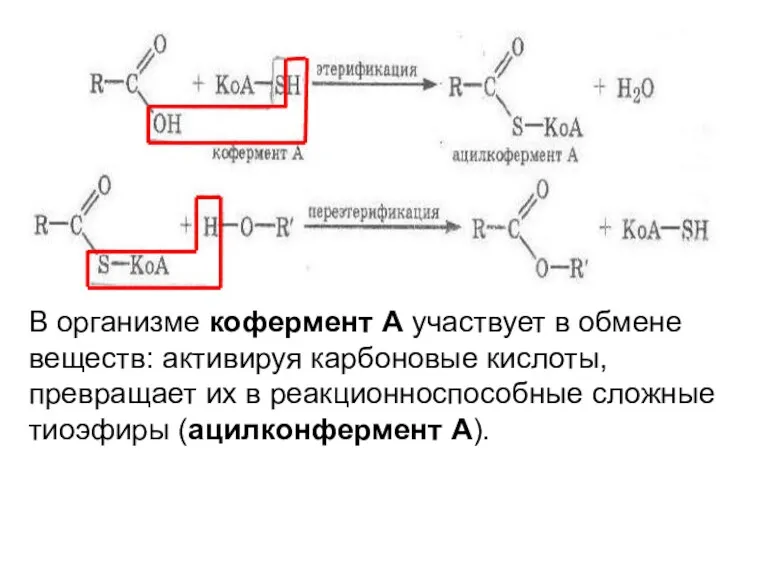
- 27. В организме кофермент А участвует в обмене веществ: активируя карбоновые кислоты, превращает их в реакционноспособные сложные
- 28. 7. Окислительно-восстановительные реакции. Тиолы сильные восстановители. 2RSH R – S – S –R + 2H+ окисление
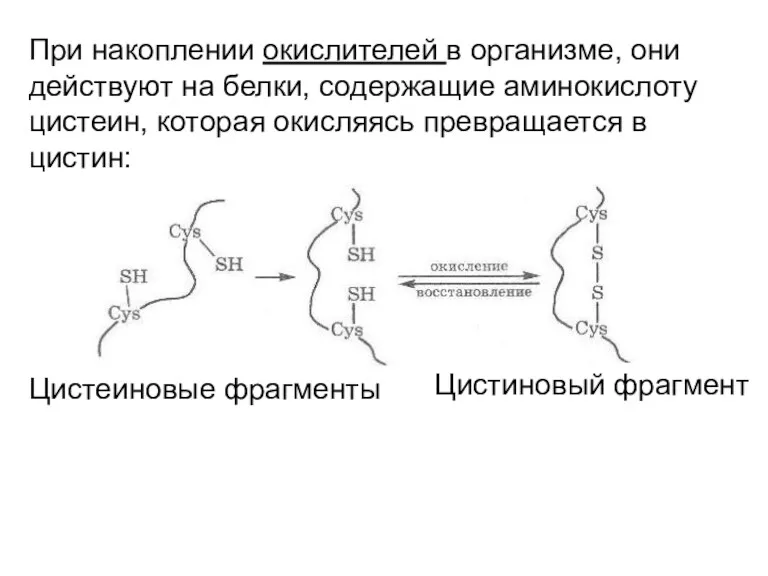
- 29. При накоплении окислителей в организме, они действуют на белки, содержащие аминокислоту цистеин, которая окисляясь превращается в
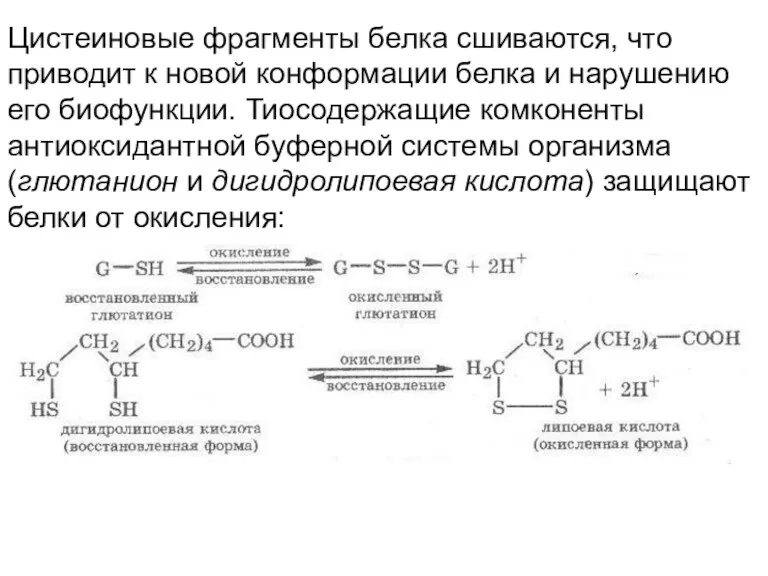
- 30. Цистеиновые фрагменты белка сшиваются, что приводит к новой конформации белка и нарушению его биофункции. Тиосодержащие комконенты
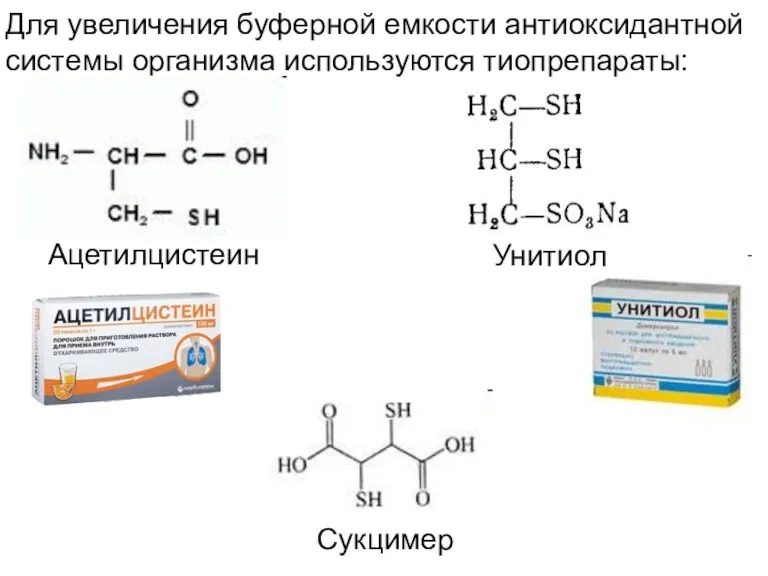
- 31. Для увеличения буферной емкости антиоксидантной системы организма используются тиопрепараты: Сукцимер Унитиол Ацетилцистеин
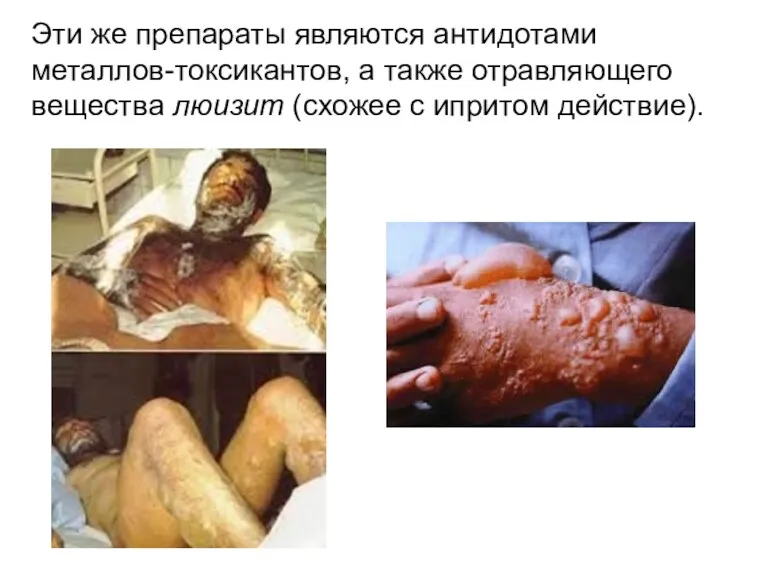
- 32. Эти же препараты являются антидотами металлов-токсикантов, а также отравляющего вещества люизит (схожее с ипритом действие).
- 33. Нарушение окислительно-восстановительного гомеостаза наблюдается при радиоактивном облучении. Для предотвращения тяжелых последствий используют радиопротекторы (вещества, смягчающие последствия
- 35. Скачать презентацию










 Эндогенная серия. Альбитит-грейзеновая группа
Эндогенная серия. Альбитит-грейзеновая группа Виды коррозии
Виды коррозии Оксиды. Классификация. Химические и физические свойства
Оксиды. Классификация. Химические и физические свойства Оксиды. Классификация оксидов
Оксиды. Классификация оксидов Нуклеин қышқылдары
Нуклеин қышқылдары Ртуть. Использование ртути
Ртуть. Использование ртути Художественная обработка камня
Художественная обработка камня Introduction to effective permeability and relative permeability
Introduction to effective permeability and relative permeability Кристаллическое состояние вещества
Кристаллическое состояние вещества Биохимия нуклеиновых кислот
Биохимия нуклеиновых кислот Химические чистящие средства
Химические чистящие средства Химические вещества как строительные и поделочные материалы
Химические вещества как строительные и поделочные материалы Вода - уникальнейшая структура жизни. Способы ее очистки
Вода - уникальнейшая структура жизни. Способы ее очистки Предмет органической химии. Органические вещества
Предмет органической химии. Органические вещества Карбон қышқылдар, түрлері қасиеттері, түындылары. Лекция № 8. Гетерофункционалды қосылыстар. Лекция № 9
Карбон қышқылдар, түрлері қасиеттері, түындылары. Лекция № 8. Гетерофункционалды қосылыстар. Лекция № 9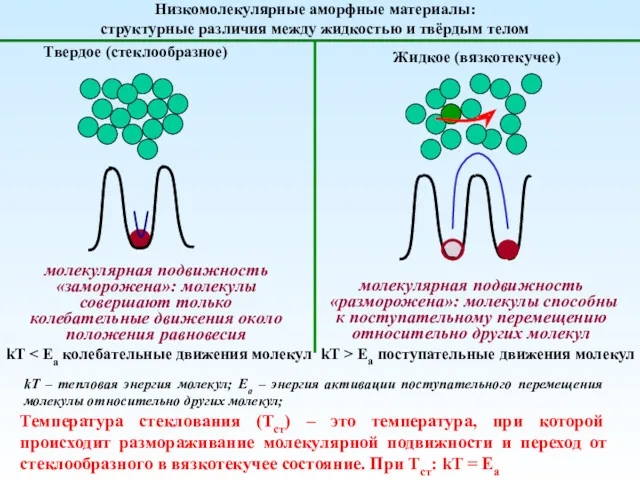 Механика полимеров
Механика полимеров Карбоновые кислоты. (10 класс)
Карбоновые кислоты. (10 класс) Химические реакции. Условия необходимые для протекания химических реакций?
Химические реакции. Условия необходимые для протекания химических реакций? Петрография
Петрография Смоги и их влияние на человека
Смоги и их влияние на человека Валентные возможности атомов. Степень окисления
Валентные возможности атомов. Степень окисления Окислительно-восстановительные реакции
Окислительно-восстановительные реакции Алюминий (лат. Aluminium)
Алюминий (лат. Aluminium) Качественные реакции на функциональные группы. Классификация функциональных групп
Качественные реакции на функциональные группы. Классификация функциональных групп Биологически важные реакции карбонильных соединений. Масс-спектрометрия
Биологически важные реакции карбонильных соединений. Масс-спектрометрия Металлы. Общая характеристика
Металлы. Общая характеристика Минералогия литофильных редких элементов. Бор
Минералогия литофильных редких элементов. Бор Теория электролитической диссоциации (ТЭД)
Теория электролитической диссоциации (ТЭД)