Содержание
- 2. 2. I-е положение ТЭД. Современное содержание ТЭД можно свести к четырем основным положениям. I-е положение: Все
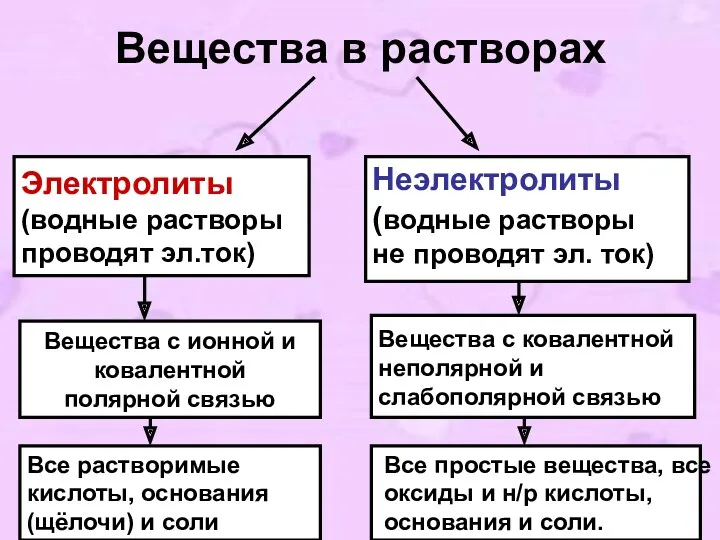
- 3. Вещества в растворах Электролиты (водные растворы проводят эл.ток) Неэлектролиты (водные растворы не проводят эл. ток) Вещества
- 4. 3. Задания к I-му положению ТЭД Какие вещества называются электролитами и неэлектролитами? Назовите по два вещества,
- 5. 4. II-е положение ТЭД В растворах электролиты диссоциируют ( распадаются ) на положительные и отрицательные ионы.
- 7. Механизм ЭД: Вещества с ионной связью: Ориентация диполей воды → гидратация → диссоциация. Вещества с ковалентной
- 8. Типы ионов По заряду: катионы (положительные) и анионы (отрицательные); По отношению к воде: Гидратированные и негидратированные
- 10. Скачать презентацию






 Цветные металлы и сплавы
Цветные металлы и сплавы Массовая доля вещества в растворе
Массовая доля вещества в растворе Характеристики атома. Электроотрицательность. Шкала Полинга. Изменения химических свойств элементов в ПСЭ. (Лекция 1.2)
Характеристики атома. Электроотрицательность. Шкала Полинга. Изменения химических свойств элементов в ПСЭ. (Лекция 1.2) Анилин. Строение. Физические и химические свойства
Анилин. Строение. Физические и химические свойства Технология промышленных газов
Технология промышленных газов Химия вокруг нас
Химия вокруг нас Непредельные, ненасыщенные, ацетиленовые алкины
Непредельные, ненасыщенные, ацетиленовые алкины Перегонка с водяным паром
Перегонка с водяным паром Липиды. Классификация липидов
Липиды. Классификация липидов Основания. Номенклатура оснований
Основания. Номенклатура оснований Химические свойства металлов
Химические свойства металлов Процесс в химическом реакторе
Процесс в химическом реакторе Скорость химических реакций. Факторы, влияющие на скорость химической реакции
Скорость химических реакций. Факторы, влияющие на скорость химической реакции Щелочные металлы. Периодическая система химических элементов Д.И. Менделеева
Щелочные металлы. Периодическая система химических элементов Д.И. Менделеева Пена и пенообразователи. Назначение, виды, состав и свойства
Пена и пенообразователи. Назначение, виды, состав и свойства Гидроксиды. Основания: способы получения
Гидроксиды. Основания: способы получения Спирты
Спирты Кондуктометрия и кондуктометрическое титрование
Кондуктометрия и кондуктометрическое титрование Тяжелые металлы
Тяжелые металлы Горение жидкостей
Горение жидкостей Определение фосфатов, железа, хлоридов
Определение фосфатов, железа, хлоридов Изменения, происходящие с белками в процессах технологической переработки сырья
Изменения, происходящие с белками в процессах технологической переработки сырья Металлическая связь
Металлическая связь Химический состав воздуха
Химический состав воздуха Сладкая жизнь. Проектно-исследовательская работа
Сладкая жизнь. Проектно-исследовательская работа Хімічні явища в побуті
Хімічні явища в побуті Кристаллы. Кристаллические вещества
Кристаллы. Кристаллические вещества Алканы. (Предельные углеводороды. Парафины. Насыщенные углеводороды.)
Алканы. (Предельные углеводороды. Парафины. Насыщенные углеводороды.)