Содержание
- 2. Цель урока: Углубить знания о важнейших классах веществ неорганической химии
- 3. Формулы только оксидов приведены в ряду: H2SO3, BeO, CuCl2 Na2CO3, Na2O, Cl2O7 CO2, Li2O, CrO3 KOH,
- 4. Не характеризует свойство основных оксидов: CaO + H2O → Ca(OH)2 SO3 + Na2O → Na2SO4 K2O
- 5. Назовите вещества: CO Na2O
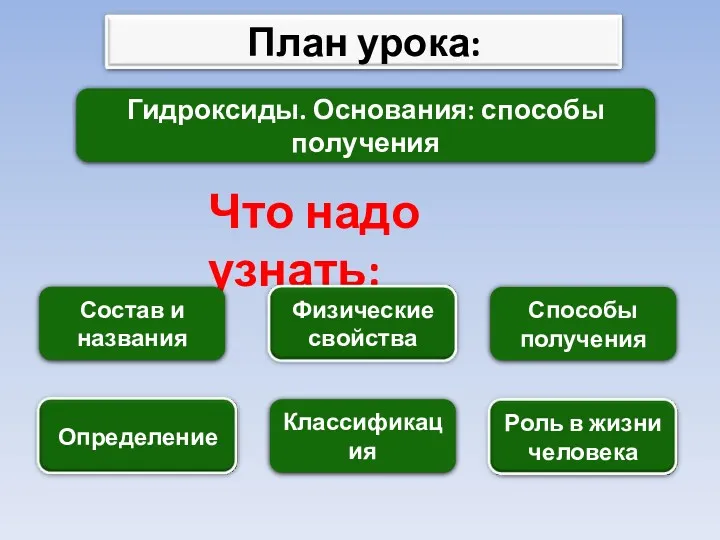
- 6. Гидроксиды. Основания: способы получения.
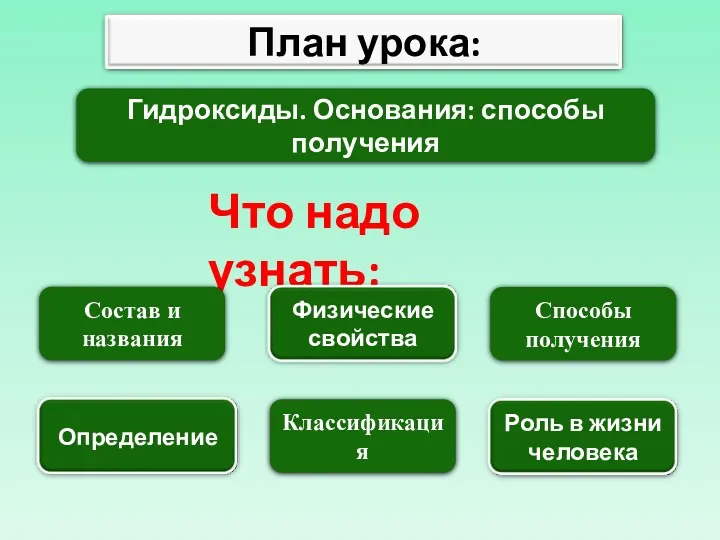
- 7. Гидроксиды. Основания: способы получения Что надо узнать: Состав и названия Классификация Способы получения
- 8. K2O + H2O → 2KOH
- 9. K2O + H2O → 2KOH Гидроксиды – это сложные вещества в состав которых входят атомы металлов
- 10. Гидроксиды. Основания: способы получения.
- 11. Основания - это гидроксиды металлов IА и IIА (кроме Be), а также металлов в минимальной степени
- 12. Работа с учебником: Стр 137 «Классификация гидроксидов» Стр 139 «Физические свойства оснований» ? На какие группы
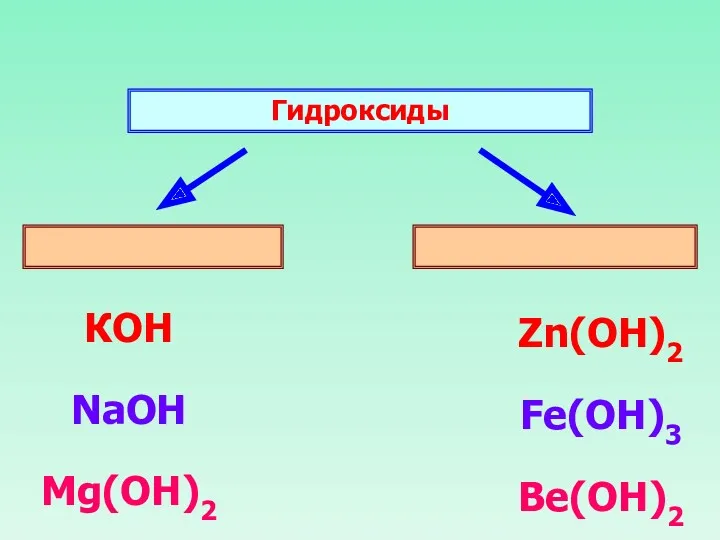
- 14. Гидроксиды КОН NaOH Mg(OH)2 Zn(ОН)2 Fe(OH)3 Be(OH)2
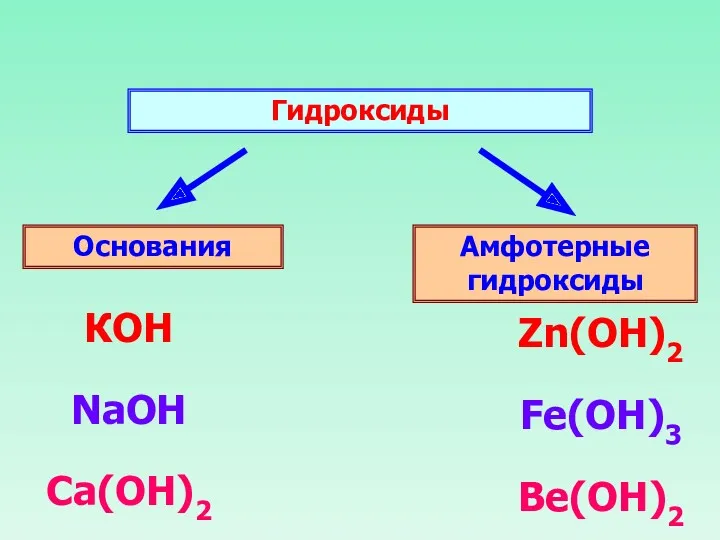
- 15. Гидроксиды Основания Амфотерные гидроксиды КОН NaOH Ca(OH)2 Zn(ОН)2 Fe(OH)3 Be(OH)2
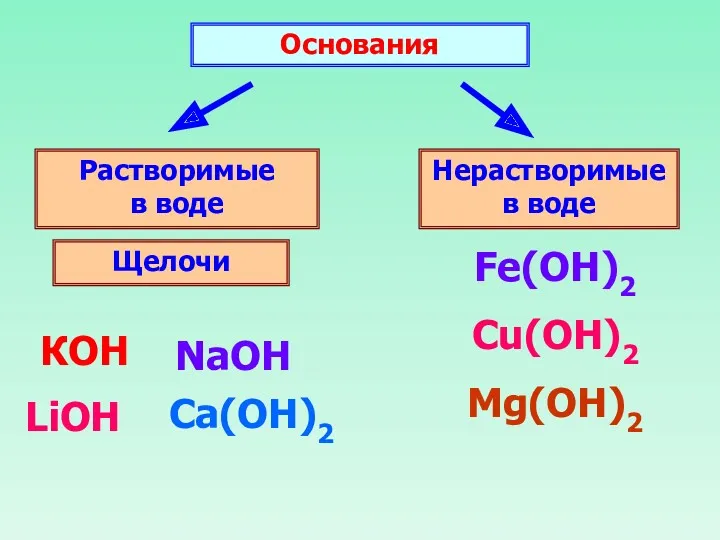
- 16. Основания Растворимые в воде Нерастворимые в воде Щелочи КОН NaOH Ca(ОН)2 LiOH Fe(OH)2 Cu(OH)2 Mg(ОН)2
- 17. NaOH – гидроксид натрия, едкий натр, каустическая сода
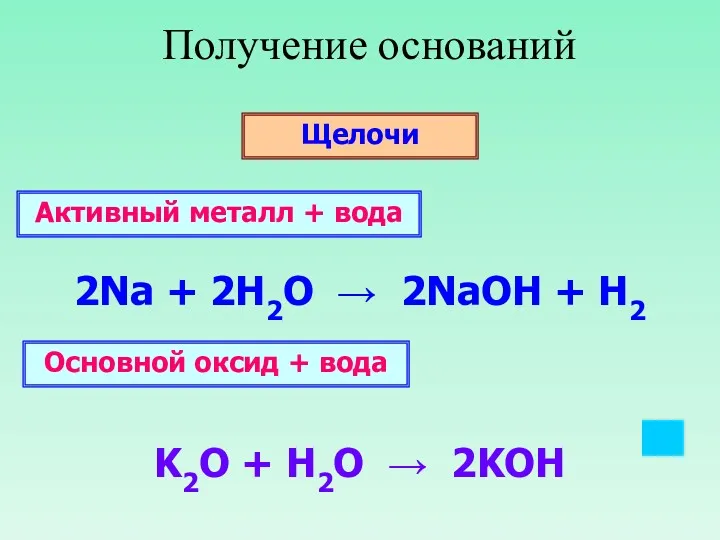
- 18. Получение оснований Щелочи 2Na + 2H2O → 2NaOH + H2 K2O + H2O → 2KOH Активный
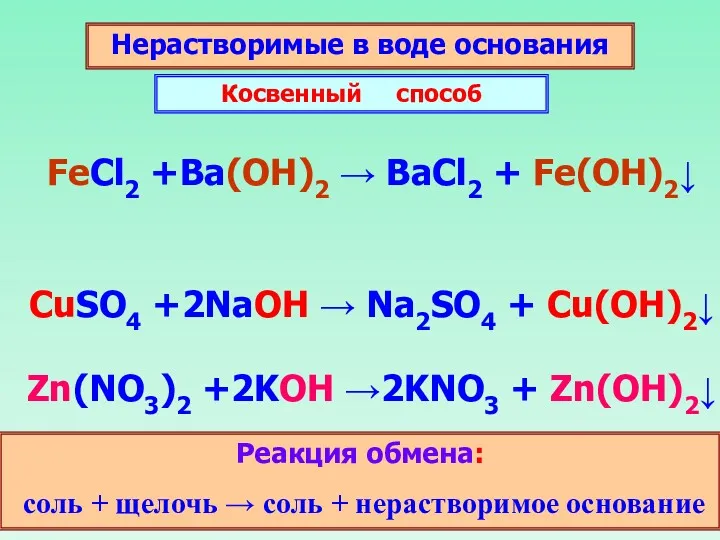
- 19. Нерастворимые в воде основания Косвенный способ CuSO4 +2NaOH → Na2SO4 + Cu(OH)2↓ Zn(NO3)2 +2KOH →2KNO3 +
- 20. Гидроксиды. Основания: способы получения Что надо узнать: Состав и названия Классификация Способы получения
- 21. Домашнее задание: §41 По задачнику
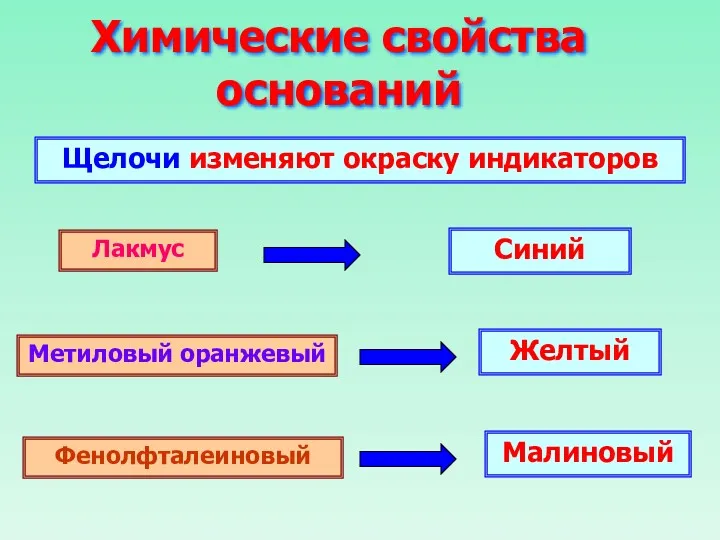
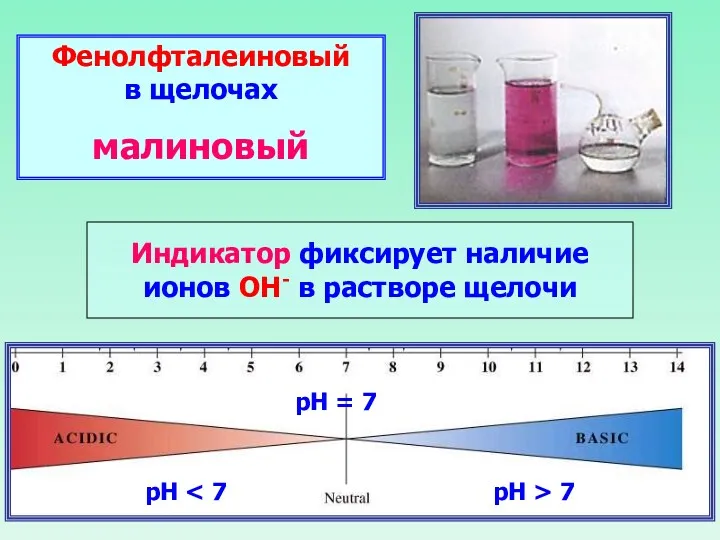
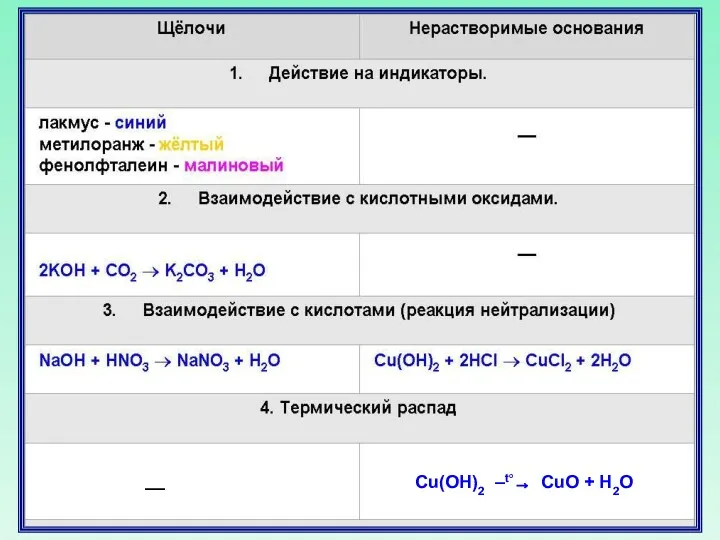
- 23. Химические свойства оснований Щелочи изменяют окраску индикаторов Лакмус Метиловый оранжевый Фенолфталеиновый Синий Желтый Малиновый
- 24. Фенолфталеиновый в щелочах малиновый Индикатор фиксирует наличие ионов ОН- в растворе щелочи рН рН = 7
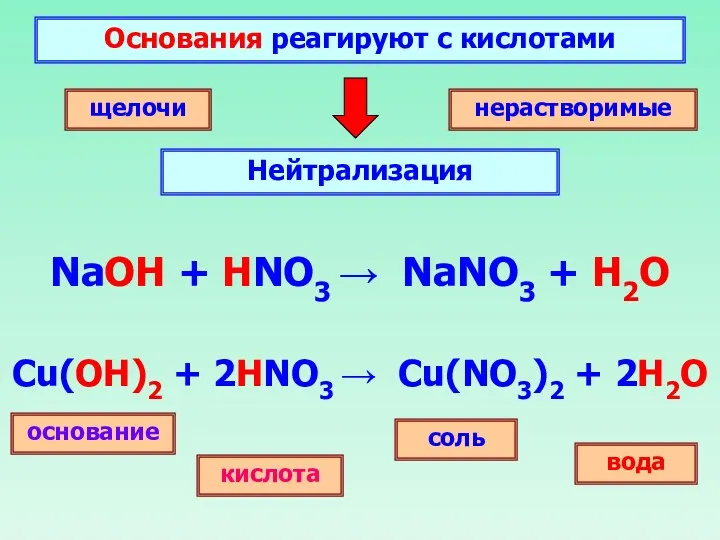
- 25. Основания реагируют с кислотами Нейтрализация щелочи нерастворимые основание соль кислота вода
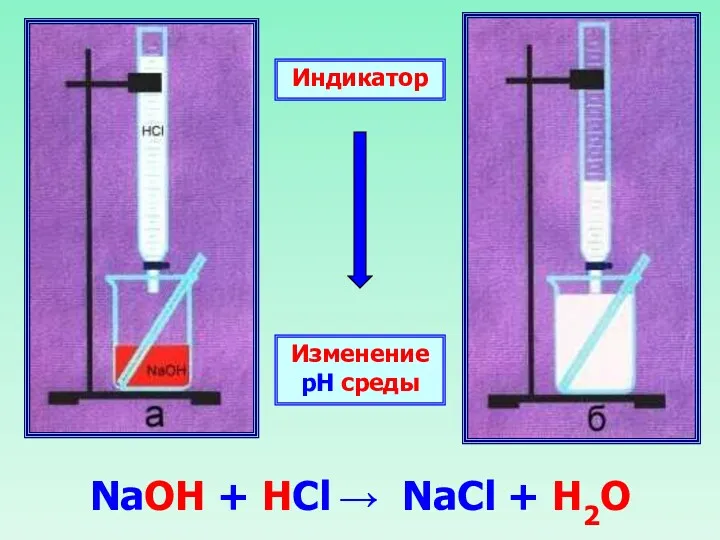
- 27. Индикатор Изменение рН среды
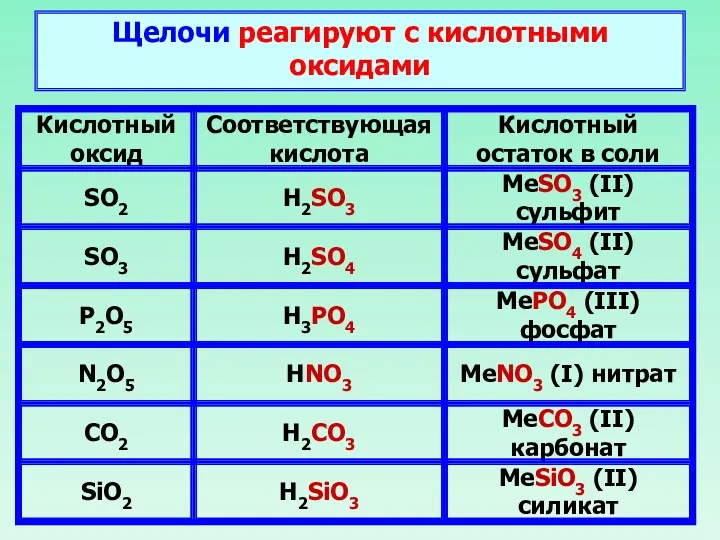
- 28. Щелочи реагируют с кислотными оксидами
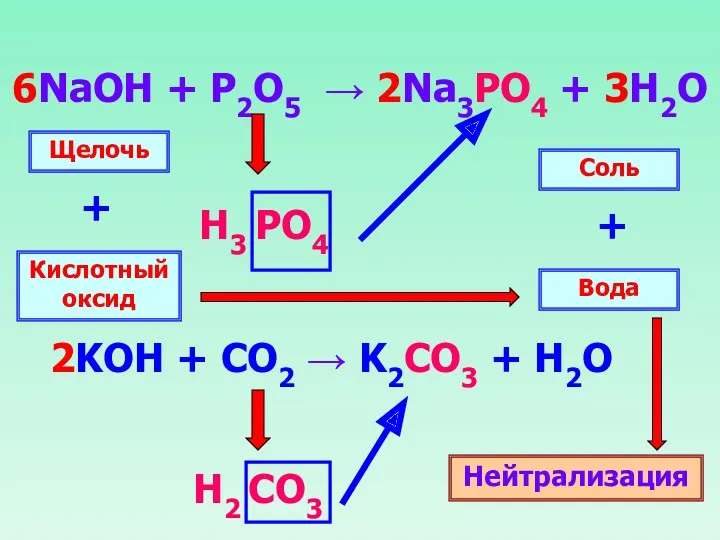
- 29. 6NaOH + P2O5 → 2Na3PO4 + 3H2O Н3 PO4 Н2 CO3 Щелочь Кислотный оксид + Вода
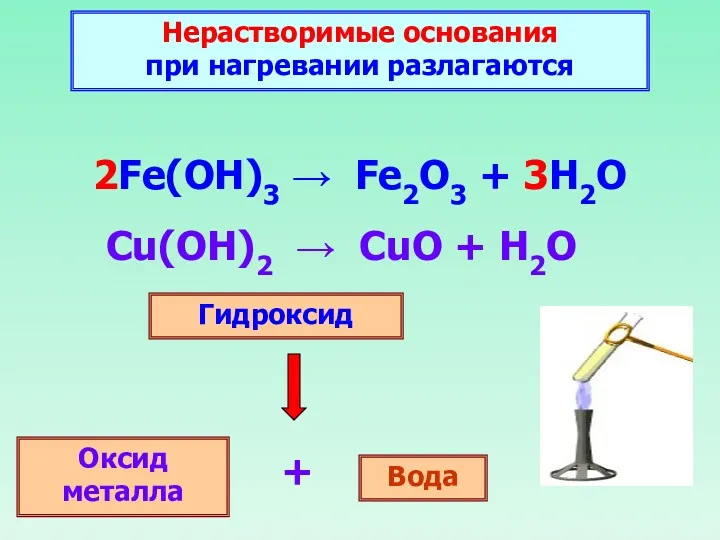
- 30. Нерастворимые основания при нагревании разлагаются 2Fe(OH)3 → Fe2O3 + 3H2O Гидроксид Оксид металла Вода +
- 31. Cu(OH)2 –t°→ CuO + H2O ––
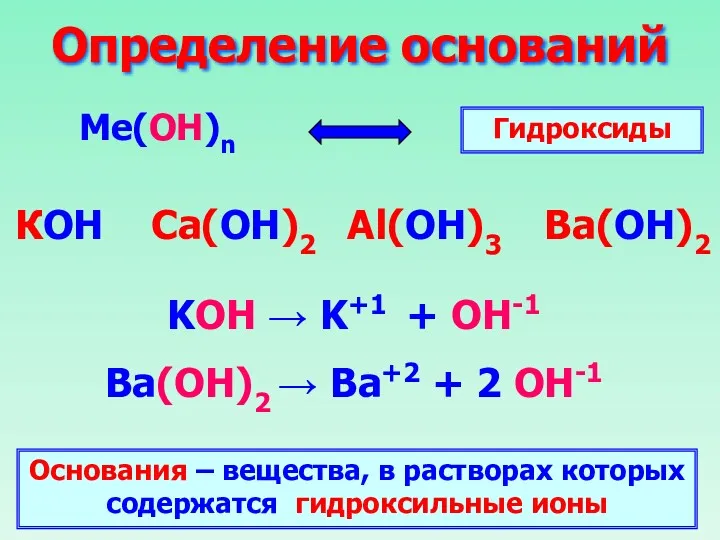
- 33. Определение оснований Ме(ОН)n КОН Ca(ОН)2 Al(ОН)3 Ba(ОН)2 Гидроксиды KOH → K+1 + OH-1 Ba(ОН)2 → Ba+2
- 35. Скачать презентацию
















 Биогенді (s.p.d) элементтермен олардың қосылыстарының медициналық және биологиялық маңызы
Биогенді (s.p.d) элементтермен олардың қосылыстарының медициналық және биологиялық маңызы Кислоты, их состав и названия
Кислоты, их состав и названия Карбоновые кислоты и их функциональные производные
Карбоновые кислоты и их функциональные производные Ароматические углеводороды
Ароматические углеводороды Гетерофазный катализ. (Лекция 20)
Гетерофазный катализ. (Лекция 20) Горение топлива
Горение топлива Використання радіоактивних ізотопів, як індикаторів у тваринництві і археології
Використання радіоактивних ізотопів, як індикаторів у тваринництві і археології Основные классы неорганических соединений
Основные классы неорганических соединений Соли, их классификация и свойства
Соли, их классификация и свойства Органічна хімія
Органічна хімія Розв’язування задач за рівняннями реакцій з використанням розчинів із певною масовою часткою розчиненої речовини. Урок 13-14
Розв’язування задач за рівняннями реакцій з використанням розчинів із певною масовою часткою розчиненої речовини. Урок 13-14 Жёсткость воды
Жёсткость воды Полисахариды: крахмал и целлюлоза
Полисахариды: крахмал и целлюлоза Растворы. Часть 2. Лекция №7
Растворы. Часть 2. Лекция №7 Химия атмосферы. Химические процессы в тропосфере
Химия атмосферы. Химические процессы в тропосфере Буферные системы
Буферные системы Белки. Строение
Белки. Строение Классификация химических элементов. Составитель. 8 класс
Классификация химических элементов. Составитель. 8 класс Минералы для ИЗБ
Минералы для ИЗБ Концентрация растворов. Массовая доля растворенного вещества. Урок 1
Концентрация растворов. Массовая доля растворенного вещества. Урок 1 Химический элемент медь
Химический элемент медь Кинетика химических реакций
Кинетика химических реакций Кремний и его соединения
Кремний и его соединения Галогены. Расположите галогены в порядке их открытия
Галогены. Расположите галогены в порядке их открытия Важнейшие реакции в органической химии
Важнейшие реакции в органической химии Технология производства аминоальдегидных смол
Технология производства аминоальдегидных смол Углерод. Физические и химические свойства
Углерод. Физические и химические свойства Гидролиз солей
Гидролиз солей