Содержание
- 2. А. Арфведсон 1792–1841 гг. Литий был открыт в 1817 г. шведским химиком А. Арфведсоном. Металл назвали
- 3. Г. Деви 1778–1829 гг. Впервые литий был получен английским химиком Г. Дэви в 1818 г.
- 4. Литий Dnn87
- 5. Использование лития
- 6. Использование лития
- 7. Г. Деви 1778–1829 гг. В 1807 г. английский химик и физик Г. Дэви впервые получил натрий
- 8. Натрий Dnn87
- 10. Натрий содержится в организме человека: в эритроцитах крови, сыворотке, пищеварительных соках, играет важную роль в водно-солевом
- 13. Металлическим натрием восстанавливают из соединений такие ценные металлы, как цирконий, тантал. Цирконий Alchemist-hp Тантал
- 14. Калий Dnn87
- 15. В природе калий встречается только в соединениях с другими элементами, например, в морской воде, во многих
- 17. Калий используют обычно в форме солей. Калийные удобрения — это природные или изменённые в процессе химической
- 18. Калий
- 19. Рубидий
- 20. Рубидий
- 21. Цезий Magnus Manske
- 22. Франций Маргарита Пере 1909–1975 гг. Франций был открыт в 1939 г. Маргаритой Пере. Она же дала
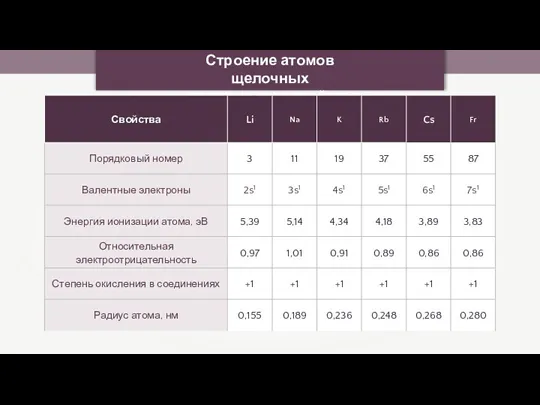
- 23. Строение атомов щелочных металлов и их свойства
- 24. Металлические свойства Металлический блеск Пластичность Мягкость Хорошая электропроводность Хорошая теплопроводность
- 25. Химические свойства металлов Щелочные металлы активно взаимодействуют почти со всеми неметаллами. 2M + H2 = 2MH
- 26. Химические свойства металлов При взаимодействии щелочных металлов с галогенами образуются соли (галогениды металлов). 2M + Cl2
- 27. Химические свойства металлов При взаимодействии щелочных металлов с серой образуются сульфиды металлов. 2M + S =
- 28. Реакция взаимодействия щелочных металлов с кислородом 4Li + O2 = 2Li2O 0 0 +1 –2 t
- 29. Взаимодействия натрия с водой, путём вытеснения воздуха
- 30. При взаимодействии с водой щелочные металлы образуют щёлочи, восстанавливая воду до водорода, и водород. 2Na +
- 31. Соединения щелочных металлов Галит Сильвинит
- 32. Оксиды щелочных металлов Оксиды щелочных металлов являются типичными основными оксидами, они обладают всеми свойствами основных оксидов.
- 33. Гидроксиды щелочных металлов Гидроксиды щелочных металлов являются сильными основаниями. Они участвуют во всех реакциях, характерных для
- 34. Соли щелочных металлов Гидроксид натрия
- 35. Соли щелочных металлов Хлорид натрия
- 36. Соли щелочных металлов
- 37. Соли щелочных металлов
- 39. Скачать презентацию


































 ЭЛЕКТРОЛИЗ
ЭЛЕКТРОЛИЗ Исследование снежного покрова
Исследование снежного покрова Коллоидно-дисперсные системы
Коллоидно-дисперсные системы Карбоновые кислоты и их функциональные производные
Карбоновые кислоты и их функциональные производные Оксид серы (IV). Сернистая кислота и её соли
Оксид серы (IV). Сернистая кислота и её соли Двойной электрический слой, его строение. Электродный потенциал
Двойной электрический слой, его строение. Электродный потенциал Понятия о металлических сплавах. Лекция 4
Понятия о металлических сплавах. Лекция 4 Основания. 8 класс
Основания. 8 класс Спирты
Спирты Производство извести в домашних условиях. 7 класс
Производство извести в домашних условиях. 7 класс Вывод формул веществ по массовым долям элементов. 10 класс
Вывод формул веществ по массовым долям элементов. 10 класс Табиғи нанокристалдар
Табиғи нанокристалдар Реакции ионного обмена
Реакции ионного обмена Оценка опасности взрыва горючих газов
Оценка опасности взрыва горючих газов Взаимодействие атомов элементов-металлов и элементов-неметаллов между собой. Ионная связь. (Тема 10)
Взаимодействие атомов элементов-металлов и элементов-неметаллов между собой. Ионная связь. (Тема 10) Неметаллы. Общая характеристика
Неметаллы. Общая характеристика XXI ғасыр көшбасшысы
XXI ғасыр көшбасшысы Решение заданий по теме: Оксиды
Решение заданий по теме: Оксиды Күрделі белоктар
Күрделі белоктар Химическое равновесие. Классификация реакций по признаку обратимости
Химическое равновесие. Классификация реакций по признаку обратимости Бета-лактамиды (природные и полусинтетические пенициллины и цефалоспорины)
Бета-лактамиды (природные и полусинтетические пенициллины и цефалоспорины) 20231028_kislorod
20231028_kislorod Валентность химических элементов
Валентность химических элементов Карбоновые кислоты
Карбоновые кислоты Простые вещества – неметаллы
Простые вещества – неметаллы Подготовка к ВПР по химии. 8 класс
Подготовка к ВПР по химии. 8 класс Основные понятия и законы химии
Основные понятия и законы химии Гидроксикислоты (оксикислоты)
Гидроксикислоты (оксикислоты)