Содержание
- 2. Неметаллы – это химические элементы, которые образуют в свободном виде простые вещества, не обладающие физическими свойствами
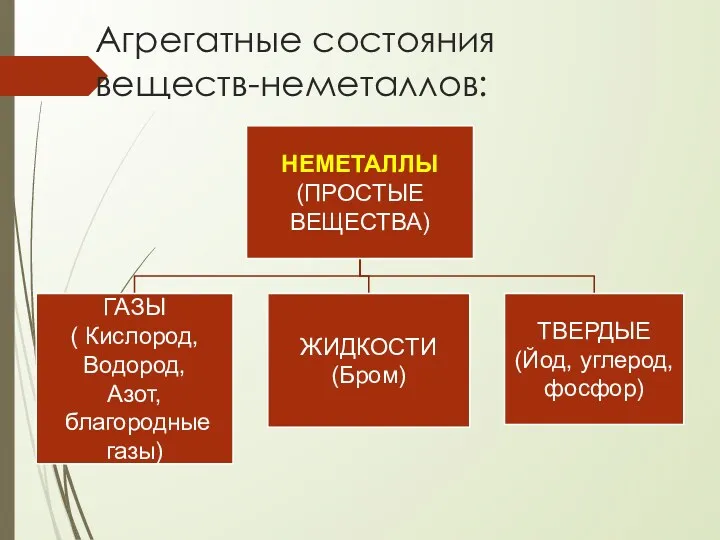
- 3. Агрегатные состояния веществ-неметаллов:
- 4. В электрическом разряде инертные газы дают характерное свечение: гелий - желтое, неон – оранжевое, аргон -
- 5. Так же к газам относятся: H2 – водород O2 – кислород N2 – азот Cl2 –
- 6. Единственный жидкий неметалл: Бром (Br2) – химически активный неметалл, тяжёлая едкая жидкость красно-бурого цвета с сильным
- 7. Аллотропия - Способность атомов одного химического элемента образовывать несколько простых веществ. Кислород (О2) газ, без цвета
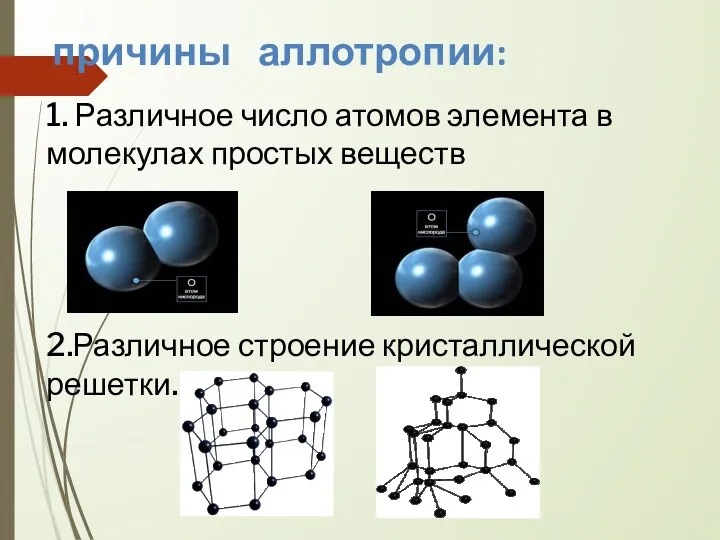
- 8. 1. Различное число атомов элемента в молекулах простых веществ 2.Различное строение кристаллической решетки. причины аллотропии:
- 9. Неметаллы – твердые вещества. Кристаллический йод и графит не похожи на другие неметаллы они имеют металлический
- 10. Аллотропные модификации Алмаз и графит – два непохожих вещества, но оба состоят из углерода. Алмаз –
- 11. графит В графите атомы углерода образуют плоскую двухмерную сетку. В этой сетке атомы располагаются так, что
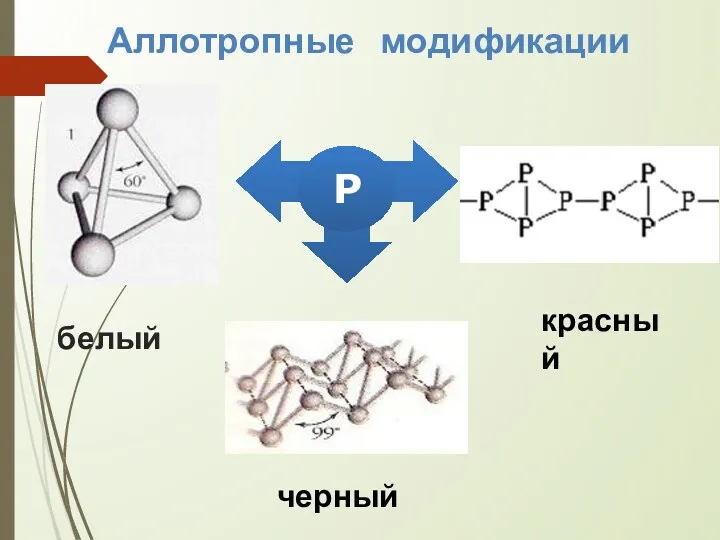
- 12. белый Р Аллотропные модификации красный черный
- 13. Белый фосфор В чистом виде это бесцветное , стекловидное вещество. Белый фосфор обладает специфическим чесночным запахом,
- 14. Темно-малиновый порошок. Нерастворим в воде. Химическая активность значительно ниже, чем у белого. На воздухе окисляется медленно,
- 15. Черный фосфор Чёрное вещество с металлическим блеском, жирное на ощупь и весьма похожее на графит. Не
- 16. Простые вещества:
- 18. Скачать презентацию










 Химические реакции
Химические реакции Геохимия окружающей среды и здоровье человека
Геохимия окружающей среды и здоровье человека Химическая связь
Химическая связь Простые вещества. Металлы и неметаллы
Простые вещества. Металлы и неметаллы Полимерные материалы, пластмассы и изделия из них
Полимерные материалы, пластмассы и изделия из них Electrochemistry
Electrochemistry Периодический закон и периодическая система химических элементов Д.И. Менделеева
Периодический закон и периодическая система химических элементов Д.И. Менделеева Поверхностные явления на границе раздела фаз. Хроматография, применение в медицинской практике
Поверхностные явления на границе раздела фаз. Хроматография, применение в медицинской практике Общая геохимия. Изотопы и их использование при решении геологических проблем
Общая геохимия. Изотопы и их использование при решении геологических проблем Оттекті органикалық қосылыстар тақырыбын пәнаралық байланыс арқылы оқыту әдістемесі
Оттекті органикалық қосылыстар тақырыбын пәнаралық байланыс арқылы оқыту әдістемесі Чем опасны нитраты
Чем опасны нитраты Морфологія наноструктур. Особливості синтезу OD, 1D та 2D наносистем. Методи фракціонування наносистем
Морфологія наноструктур. Особливості синтезу OD, 1D та 2D наносистем. Методи фракціонування наносистем Азот. Аммиак (9 класс)
Азот. Аммиак (9 класс) Свойства кислот и оснований в свете теории электролитической диссоциации
Свойства кислот и оснований в свете теории электролитической диссоциации Исследование снежного покрова
Исследование снежного покрова Basis Sets and Pseudopotentials
Basis Sets and Pseudopotentials Строение атома
Строение атома Хімія в побуті
Хімія в побуті Химия в пище. Пищевые добавки
Химия в пище. Пищевые добавки Щелочные металлы
Щелочные металлы Типы химических реакций
Типы химических реакций Химический элемент гелий
Химический элемент гелий Азот. Фосфор
Азот. Фосфор Масса и формулы. Химия 8 класс
Масса и формулы. Химия 8 класс Окислительно-восстановительные реакции
Окислительно-восстановительные реакции Лекция 8. Электрохимия
Лекция 8. Электрохимия Основные классы неорганических веществ
Основные классы неорганических веществ Физические и химические свойства воды
Физические и химические свойства воды