Содержание
- 2. Электрохимия – это раздел химической науки, изучающий электрохимические процессы.
- 3. Электрохимическими называются процессы: а) протекающие в растворе под воздействием электрического тока (электролиз); б) протекающие в растворе
- 4. Большинство электрохимических процессов являются окислительно-восстановительными.
- 5. План 8.1 Термодинамика ОВР 8.2 Устройство и принцип действия гальванических элементов 8.3 Потенциометрические методы анализа
- 6. 8.1 ОВР – это реакции, протекающие с изменением степени окисления атомов, входящих в состав реагирующих веществ.
- 7. Степень окисления – это условный заряд атома в молекуле, вычисленный исходя из допущения, что вещество состоит
- 8. Степень окисления принимает любые значения: целые, дробные, положительные, отрицательные: К2+1О‾2 Na2+1О2-1 КО3 -1/3 F2‾1O+2
- 9. Типы ОВР Межмолекулярные ОВР – окислитель и восстано-витель, разные вещества: К2Cr2O7 + 6KI + 4H2SO4 →
- 10. 2.Внутримолекулярные ОВР – атом-окислитель и атом-восстановитель входят в состав одного вещества t 2Cu(NO3)2 →2CuO + 4NO2
- 11. 3. Реакции диспропорционирования – атом одного химического элемента является и окислителем, и восстановителем 3Cl2 + 6KOH
- 12. Схема межмолекулярной ОВР : Ок1 + Вос2 → Ок2 + Вос1 Ок1 / Вос1 Ок2 /
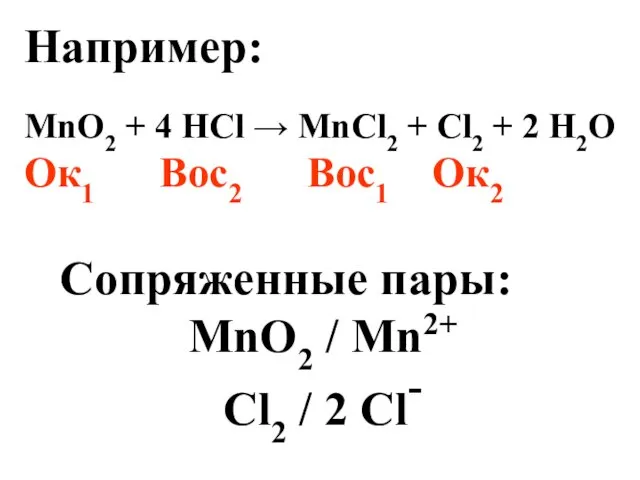
- 13. Например: MnO2 + 4 HCl → MnCl2 + Cl2 + 2 H2O Ок1 Вос2 Вос1 Ок2
- 14. Если ОВР протекает в водном растворе, то характеристикой каждой сопряженной пары служит окислительно-восстановительный потенциал (ОВП), φок/вос,В
- 15. В справочниках приводятся стандартные ОВП (φ0ок/вос). Стандартные ОВП изменяются в диапазоне от – 3 до +
- 16. Чем меньше ОВП, тем сильнее восстановитель и слабее сопряженный с ним окислитель. Li – самый сильный
- 17. Чем больше ОВП, тем сильнее окислитель и слабее сопряженный с ним восстановитель. F2 – самый сильный
- 18. Зная ОВП, можно сравнивать силу окислителей и восстано-вителей: φ0 (MnO4‾ / Mn2+) = 1,51 В φ0
- 19. Сила окислителей и восстановителей зависит от: их природы, концентрации, температуры, иногда от рН.
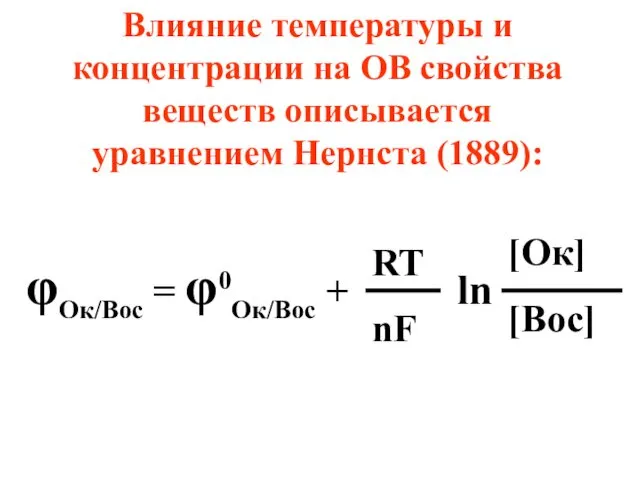
- 20. Влияние температуры и концентрации на ОВ свойства веществ описывается уравнением Нернста (1889): φОк/Вос = φ0Oк/Вос +
- 21. где n – число отданных или принятых электронов, F – число Фарадея, равное 96500 Кл/моль
- 22. Немецкий физик и химик, профессор Берлинского универ-ситета, лауреат Нобе-левской премии 1920 г. Основные работы посвящены теории
- 23. При Т = 298 К
- 24. Соответственно: φОк/Вос = φ0Oк/Вос + 0,0592 n lg [Ок] [Вос]
- 25. Пример: MnO4‾ + 8H+ + 5 ē → Mn2+ + 4H2O Окисленная форма Восстановленная форма φ=
- 26. Характеристикой ОВР является ее электродвижущая сила (ЭДС или Е), В Е=φОк1/Вос1–φОк2/Вос2
- 27. Например: KMnO4 + H2O2 + H2SO4 → Ок1 Вос2 MnSO4 + O2 + K2SO4 +H2O Вос1
- 28. Рассчитав электродвижущую силу ОВ реакции, можно определить ее характер (само- или несамопроизвольный). Для этого необходимо установить
- 29. Аэл = nFE Aэл = – ΔrG ΔrG = – nFE
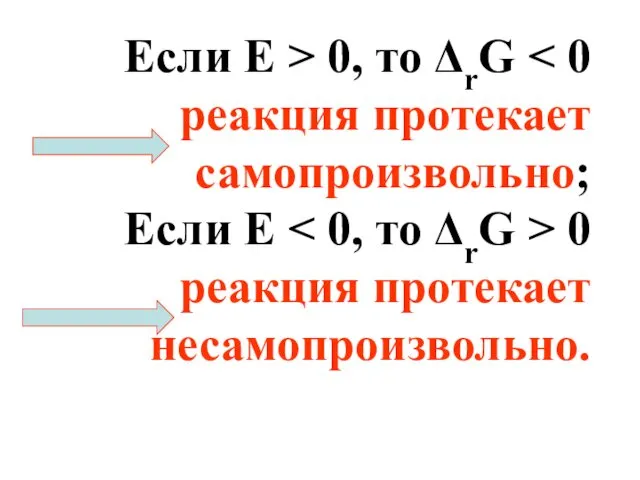
- 30. Если Е > 0, то ΔrG Если E 0 реакция протекает несамопроизвольно.
- 31. Большинство ОВР имеют обратимый характер, поэтому их важной характеристикой является константа равновесия (К): ΔrG0 = –
- 33. При Т = 298К К = 10 nE0 0,0592
- 34. Большинство биохимических реакций являются окислительно-восстановительными. Они играют важную роль в организме, выполняя две важнейшие функции.
- 35. 1) пластическую – синтез сложных органических молекул; 2) энергетическую – выделение энергии при окислении сложных высокомолекулярных
- 36. Энергоснабжение организма на 99% обеспечивается протеканием в нем ОВ процессов. Причем, 90% всей энергии выделяется при
- 37. Фармакологическое действие ряда лекарственных препаратов основано на их ОВ свойствах. Известно, что окислители обладают бактерицидными свойствами:
- 38. Na2S2O3 – универсальное противоядие, применяемое при отравлениях тяжелыми металлами и хлором: Pb(CH3COOH)2 + Na2S2O3 + H2O
- 39. 8.2 Гальванический элемент (ГЭ) – это устройство для превращения химической энергии в электрическую.
- 40. ГЭ состоит из двух электродов (полуэлементов). Простейший полуэлемент состоит из металлической пластинки, опущенной в раствор своей
- 41. Более активный металл называется анодом. На его поверхности протекает процесс окисления. При работе ГЭ анод заряжается
- 42. На менее активном металле, называемом катодом, протекает процесс восстановления. При работе ГЭ катод заряжается положительно.
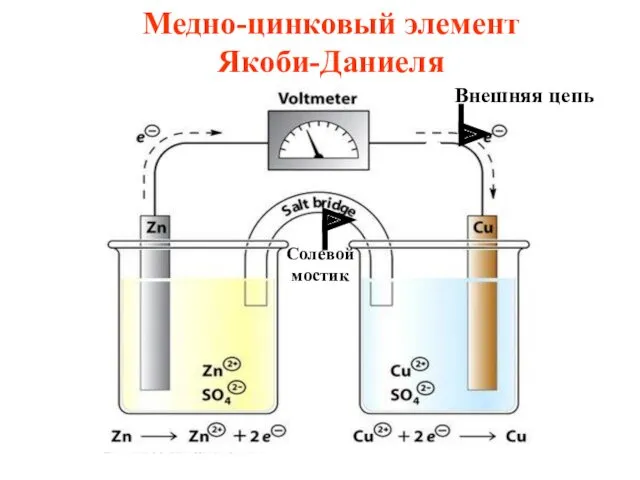
- 43. Солевой мостик Медно-цинковый элемент Якоби-Даниеля Внешняя цепь
- 44. Медный и цинковый электроды соединены металлическим проводником, образующим внешнюю цепь гальванического элемента
- 45. Растворы солей CuSO4 и ZnSO4 соединены между собой солевым мостиком, образующим внутреннюю цепь гальванического элемента. Солевой
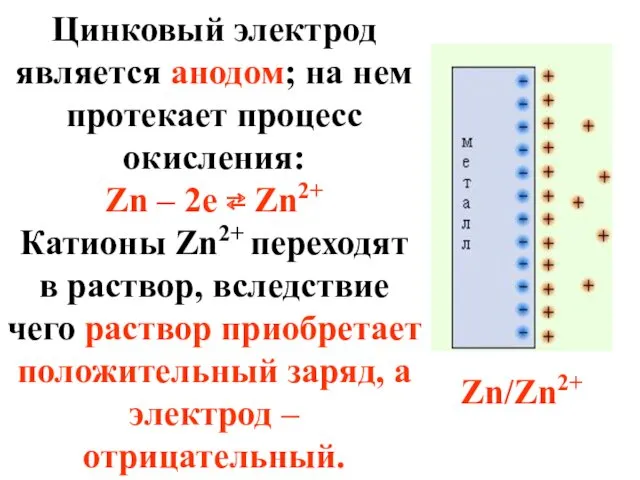
- 46. Цинковый электрод является анодом; на нем протекает процесс окисления: Zn – 2e ⇄ Zn2+ Катионы Zn2+
- 47. Электроны , отданные цинком, поступают во внешнюю цепь и мигрируют к меди.
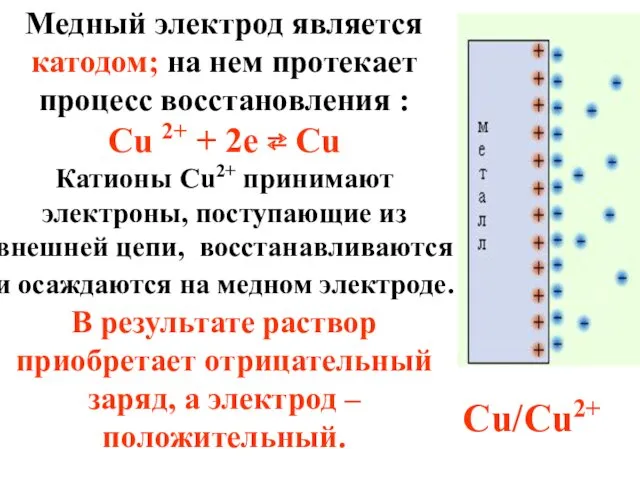
- 48. Медный электрод является катодом; на нем протекает процесс восстановления : Cu 2+ + 2e ⇄ Cu
- 49. (-)Zn / Zn2+ // Cu2+/ Cu (+) Схема медно-цинкового гальванического элемента
- 50. / обозначает поверхность раздела металл-раствор, а также ОВ потенциал (электродный потенциал), возникающий на поверхности электрода вследствие
- 51. // обозначают границу раздела двух растворов, а так же диффузионный потенциал, возникающий из-за их разноименных зарядов.
- 52. Катод: Zn – 2e ⇄ Zn2+ 1 Анод: Cu 2+ + 2e ⇄ Cu 1 Zn
- 53. Э.д.с. гальванического элемента рассчитывают как: Е=φ(катод)–φ(анод)
- 54. Кроме ОВ и диффузионных потенциалов существуют мембранные потенциалы, возникновение которых обусловлено неравномерным распределением заряженных частиц (например,
- 55. Ионный состав нервной клетки
- 56. Для каждого проникающего иона мембранный потенциал рассчитывается по уравнению Нернста: φ = внутр среда Мембранные потенциалы
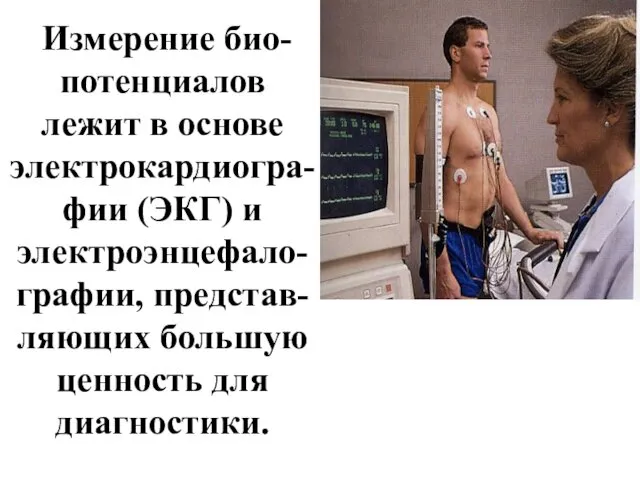
- 57. Измерение био-потенциалов лежит в основе электрокардиогра-фии (ЭКГ) и электроэнцефало-графии, представ-ляющих большую ценность для диагностики.
- 58. КЛАССИФИКАЦИЯ ГЭ Хими-ческие Концент-рацион-ные Топлив-ные
- 59. Химические ГЭ состоят из различных электродов. Концентрационные элементы состоят из одинаковых электродов и отличаются только концентрацией
- 60. С3Н8 + 5 О2 → 3 СО2 + 4 Н2О В топливных элементах энергия, выделяющаяся при
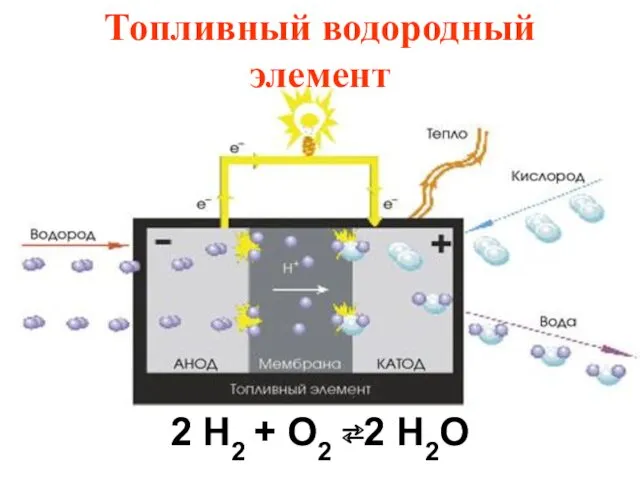
- 61. Топливный водородный элемент 2 H2 + O2 ⇄2 H2O
- 62. КПД водородного элемента составляет не менее 50%. Областями его использования является автомобильный транспорт (до 70% потенциального
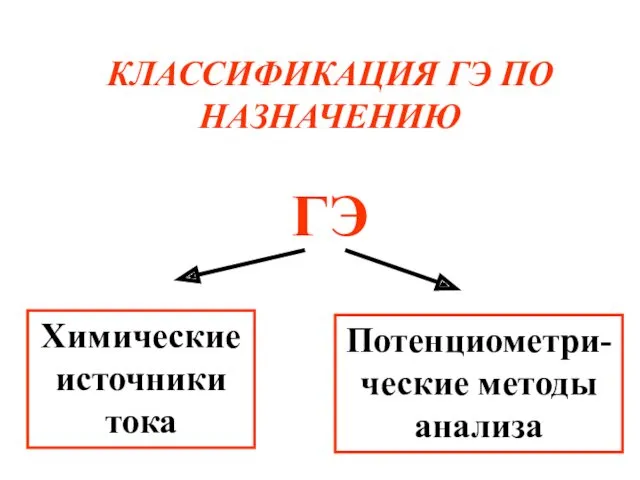
- 63. КЛАССИФИКАЦИЯ ГЭ ПО НАЗНАЧЕНИЮ ГЭ Химические источники тока Потенциометри-ческие методы анализа
- 64. Открытие ГЭ принадлежит анатому из Болоньи Л. Гальвани (конец XVIII в). Получение электричества с помощью химических
- 65. Алоизо Луиджи Гальвани (1726 - 1798) Итальянский врач, анатом и физиолог конца XVIII века; на явление,
- 66. 8.3Потенциометрия – совокупность физико-химических методов анализа, основанных на измерении э.д.с специально составленных ГЭ.
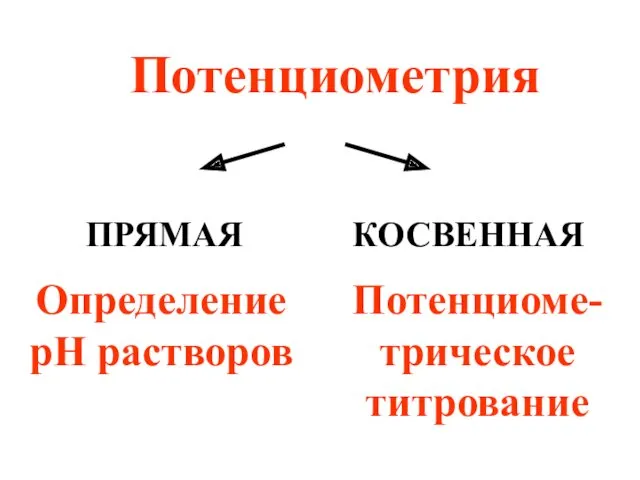
- 67. Потенциометрия ПРЯМАЯ КОСВЕННАЯ Определение рН растворов Потенциоме-трическое титрование
- 68. Типы электродов, применяемых в потенциометрии Электроды 1-го рода – металл, опущенный в раствор своей соли: Cu
- 69. φ = φ0 + 0,0592 n lg [Me n+] Men+ - потенциалопределяющий ион
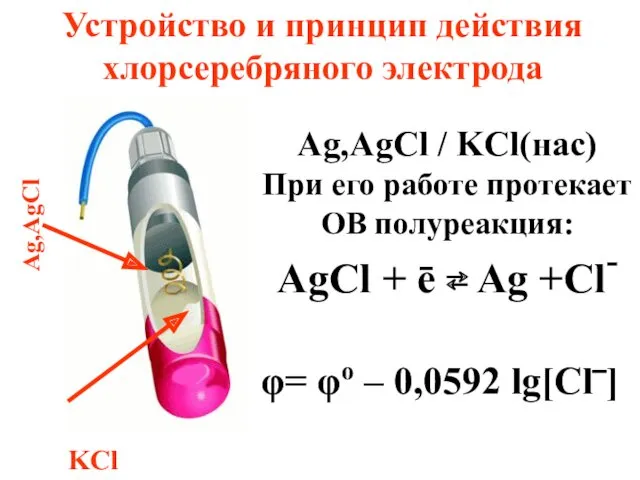
- 70. Электроды 2-го рода – металл, покрытый слоем своего труднорастворимого соединения и опущенный в раствор соли.
- 71. Ag,AgCl / KCl(нас) При его работе протекает ОВ полуреакция: AgCl + ē ⇄ Ag +Cl- φ=
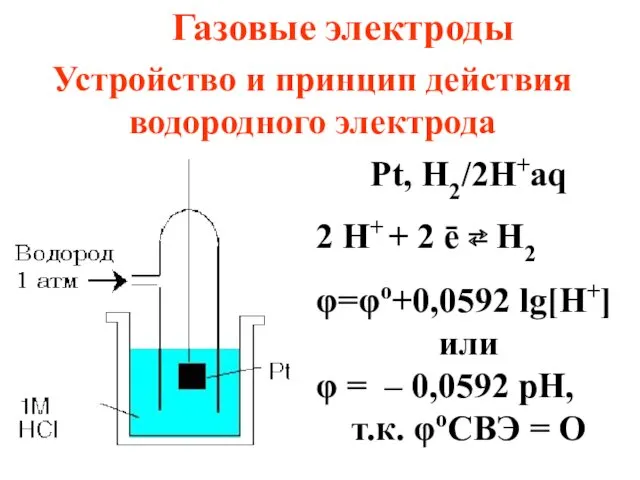
- 72. Устройство и принцип действия водородного электрода Pt, H2/2H+aq 2 H+ + 2 ē ⇄ H2 φ=φo+0,0592
- 73. Ионоселективные электроды (ИСЭ) позволяют определять содержание определенного иона в исследуемом растворе, содержащим смесь различных ионов.
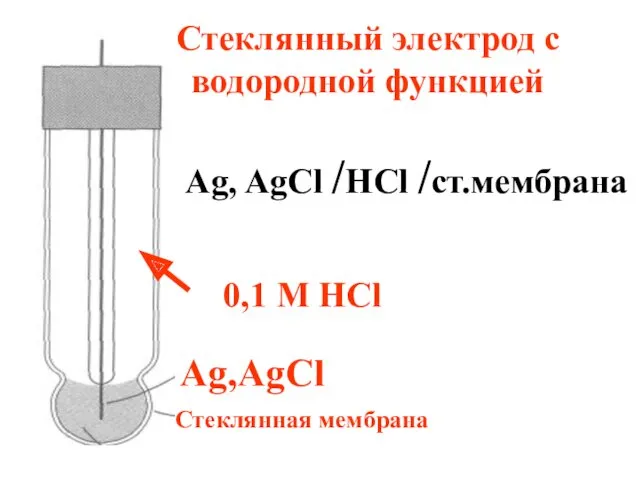
- 74. Стеклянный электрод с водородной функцией 0,1 M HCl Ag,AgCl Ag, AgCl /HCl /ст.мембрана Стеклянная мембрана
- 75. Из-за различного содержания Н+ во внутреннем и исследуемом растворах на поверхности мембраны возникает потенциал, равный: φст
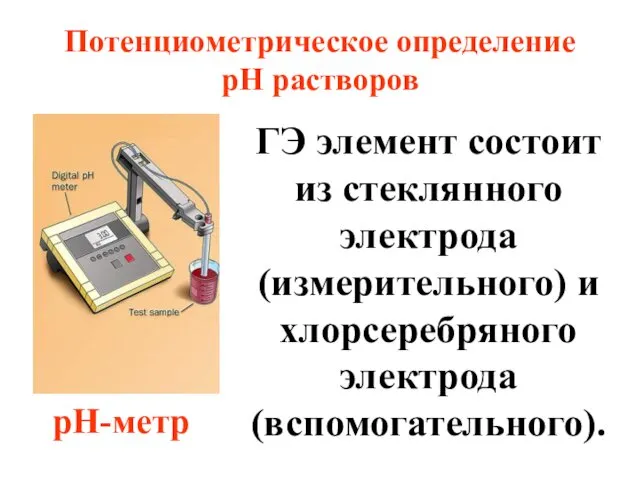
- 76. Потенциометрическое определение рН растворов pH-метр ГЭ элемент состоит из стеклянного электрода (измерительного) и хлорсеребряного электрода (вспомогательного).
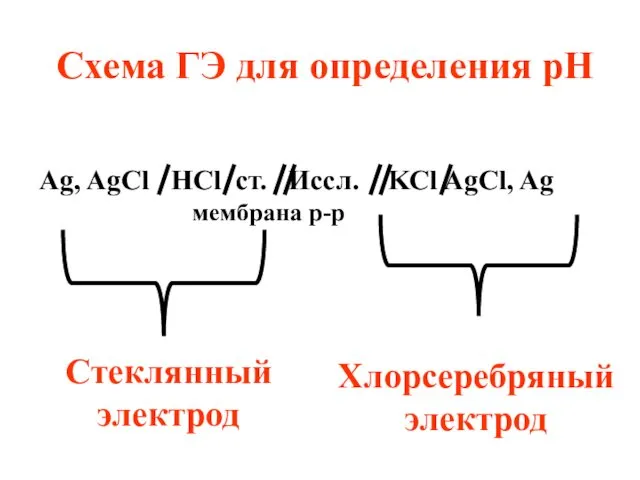
- 77. Ag, AgCl HCl ст. Иссл. KCl AgCl, Ag мембрана р-р Схема ГЭ для определения рН Стеклянный
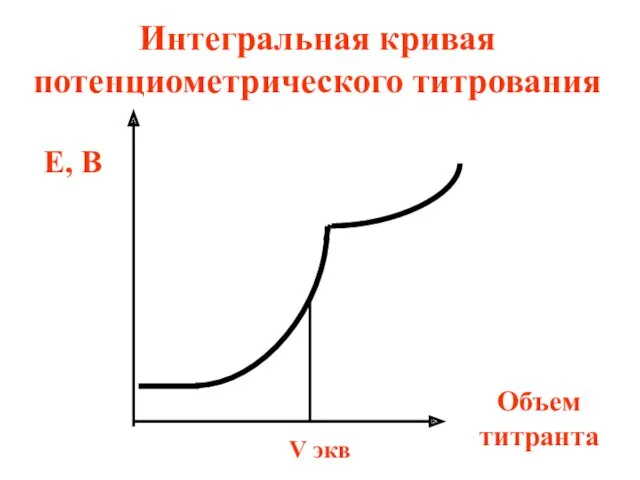
- 78. Потенциометрическое титрование - это любой метод титриметрического анализа, в котором точка эквивалентности фиксируется по резкому изменению
- 79. Интегральная кривая потенциометрического титрования Е, В Объем титранта V экв
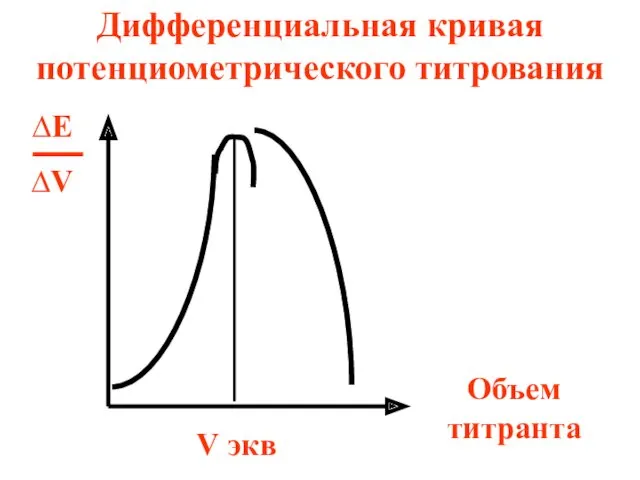
- 80. ∆Е ∆V Объем титранта Дифференциальная кривая потенциометрического титрования V экв
- 81. Потенциометрические методы анализа позволяют: анализировать окрашенные растворы, растворы с осадком и гели, получать точные результаты в
- 83. Скачать презентацию




















![Соответственно: φОк/Вос = φ0Oк/Вос + 0,0592 n lg [Ок] [Вос]](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/107555/slide-23.jpg)


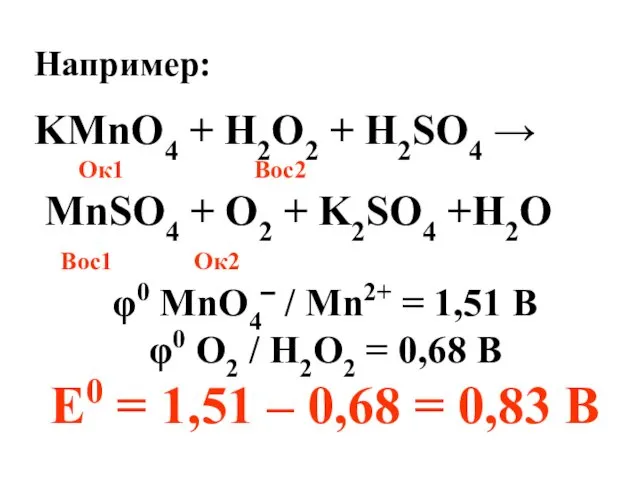

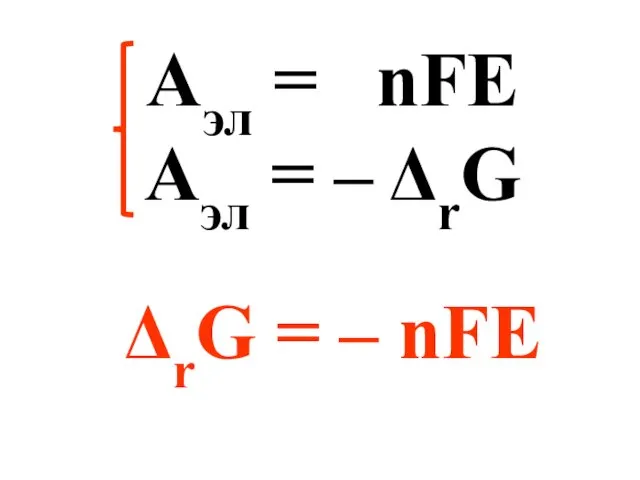

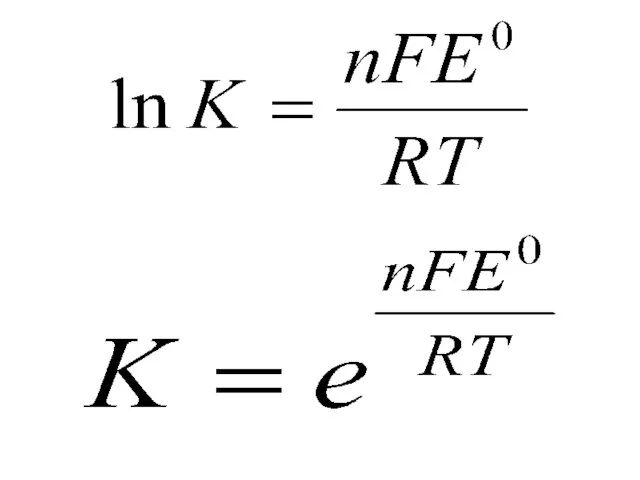





























![φ = φ0 + 0,0592 n lg [Me n+] Men+ - потенциалопределяющий ион](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/107555/slide-68.jpg)





 Предельные углеводороды. Алканы
Предельные углеводороды. Алканы Гетерофункциональные соединения, участвующие в процессах жизнедеятельности
Гетерофункциональные соединения, участвующие в процессах жизнедеятельности Галогены (солеобразующие)
Галогены (солеобразующие) Общая характеристика неметаллов
Общая характеристика неметаллов Спирттер мен фенолдар
Спирттер мен фенолдар Химия вокруг нас
Химия вокруг нас Методы определения Тст и Тт полимеров
Методы определения Тст и Тт полимеров Гидролиз. Необратимый гидролиз
Гидролиз. Необратимый гидролиз Кислоты. Химические свойства кислот
Кислоты. Химические свойства кислот Пневмовакуум-формование
Пневмовакуум-формование Строение атома. Периодическая таблица Менделеева. Химическая связь
Строение атома. Периодическая таблица Менделеева. Химическая связь Бордың адам ағзасына әсері. Бор дегеніміз не?
Бордың адам ағзасына әсері. Бор дегеніміз не? Карбоновые кислоты. 10 класс
Карбоновые кислоты. 10 класс Жёсткость воды
Жёсткость воды Metal–metal multiple bonded intermediates in catalysis
Metal–metal multiple bonded intermediates in catalysis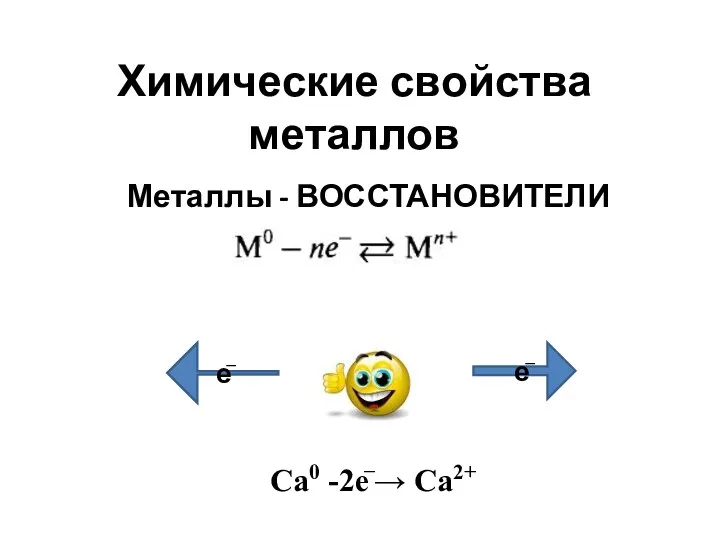 Химические свойства металлов
Химические свойства металлов Биологическая роль макро и микроэлементов. (Лекция 17)
Биологическая роль макро и микроэлементов. (Лекция 17) Химическая связь и ее типы. (11 класс)
Химическая связь и ее типы. (11 класс) Готовимся к экзамену по химии. 9 класс
Готовимся к экзамену по химии. 9 класс Биологически важные 5-ти и 6-ти членные гетероциклические соединения. (Лекция 25)
Биологически важные 5-ти и 6-ти членные гетероциклические соединения. (Лекция 25) Анализ проб воды
Анализ проб воды Мини-тақталарда немесе дәптерде қатты, сұйық және газтектес заттардың құрылысын сал
Мини-тақталарда немесе дәптерде қатты, сұйық және газтектес заттардың құрылысын сал Растворы. Способы выражения концентраций. Сильные и слабые электролиты. Закон разведения Оствальда
Растворы. Способы выражения концентраций. Сильные и слабые электролиты. Закон разведения Оствальда Минеральные удобрения
Минеральные удобрения Каменный уголь. Физические и химические свойства
Каменный уголь. Физические и химические свойства Preparation for COP
Preparation for COP Методы пробоотбора воздуха. Лекция 2
Методы пробоотбора воздуха. Лекция 2 Периодические системы химических элементов
Периодические системы химических элементов