Содержание
- 2. Принципы генной терапии
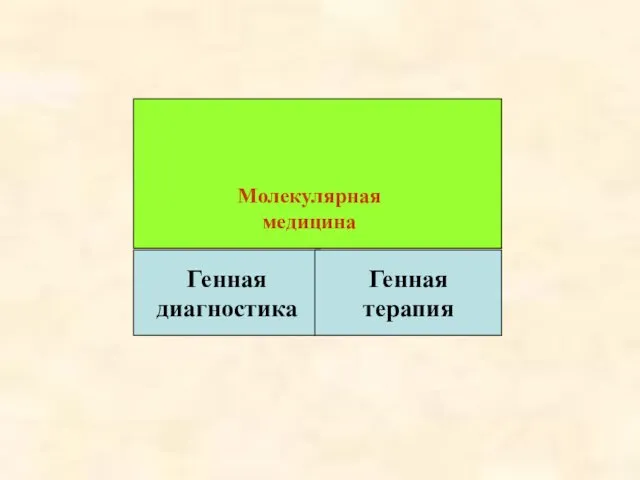
- 3. Молекулярная медицина Генная диагностика Генная терапия
- 4. Генная терапия -новая область современной биомедицины, основанная на введении в организм больного рекомбинантных генетических конструкций с
- 5. 14 сентября 1990 г. - введение ретровирусного вектора, экспрессирующего ген аденозиндеаминазы (ADA) (частота встречаемости 1:100 000)
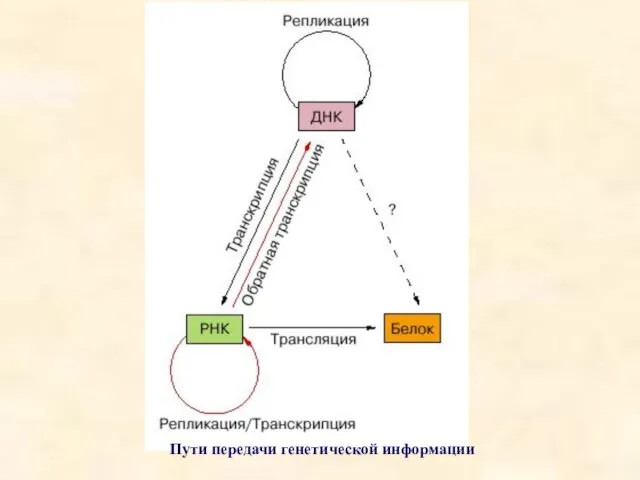
- 6. Пути передачи генетической информации
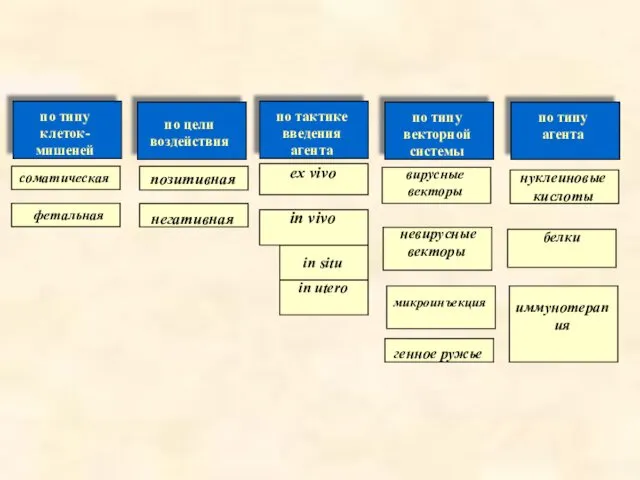
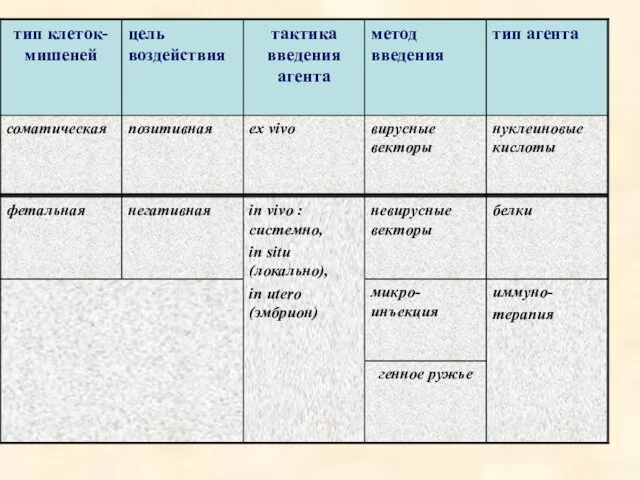
- 7. Классификация генной терапии
- 8. 1) по типу клеток-мишеней: соматическая фетальная 2) по цели воздействия: позитивная ( компенсация экспресcии гена) негативная
- 9. 4) по типу векторной системы: вирусные векторы невирусные векторы микроинъекция “gene gun” (генный пистолет) 5) по
- 10. белки
- 12. Смена парадигм генной терапии от «генетической» к генной терапии от «пересадки» генов к пересадке клеток от
- 13. Генотерапевтические агенты
- 14. Нуклеиновые кислоты – генотерапевтические агенты Антисенс ДНК и РНК Рибозимы Peptide – nucleic acids (PNA) РНК
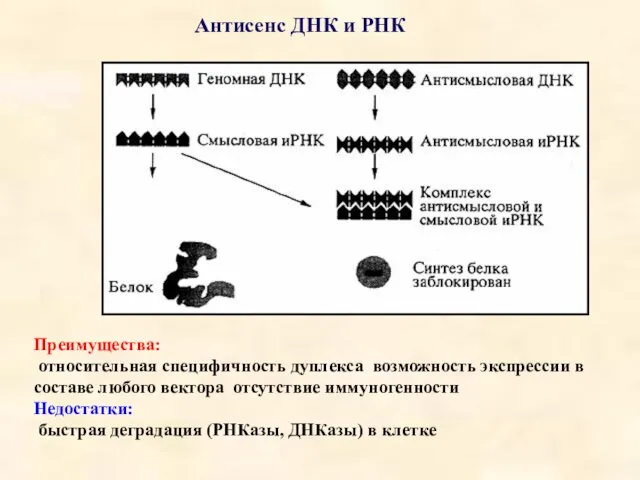
- 15. Антисенс ДНК и РНК Преимущества: относительная специфичность дуплекса возможность экспрессии в составе любого вектора отсутствие иммуногенности
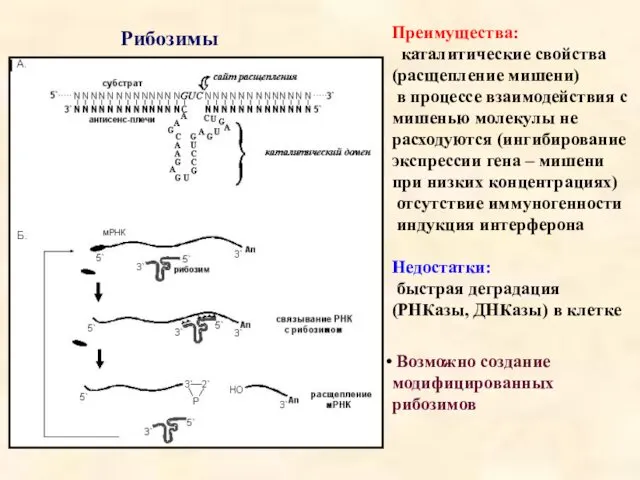
- 16. Рибозимы Преимущества: каталитические свойства (расщепление мишени) в процессе взаимодействия с мишенью молекулы не расходуются (ингибирование экспрессии
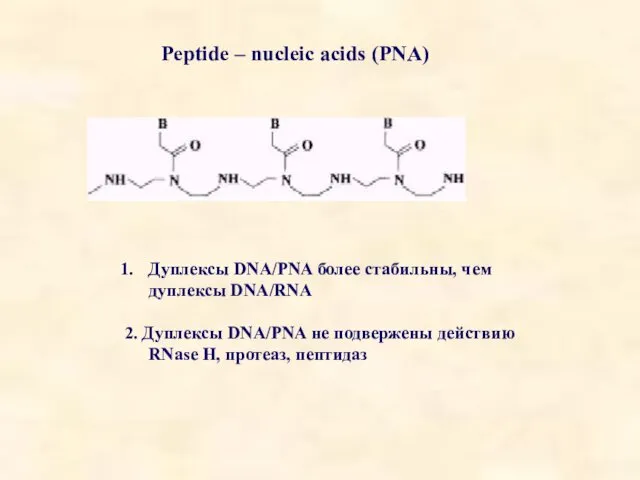
- 17. Peptide – nucleic acids (PNA) Дуплексы DNA/PNA более стабильны, чем дуплексы DNA/RNA 2. Дуплексы DNA/PNA не
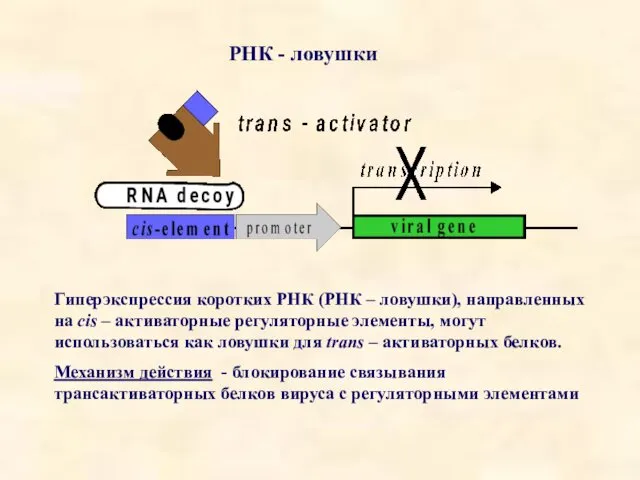
- 18. РНК - ловушки Гиперэкспрессия коротких РНК (РНК – ловушки), направленных на cis – активаторные регуляторные элементы,
- 19. Белки – генотерапевтические агенты Трансдоминантные негативные белки Одноцепочечные антитела (intrabodies) Суицидные гены
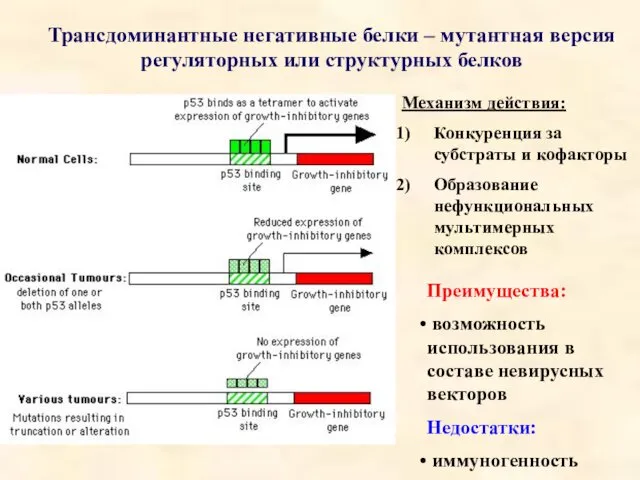
- 20. Трансдоминантные негативные белки – мутантная версия регуляторных или структурных белков Механизм действия: Конкуренция за субстраты и
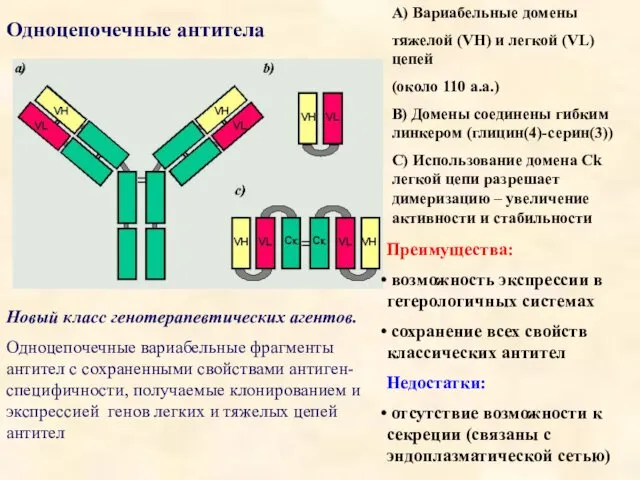
- 21. Одноцепочечные антитела Новый класс генотерапевтических агентов. Одноцепочечные вариабельные фрагменты антител с сохраненными свойствами антиген-специфичности, получаемые клонированием
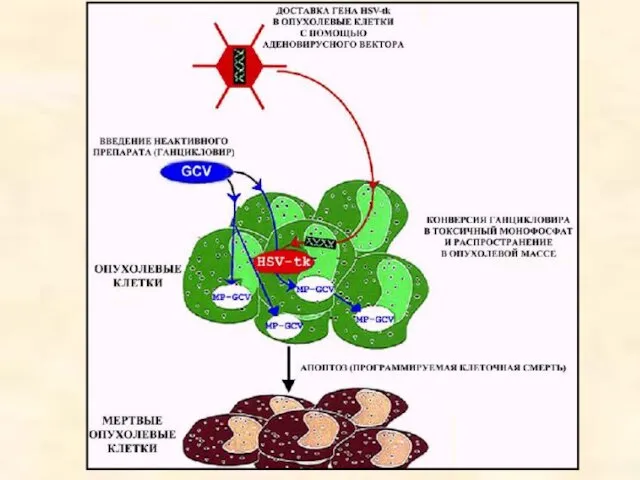
- 22. Суицидные гены Вместо ингибирования (или компенсации) функции дефектного гена возможно использование суицидных генов, экспрессия которых вызывает
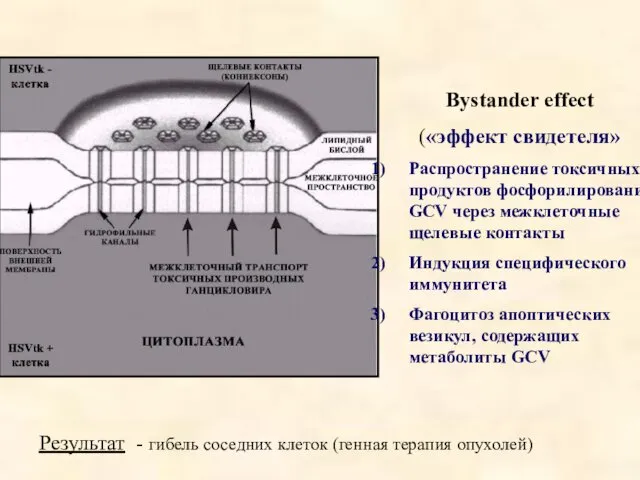
- 24. Bystander effect («эффект свидетеля» Распространение токсичных продуктов фосфорилирования GCV через межклеточные щелевые контакты Индукция специфического иммунитета
- 25. Иммунотерапия ДНК – вакцины Антиген – специфичные Т лимфоциты
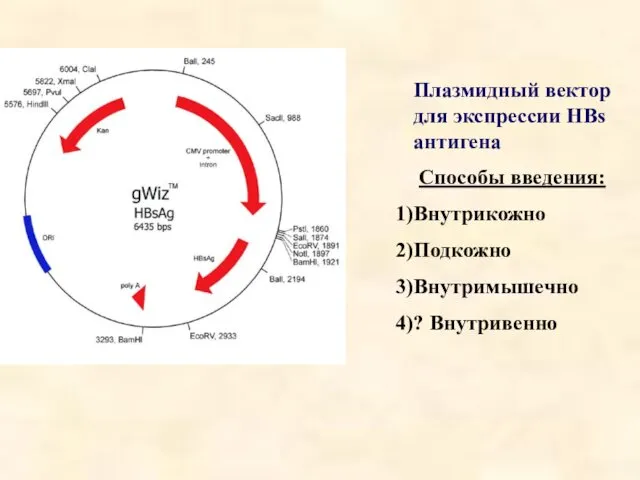
- 26. Плазмидный вектор для экспрессии HBs антигена Способы введения: Внутрикожно Подкожно Внутримышечно ? Внутривенно
- 27. Преимущества: дешевизна производства отсутствие иммуногенности (? Анти-ДНК антитела) экспрессия продукта гена в нативной форме индукция Т-клеточного
- 28. Знаем: что лечить Знаем: чем лечить Не знаем: КАК ЛЕЧИТЬ?
- 29. Системы доставки генетического материала Векторы вирусные невирусные
- 30. Вирусные векторы: ретровирусы аденовирусы аденоассоциированный вирус герпесвирусы лентивирусы и др. - достоинства: трансфекция большого количества клеток
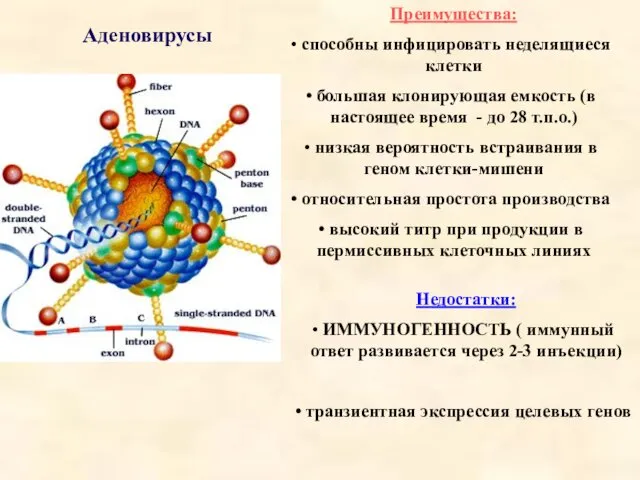
- 31. Аденовирусы Преимущества: способны инфицировать неделящиеся клетки большая клонирующая емкость (в настоящее время - до 28 т.п.о.)
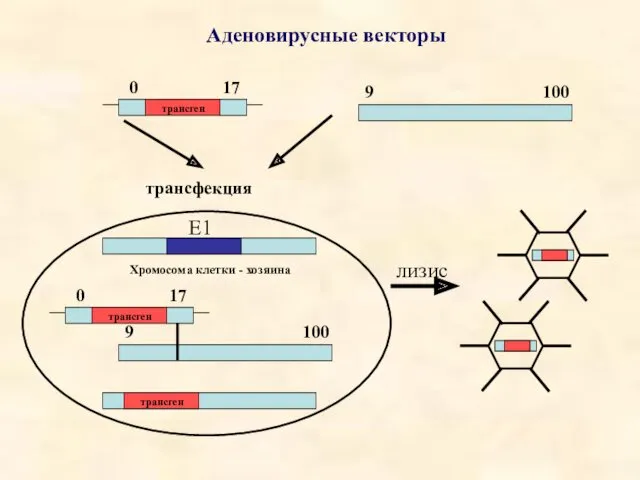
- 32. Аденовирусные векторы
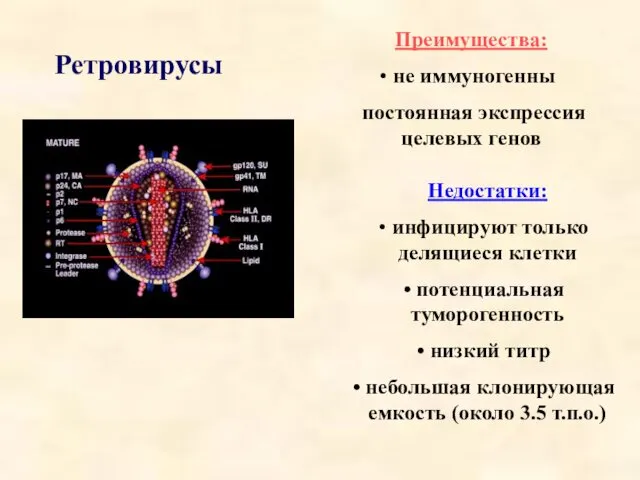
- 33. Ретровирусы Преимущества: не иммуногенны постоянная экспрессия целевых генов Недостатки: инфицируют только делящиеся клетки потенциальная туморогенность низкий
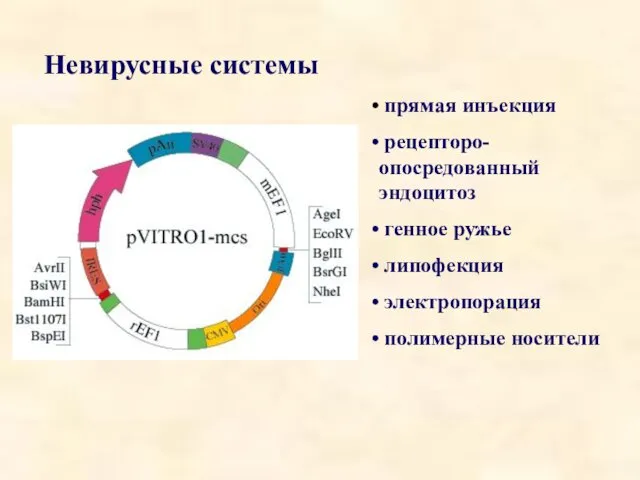
- 34. Невирусные системы прямая инъекция рецепторо-опосредованный эндоцитоз генное ружье липофекция электропорация полимерные носители
- 35. Плазмидные векторы - достоинства: отсутствие токсичности и мутагенности практически неограниченная емкость вектора дешевизна производства - недостатки:
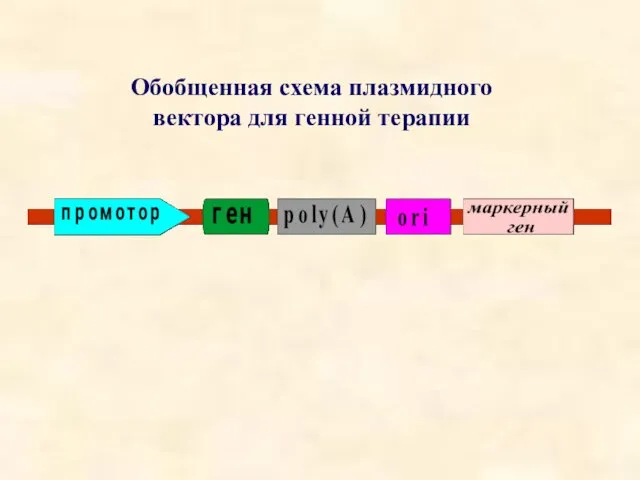
- 36. Обобщенная схема плазмидного вектора для генной терапии
- 37. Маркерные гены: SEAP (secreted alkaline phosphatase) β - galactosidase G418 (neomycin) GFP (green fluorescent protein)
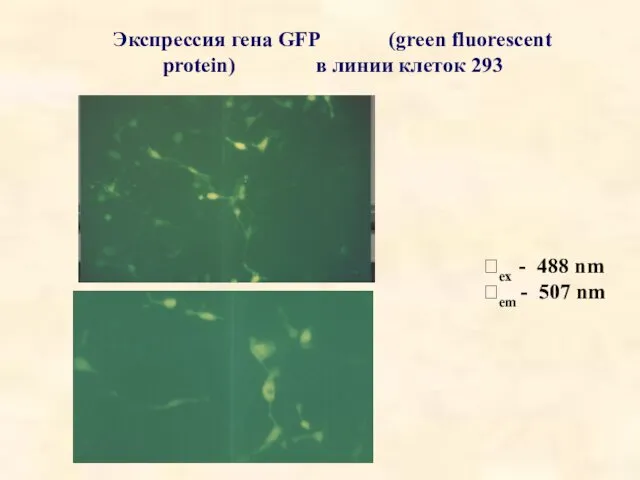
- 38. Экспрессия гена GFP (green fluorescent protein) в линии клеток 293 ex - 488 nm em -
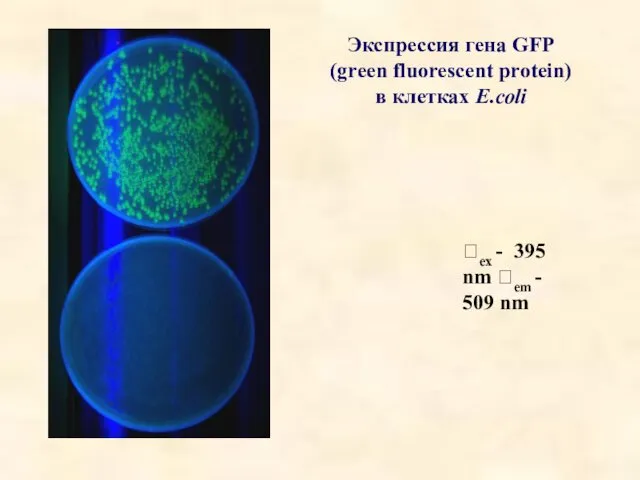
- 39. Экспрессия гена GFP (green fluorescent protein) в клетках E.coli ex - 395 nm em - 509
- 40. Физические методы доставки рекомбинантных плазмидных векторов: прямая инъекция «голого» гена в ткань (ДНК-вакцинация) электропорация липофекция кальций-фосфатная
- 42. Принцип действия “Effecten Transfection Reagent” (“QIAGEN”, Germany)
- 43. Смешанные системы доставки
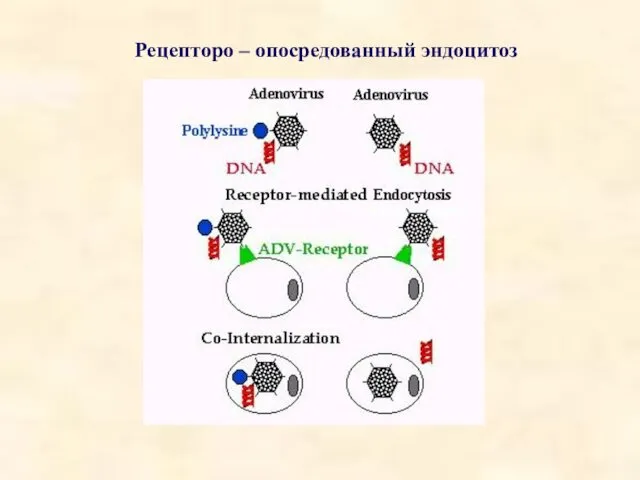
- 44. Рецепторо – опосредованный эндоцитоз
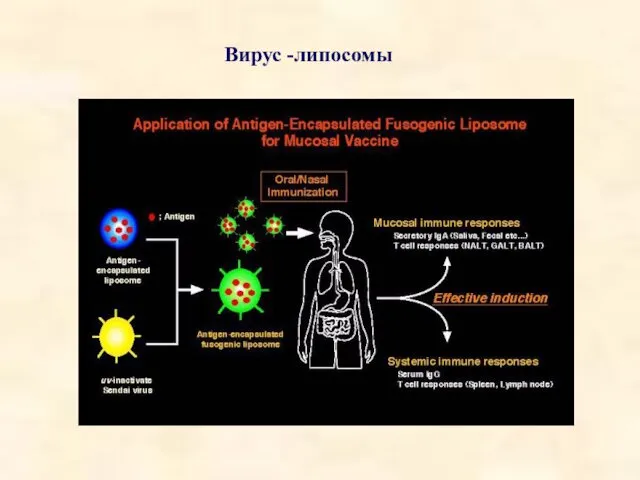
- 45. Вирус -липосомы
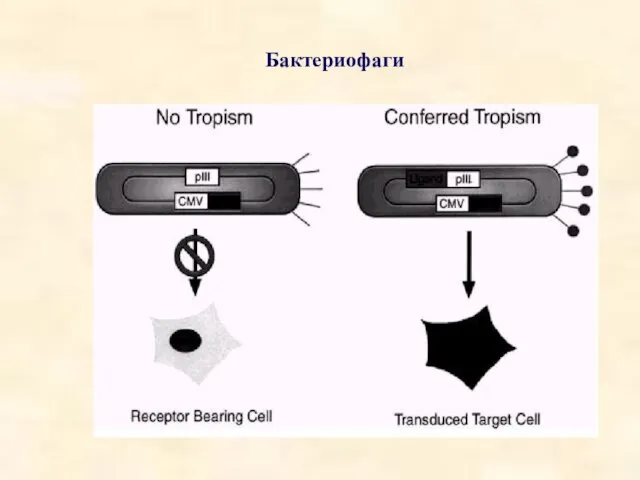
- 46. Бактериофаги
- 47. Генная терапия в медицине
- 48. Клинические испытания генотерапевтических препаратов. I фаза. Оценка токсичности генной конструкции. II фаза. Ограниченные испытания на небольшом
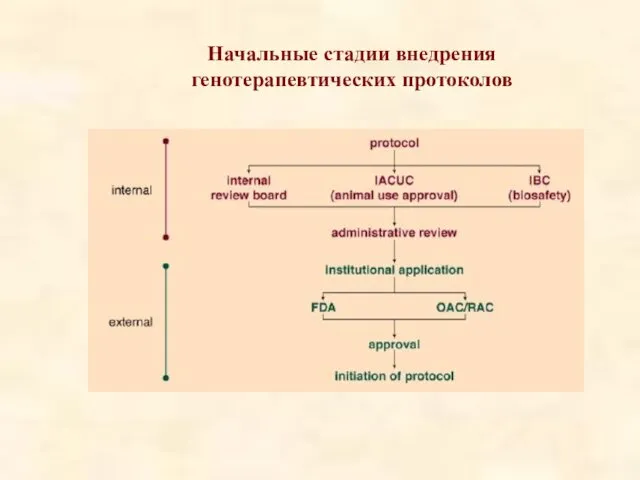
- 49. Начальные стадии внедрения генотерапевтических протоколов
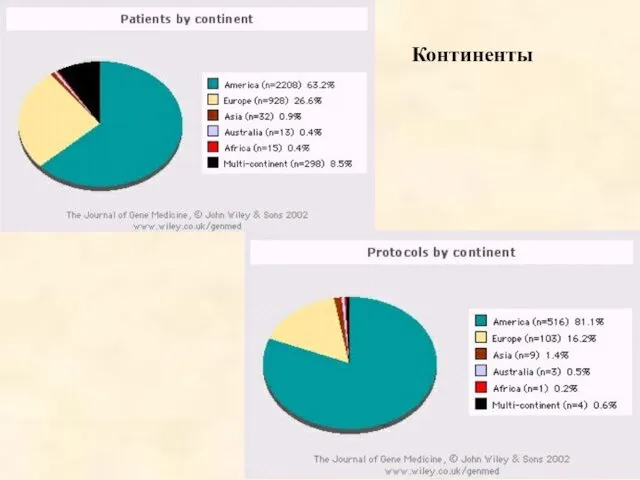
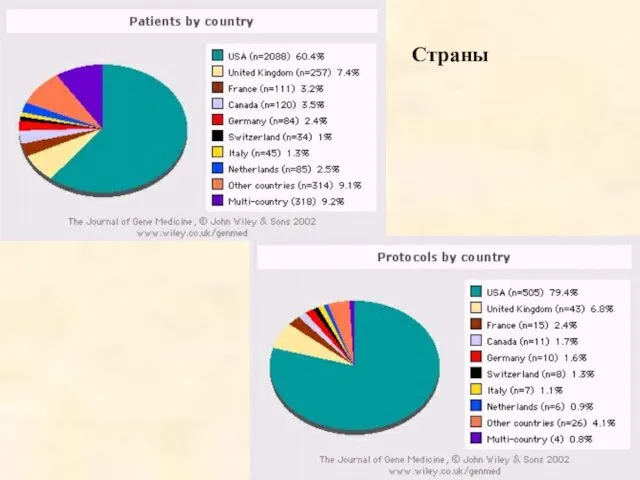
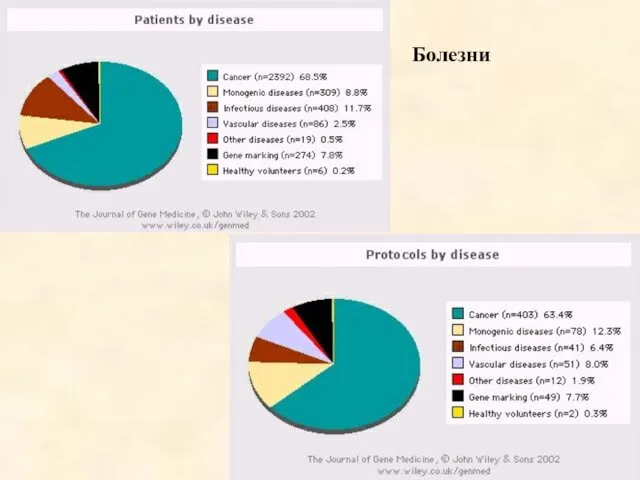
- 50. Зарегистрировано 636 клинических протоколов генной терапии 3496 пациента имеют в своем организме генетически модифицированные клетки 63,4
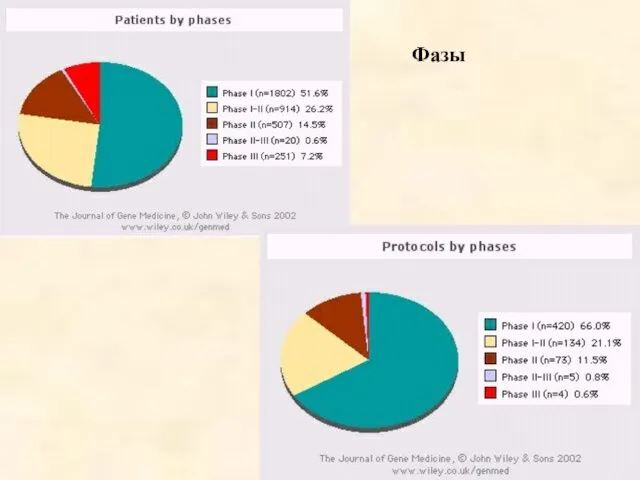
- 51. Из 636 генотерапевтических проектов: 420 проектов (66%) - I фаза клинических испытаний 134 проекта (21,1%) -
- 52. Современное состояние генной терапии
- 53. Континенты
- 54. Страны
- 55. Болезни
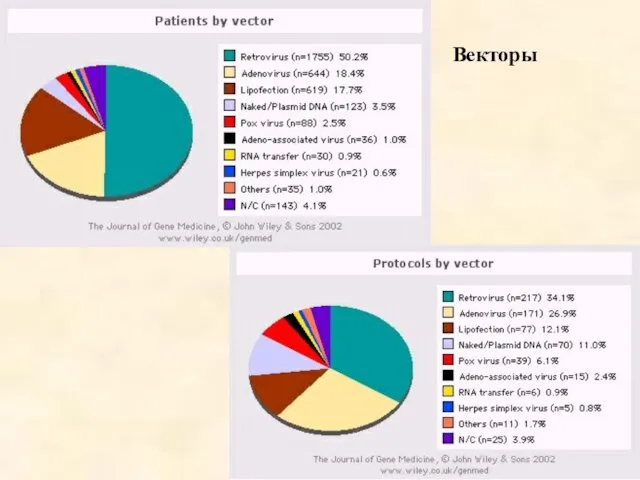
- 56. Векторы
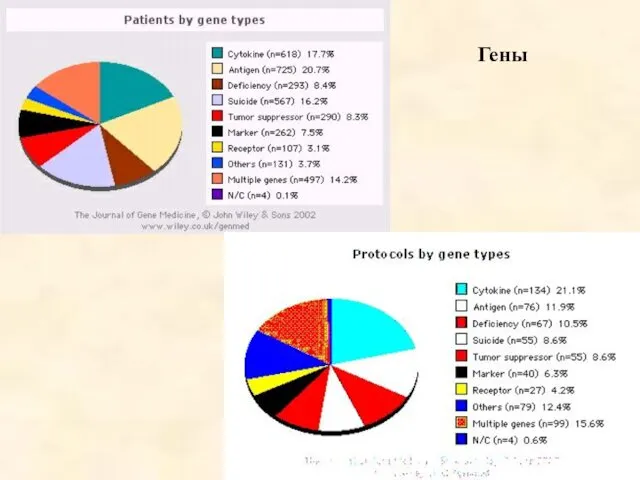
- 57. Гены
- 58. Фазы
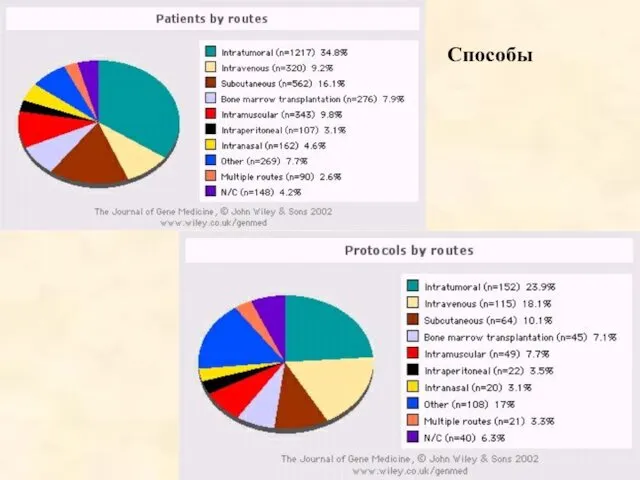
- 59. Способы
- 60. III фаза клинических испытаний Генная терапия глиобластомы головного мозга. После резекции в ложе опухоли вносятся мышиные
- 61. Реализуемые механизмы: прямой эффект фосфорилированного ганцикловира «bystander effect» - гибель соседних опухолевых клеток за счет проникновения
- 62. Генная терапия остеосаркомы (ESCCHN) (2 протокола) Частота встречаемости - 40 000 случаев в год (США) Предпосылки
- 63. Генная терапия метастатической меланомы (иммунотерапия) Генотерапевтический агент - HLA-B7/Beta-2 Microglobulin cDNA Презентация антигенов MHC класса I
- 64. Первый трагический случай Смерть в сентябре 1999 г. Джесси Гелзингера (США). Страдал недостаточностью орнитинкарбамоил-трансферазы (ОКТ). Смерть
- 65. ПРИМЕРЫ: муковисцидоз (кистозный фиброз поджелудочной железы) - перенос гена МТР (муковисцидозный трансмембранный регулятор) с помощью аденовирусного
- 68. Основные подходы в генокоррекции онкологических заболеваний
- 71. Новые подходы к коррекции генных дефектов: Химеропластика (коррекция ДНК в клетке) Химеропласты - ДНК/РНК гибриды (около
- 72. Выводы: Генная терапия пригодна для лечения широкого спектра заболеваний. Генная терапия имеет низкий уровень риска осложнений.
- 73. вопросы Сможет ли генная терапия в будущем обеспечить полноценную генокоррекцию, которая не представит угрозы для потомства?
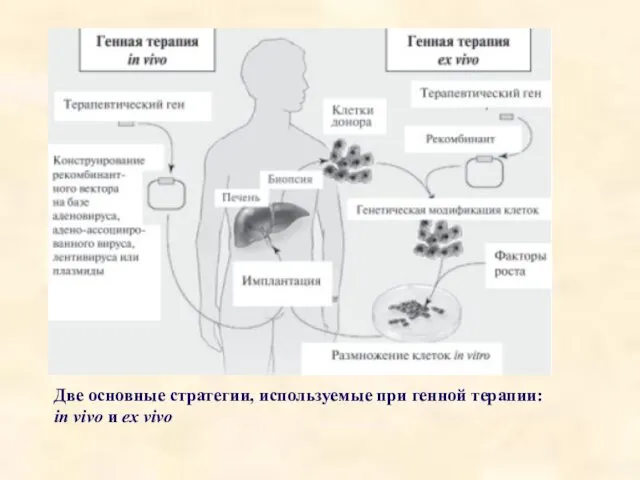
- 74. Две основные стратегии, используемые при генной терапии: in vivo и ex vivo
- 75. Генная терапия человека На людях технология генной инженерии была впервые применена для лечения Ашанти Де Сильвы,
- 76. Работающая копия гена ADA была введена в клетки крови Ашанти с помощью модифицированного вируса. Клетки получили
- 77. В настоящее время известно 4000 наследственных заболеваний, для большинства из которых не найдено эффективных способов лечения.
- 78. Неблагоприятная экологическая обстановка и целый ряд других подобных причин приводят к тому, что все больше детей
- 79. Генно-инженерный метод лечения диабета Канадские исследователи идентифицировали белок, ингибирующий выработку инсулина у мышей и получили линию
- 80. Одна из самых больших загадок диабета – причина, по которой специализированные клетки поджелудочной железы прекращают секретировать
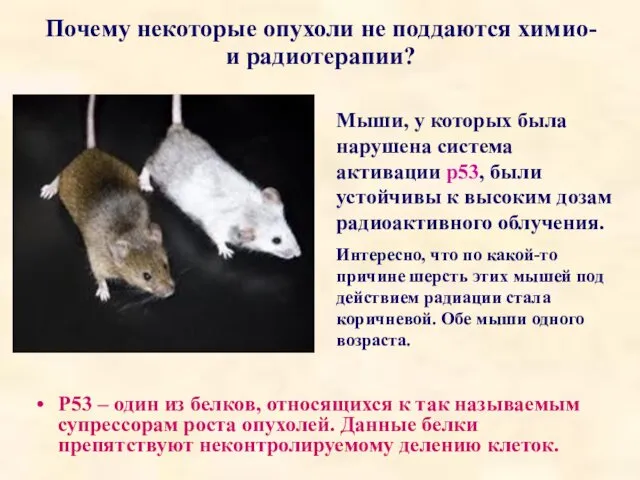
- 81. Почему некоторые опухоли не поддаются химио- и радиотерапии? Р53 – один из белков, относящихся к так
- 82. Р53 – белок, вызывающий апоптоз (физиологическую гибель) аномальных быстро делящихся клеток. В норме существует по крайней
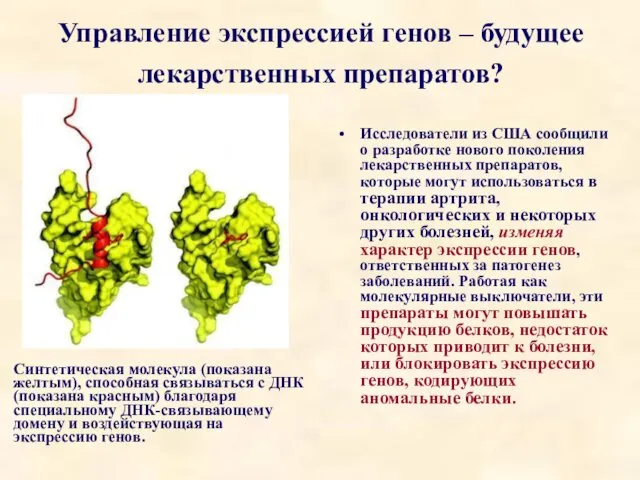
- 83. Управление экспрессией генов – будущее лекарственных препаратов? Исследователи из США сообщили о разработке нового поколения лекарственных
- 84. В своих экспериментах профессор Анна К. Мапп и ее коллеги сосредоточились на работе молекул, влияющих на
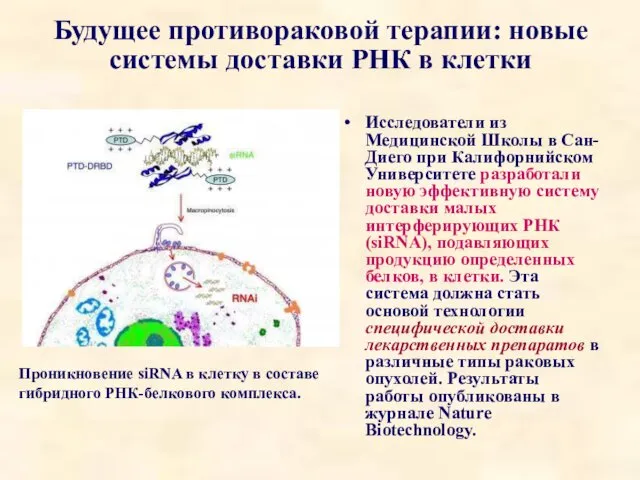
- 85. Будущее противораковой терапии: новые системы доставки РНК в клетки Исследователи из Медицинской Школы в Сан-Диего при
- 86. «Малые интерферирующие РНК, осуществляющие процесс так называемой РНК-интерференции, обладают невероятным потенциалом для лечения рака», объясняет профессор
- 87. Как довести рак до самоубийства? Специалисты из Казанского государственного университетаСпециалисты из Казанского государственного университета, московского Института
- 89. Скачать презентацию

















































 Внутрибольничная инфекция
Внутрибольничная инфекция Подписание медицинской документации (электронные медицинские документы)
Подписание медицинской документации (электронные медицинские документы) Программа реабилитации больных бронхиальной астмой
Программа реабилитации больных бронхиальной астмой Лекарственные формы
Лекарственные формы Особенности лечебной физкультуры
Особенности лечебной физкультуры Интенсивная терапия при острых нарушениях кровообращения (шоки)
Интенсивная терапия при острых нарушениях кровообращения (шоки) Железодефицитная анемия и беременность
Железодефицитная анемия и беременность Внутренняя картина болезни и ее взаимосвязь между психоэмоциональным состоянием у лиц с сахарным диабетом 2 типа
Внутренняя картина болезни и ее взаимосвязь между психоэмоциональным состоянием у лиц с сахарным диабетом 2 типа Планирование в здравоохранении
Планирование в здравоохранении Учение об инфекции. Патогенность и вирулентность микробов
Учение об инфекции. Патогенность и вирулентность микробов Система коррекционно-педагогической работы при дизартрии
Система коррекционно-педагогической работы при дизартрии Общая анатомия венозной системы. Вены головы и шеи
Общая анатомия венозной системы. Вены головы и шеи Острая дыхательная недостаточность
Острая дыхательная недостаточность Лучевая диагностика полостных образований
Лучевая диагностика полостных образований Выделительная система
Выделительная система Acute and chronic glomerulonephritis
Acute and chronic glomerulonephritis Принципы использования лекарственных веществ
Принципы использования лекарственных веществ Буындағы қозғалысты модельдеу. Буын түрлері
Буындағы қозғалысты модельдеу. Буын түрлері Гигиеническая оценка пищевых добавок, применяемых в РК
Гигиеническая оценка пищевых добавок, применяемых в РК Пневмония. Классификация
Пневмония. Классификация Нутритивная поддержка в многопрофильном стационаре
Нутритивная поддержка в многопрофильном стационаре Ближневосточный респираторный коронавирусный синдром
Ближневосточный респираторный коронавирусный синдром Операция вскрытия или обнажения сустава - артротомия
Операция вскрытия или обнажения сустава - артротомия Минералдық дистрофиялар
Минералдық дистрофиялар Этапы определения потребности в медицинском имуществе
Этапы определения потребности в медицинском имуществе Расспрос, осмотр и пальпация грудной клетки легочного больного
Расспрос, осмотр и пальпация грудной клетки легочного больного Средства, влияющие на иммунитет
Средства, влияющие на иммунитет Тревожные расстройства_2.pptx
Тревожные расстройства_2.pptx