2 Гелий
He
4,0026
.История открытия. Гелий впервые был идентифицирован как химический элемент в 1868 П.Жансеном
при изучении солнечного затмения в Индии. При спектральном анализе солнечной хромосферы была обнаружена ярко-желтая линия, первоначально отнесенная к спектру натрия, однако в 1871 Дж.Локьер и П.Жансен доказали, что эта линия не относится ни к одному из известных на земле элементов. Локьер и Э.Франкленд назвали новый элемент гелием от греч. «гелиос», что означает солнце. В то время не знали, что гелий – инертный газ, и предполагали, что это металл. И только спустя почти четверть века гелий был обнаружен на земле. В 1895, через несколько месяцев после открытия аргона, У.Рамзай и почти одновременно шведские химики П.Клеве и Н.Ленгле установили, что гелий выделяется при нагревании минерала клевеита. Год спустя Г.Кейзер обнаружил примесь гелия в атмосфере, а в 1906 гелий был обнаружен в составе природного газа нефтяных скважин Канзаса. В том же году Э.Резерфорд и Т.Ройдс установили, что a-частицы, испускаемые радиоактивными элементами, представляют собой ядра гелия.
ГЕЛИЙ, He (helium), химический элемент из семейства благородных (инертных) газов He, Ne, Ar, Kr, Xe, Rn, составляющих VIIIA подгруппу в периодической системе элементов, или, как ее еще называют, нулевую группу.




















 Розрахункові задачі. Обчислення за хімічними рівняннями. Відносного виходу продукту реакції
Розрахункові задачі. Обчислення за хімічними рівняннями. Відносного виходу продукту реакції Углеводы, 10 класс
Углеводы, 10 класс Углеводы - 2
Углеводы - 2 Химическая посуда и лабораторное оборудование
Химическая посуда и лабораторное оборудование Комплексные соединения. Определения
Комплексные соединения. Определения Химические свойства солей
Химические свойства солей Ознайомлення зі зразками пластмас. Практична робота №4
Ознайомлення зі зразками пластмас. Практична робота №4 Фракционирование клеточных экстрактов
Фракционирование клеточных экстрактов От кулинарии — к кулинохимии
От кулинарии — к кулинохимии Геохимия природных процессов
Геохимия природных процессов Химические свойства солей в свете теории электролитической диссоциации
Химические свойства солей в свете теории электролитической диссоциации Химия нефти и газа. Свойства нефти и нефтепродуктов. Свойства газов
Химия нефти и газа. Свойства нефти и нефтепродуктов. Свойства газов Карбоновые кислоты
Карбоновые кислоты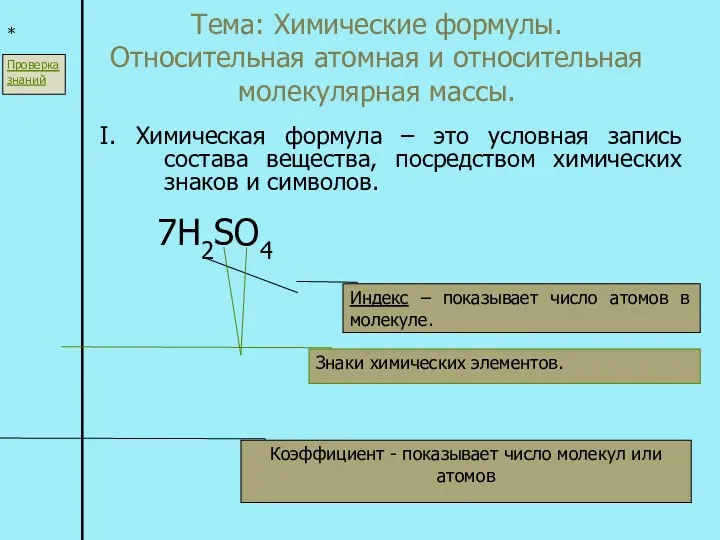 Химические формулы. Относительная атомная и относительная молекулярная массы
Химические формулы. Относительная атомная и относительная молекулярная массы Масова частка розчиненої речовини
Масова частка розчиненої речовини Количество вещества. Молярная масса. Молярный объем
Количество вещества. Молярная масса. Молярный объем Тема. Водородная связь
Тема. Водородная связь Характеристика химического элемента по его положению в ПСХЭ Д.И. Менделеева
Характеристика химического элемента по его положению в ПСХЭ Д.И. Менделеева Сульфидтер. Аз еруші сульфидтер
Сульфидтер. Аз еруші сульфидтер Палладий. История открытия химических веществ
Палладий. История открытия химических веществ Азот
Азот Первоначальные сведения о строении вещества
Первоначальные сведения о строении вещества Классификация органических соединений. Углеводороды
Классификация органических соединений. Углеводороды Радикальные реакции. (Лекция 9)
Радикальные реакции. (Лекция 9) Синтетичні миючі засоби
Синтетичні миючі засоби Комплексные соединения
Комплексные соединения Plastic varieties and applications in construction
Plastic varieties and applications in construction Сложные эфиры. Жиры. Мыло
Сложные эфиры. Жиры. Мыло