Содержание
- 2. ВОПРОСЫ: Какие вещества относят к солям? Как составляют формулы солей? Как называются соли ? - хлориды,
- 3. 1. ВЗАИМОДЕЙСТВИЕ С МЕТАЛЛАМИ СОЛЬ + МЕТАЛЛ → новая СОЛЬ + Металл↓ каждый предыдущий металл вытесняет
- 4. ЗАДАНИЕ Допишите уравнения реакций: Al + FeSO₄ → III II Fe + Al₂(SO₄)₃ 2 3 3
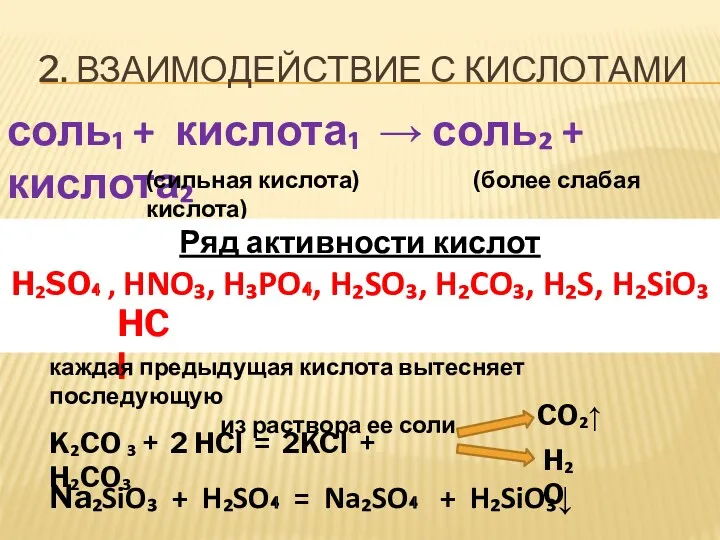
- 5. 2. ВЗАИМОДЕЙСТВИЕ С КИСЛОТАМИ соль₁ + кислота₁ → соль₂ + кислота₂ (сильная кислота) (более слабая кислота)
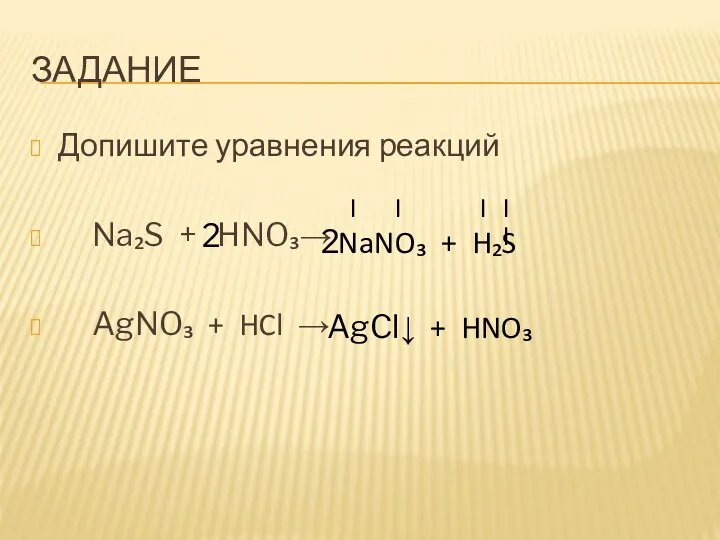
- 6. ЗАДАНИЕ Допишите уравнения реакций Na₂S + HNO₃→ AgNO₃ + HCl → I I I II NaNO₃
- 7. 3. ВЗАИМОДЕЙСТВИЕ С ОСНОВАНИЯМИ соль₁ +основание₁ = соль₂ +основание₂↓ CuSO₄ + 2NaOH = Cu(OH)₂↓ + Na₂SO₄
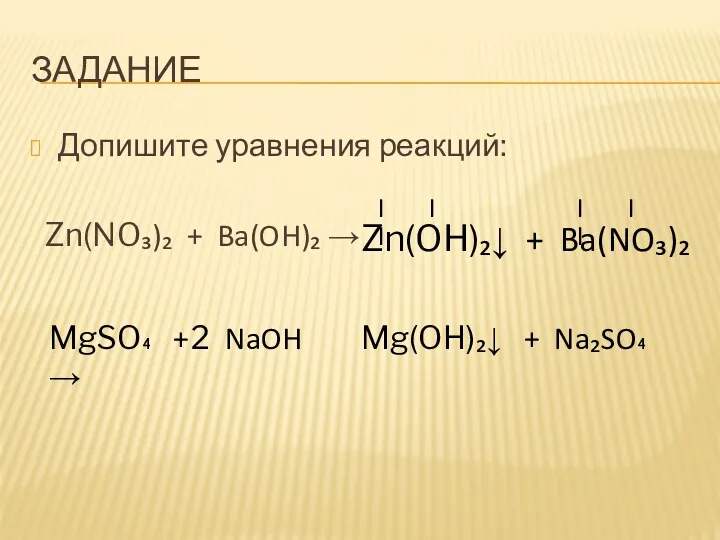
- 8. ЗАДАНИЕ Допишите уравнения реакций: Zn(NO₃)₂ + Ba(OH)₂ → Zn(OH)₂↓ + Ba(NO₃)₂ II I II I MgSO₄
- 9. 4. ВЗАИМОДЕЙСТВИЕ С СОЛЯМИ соль₁ +соль₂= новая соль₁↓+ новая соль₂ BaCl₂ + Na₂SO₄ = BaSO₄↓ +
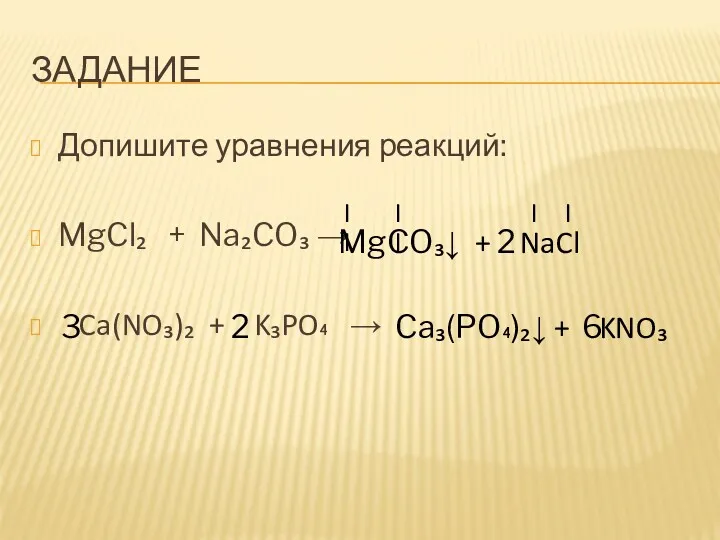
- 10. ЗАДАНИЕ Допишите уравнения реакций: MgCl₂ + Na₂CO₃ → Ca(NO₃)₂ + K₃PO₄ → MgCO₃↓ + NaCl II
- 11. 5. РАЗЛОЖЕНИЕ ПРИ НАГРЕВАНИИ НЕРАСТВОРИМЫХ СОЛЕЙ соль ↓ → оксид металла + оксид неметалла t⁰C BaSiO₃↓
- 12. ВЫВОД: + металл → + кислота → + основание → + соль → разложение при нагревании
- 13. Т Е С Т 1. Карбонат калия - K₂CO₃ реагирует c : а) оксидом натрия -
- 15. Скачать презентацию








 Макро, микро и ультрамикроэлементы. Их роль
Макро, микро и ультрамикроэлементы. Их роль Знаки вторичной переработки
Знаки вторичной переработки Физико-химические свойства алкенов
Физико-химические свойства алкенов Оксигеновмісні сполуки. Одноатомні та багатоатомні спирти. Феноли. Лекція №6
Оксигеновмісні сполуки. Одноатомні та багатоатомні спирти. Феноли. Лекція №6 Химия в повседневной жизни человека
Химия в повседневной жизни человека Фенол. 10 класс
Фенол. 10 класс Каучук. Немного из истории
Каучук. Немного из истории Химические превращения веществ
Химические превращения веществ Основания - свойства ТЭД
Основания - свойства ТЭД Химические свойства оксидов
Химические свойства оксидов Алюминий и его сплавы
Алюминий и его сплавы Химическая промышленность и химические технологии
Химическая промышленность и химические технологии Выращивание кристаллов в домашних условиях
Выращивание кристаллов в домашних условиях Фторопласт-4 (тефлон, політетрафлуоретен)
Фторопласт-4 (тефлон, політетрафлуоретен) Жиры. Мыла. СМС. 10 класс
Жиры. Мыла. СМС. 10 класс La notion de catabolisme et d’anabolisme. La bioenergetique. La chaine mitochondriale de transfert d’electrons
La notion de catabolisme et d’anabolisme. La bioenergetique. La chaine mitochondriale de transfert d’electrons Hydrophilization and hydrophobization of the surface of solids with the help of SAA
Hydrophilization and hydrophobization of the surface of solids with the help of SAA Plastics слайды
Plastics слайды Оценка химической обстановки при авариях на химически опасных объектах
Оценка химической обстановки при авариях на химически опасных объектах Электролиз
Электролиз Окисно-відновні реакції та їхнє значення
Окисно-відновні реакції та їхнє значення Пищевые добавки
Пищевые добавки Обратимость химических реакций. Химическое равновесие
Обратимость химических реакций. Химическое равновесие Закономерности протекания химических реакций
Закономерности протекания химических реакций Органические производные пятивалентного фосфора. Способы получения
Органические производные пятивалентного фосфора. Способы получения Карбоновые кислоты и их функциональные производные. Хроматографические методы исследования
Карбоновые кислоты и их функциональные производные. Хроматографические методы исследования Гидролиз солей
Гидролиз солей Галогены (солеобразующие)
Галогены (солеобразующие)