Содержание
- 2. До оксигеновмісних сполук відносять ті, що містять атоми Карбонну в молекулі. До цієї групи відносять одноатомні
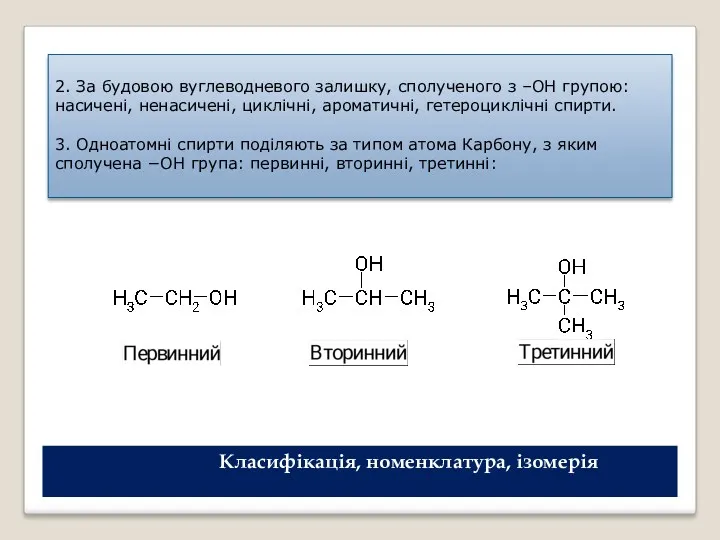
- 3. 2. За будовою вуглеводневого залишку, сполученого з –ОН групою: насичені, ненасичені, циклічні, ароматичні, гетероциклічні спирти. 3.
- 4. Номенклатура гідроксисполук Тривіальна номенклатура (винний спирт, деревний спирт) 2. За замісниковою номенклатурою − спирти називають відповідно
- 5. За систематичною (IUPAC) номенклатурою назва спирту утворюється від назви відповідного алкану додаванням до неї закінчення -ол
- 6. Номенклатура гідроксисполук Дво-, три- і т.д. основні спирти за систематичною номенклатурою IUPAC називають відповідно до існуючих
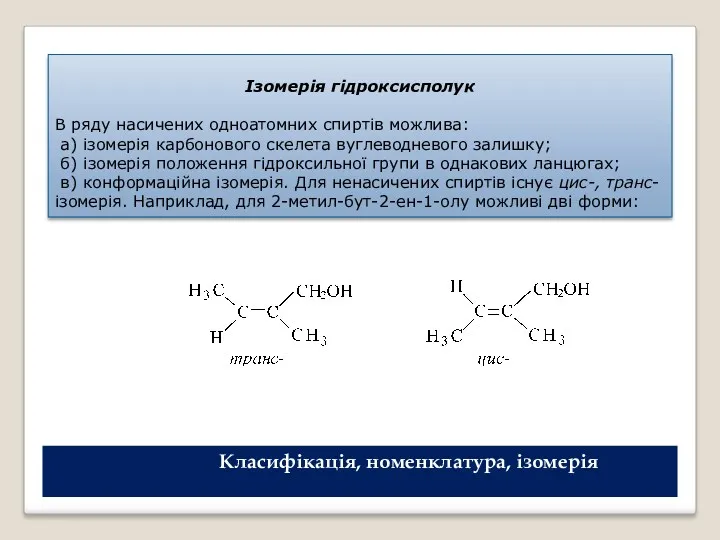
- 7. Ізомерія гідроксисполук В ряду насичених одноатомних спиртів можлива: а) ізомерія карбонового скелета вуглеводневого залишку; б) ізомерія
- 8. Методи одержання одноатомних спиртів 1. Окиснення алканів (метод має практичне застосування для промислового добування вищих насичених
- 9. Методи одержання одноатомних спиртів 4. Добування з оксосполук. а) відновлення оксосполук та естерів: Третинні спирти відновленням
- 10. Методи одержання одноатомних спиртів 5. Синтези за допомогою металоорганічних сполук (застосування реактивів Гріньяра). Ці сполуки легко
- 11. Методи одержання одноатомних спиртів З інших альдегідів утворюються вторинні спирти (реакція Вагнера): З кетонів завжди утворюються
- 12. Методи одержання одноатомних спиртів 6. Гідроліз естерів − застосовується для промислового добування високомолекулярних спиртів із восків:
- 13. Фізичні властивості спиртів У ряду одноатомних спиртів, на відміну від насичених і ненасичених вуглеводнів, немає газоподібних
- 14. Фізичні властивості спиртів За рахунок утворення водневих зв’язків між молекулами спирту і води (для нижчих гомологів)
- 15. Спирти вступають у реакції за двома основних напрямками: 1. З розривом зв’язку О−Н. 2. З розривом
- 16. Хімічні властивості одноатомних спиртів
- 17. Хімічні властивості одноатомних спиртів
- 18. Хімічні властивості одноатомних спиртів
- 19. Окремі представники, фізіологічна дія та застосування. Метанол СН3ОН – метиловий спирт, деревинний спирт. Метанол вперше був
- 20. На сьогодні найпоширеніший метод добування етанолу для харчової та фармацевтичної промисловості – бродіння цукристих речовин. За
- 22. Багатоатомними спиртами називають похідні вуглеводнів, у молекулах яких два і більше атомів Гідрогену заміщені на гідроксильні
- 23. За замісниковою номенклатурою ІЮПАК назви двох та триатомних спиртів утворюють від назви відповідного вуглеводню, додаючи суфікс
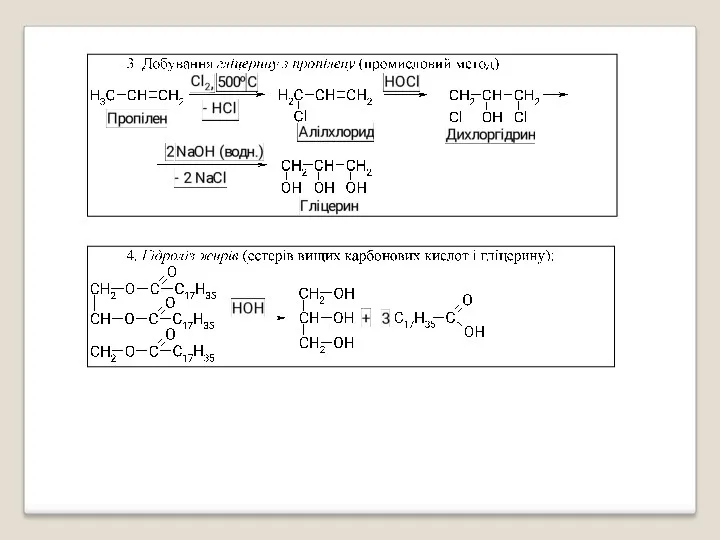
- 24. Для добування багатоатомних спиртів можуть бути застосовані ті самі методи, що і для одноатомних спиртів, але
- 26. Багатоатомні спирти - безбарвні, сиропоподібні, в’язкі рідини солодкуваті на смак, добре розчинні у воді, погано –
- 27. Багатоатомні спирти можуть виявляти всі властивості одноатомних спиртів, причому в реакції може брати участь одна або
- 28. Найбільший інтерес становлять специфічні реакції багатоатомних спиртів, зумовлені наявністю в молекулі кількох –ОН груп, їх взаємним
- 29. 2. Дегідратація етиленгліколю за Фаворським приводить до утворення циклічного етеру − діоксану: 3. Дегідратація гліцерину в
- 30. Етандіол (етиленгліколь) – безбарвна густа і дуже токсична рідина без запаху, що застосовується як пластифікатор у
- 31. Гліцерол – густа сиропоподібна рідина, солодка на смак. Вперше гліцерол виділив шведський аптекар К. Шеєле у
- 32. Нітрогліцерол (гліцеролтринітрат). Безбарвна масляниста рідина, добре розчинна в ацетоні, діетиловому етері, бензені, погано – у воді.
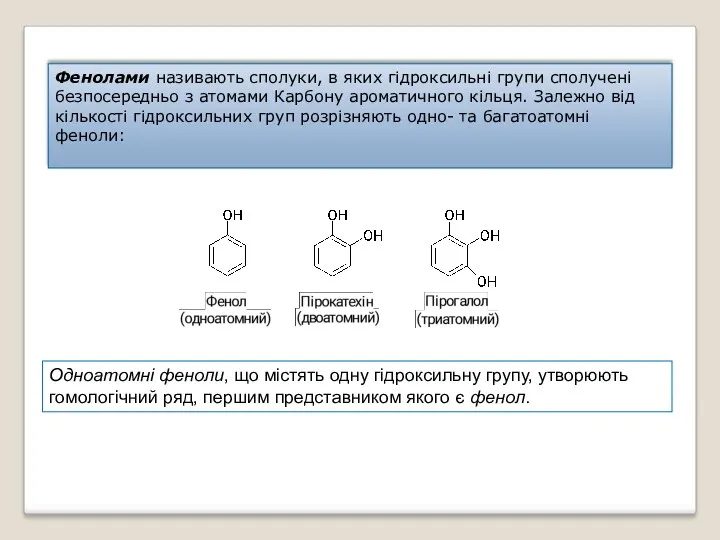
- 33. Фенолами називають сполуки, в яких гідроксильні групи сполучені безпосередньо з атомами Карбону ароматичного кільця. Залежно від
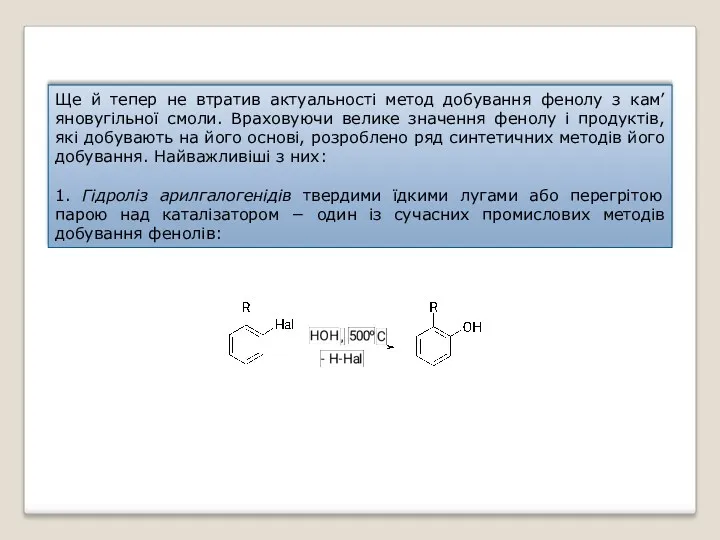
- 34. Ще й тепер не втратив актуальності метод добування фенолу з кам’яновугільної смоли. Враховуючи велике значення фенолу
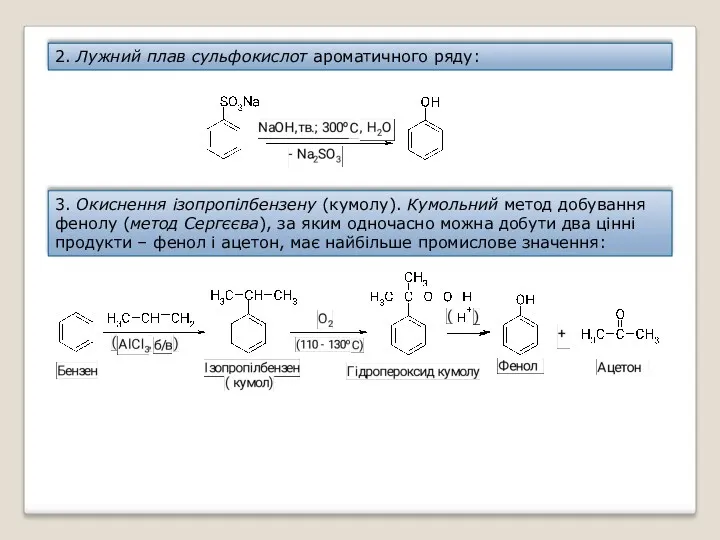
- 35. 2. Лужний плав сульфокислот ароматичного ряду: 3. Окиснення ізопропілбензену (кумолу). Кумольний метод добування фенолу (метод Сергєєва),
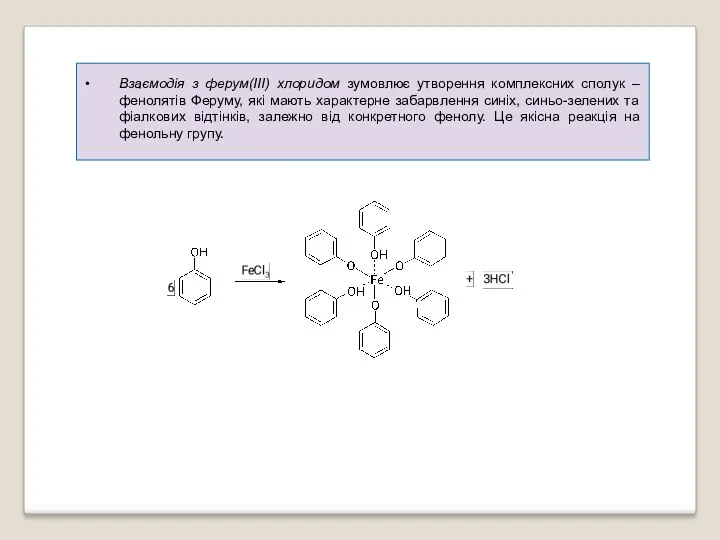
- 37. Взаємодія з ферум(ІІІ) хлоридом зумовлює утворення комплексних сполук – фенолятів Феруму, які мають характерне забарвлення синіх,
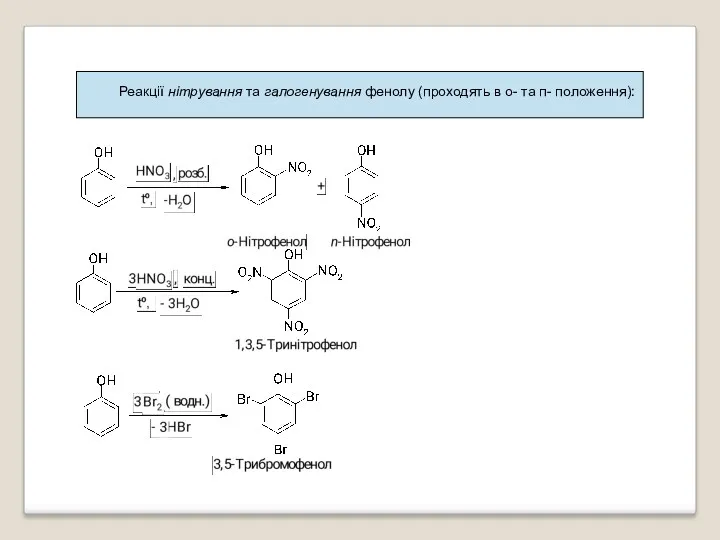
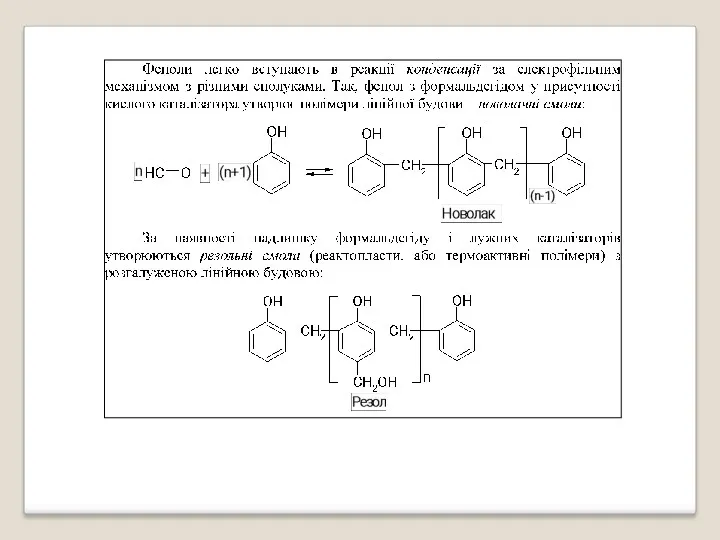
- 38. Реакції нітрування та галогенування фенолу (проходять в о- та п- положення):
- 41. Скачать презентацию





























 Предмет органической химии
Предмет органической химии Сульфур. Характеристика елемента та утворених ним сполук, кругообіг елемента в природі
Сульфур. Характеристика елемента та утворених ним сполук, кругообіг елемента в природі Исследование модифицирования на структуру и жидкотекучесть сплава АК12
Исследование модифицирования на структуру и жидкотекучесть сплава АК12 Теорія хімічної будови органічних сполук О.М. Бутлерова. Теорія, як вища форма наукових знань
Теорія хімічної будови органічних сполук О.М. Бутлерова. Теорія, як вища форма наукових знань Первичная структура белков и пептидов
Первичная структура белков и пептидов Реакции ионного обмена. Теория химического строения органических соединений. 9 класс
Реакции ионного обмена. Теория химического строения органических соединений. 9 класс Моющие средства
Моющие средства Приготування розчинів
Приготування розчинів Реакции деструкции макромолекул
Реакции деструкции макромолекул Альдегиды и кетоны
Альдегиды и кетоны Диаграммы фазового равновесия. Правило фаз
Диаграммы фазового равновесия. Правило фаз Основания - свойства ТЭД
Основания - свойства ТЭД Радиоактивное загрязнение. Йод
Радиоактивное загрязнение. Йод Металдар мен бейметалдардың салыстырмалы сипаттамасы
Металдар мен бейметалдардың салыстырмалы сипаттамасы Чипсы. Польза или вред?
Чипсы. Польза или вред? Сарқынды сулардан ренийді бөлу әдісі. құмда мысты қайта өңдеу
Сарқынды сулардан ренийді бөлу әдісі. құмда мысты қайта өңдеу Технология лаков и красок
Технология лаков и красок Методы определения вязкости жидкости
Методы определения вязкости жидкости 20231110_zakon_avogadro
20231110_zakon_avogadro Карбоновые кислоты. Строение, гомологический ряд, изомерия и номенклатура
Карбоновые кислоты. Строение, гомологический ряд, изомерия и номенклатура Гидросульфит натрия (пищевая добавка Е222)
Гидросульфит натрия (пищевая добавка Е222) Соединения фосфора: оксид фосфора (V). Ортофосфорная кислота и ее соли
Соединения фосфора: оксид фосфора (V). Ортофосфорная кислота и ее соли Пищевые добавки
Пищевые добавки Коллигативные свойства растворов
Коллигативные свойства растворов кислоты
кислоты Органические вещества. Валентность. Теория химического строения
Органические вещества. Валентность. Теория химического строения Ионная химическая связь
Ионная химическая связь Методи добування у промисловості
Методи добування у промисловості