Содержание
- 2. Теория химического строения органических соединений Урок 9 класса. Реакции ионного обмена. Качественные реакции. Степень окисления
- 3. 5 28.09.2016 Барий и сульфат-ион Ba2+ + SO4 -2 → BaSO4↓ качественная реакция на соли бария;
- 4. Алюминий, цинк, фосфат-ион Al3+ + 3OH— = Al(OH)3↓ Zn2+ + 2OH— = Zn(OH)2↓ избыток щелочи: Al(OH)3
- 5. Цвет пламени Многие щелочные и щелочно-земельные металлы не имеют нерастворимых солей. Поэтому их определяют по цвету
- 6. Реакции ионного обмена Реакции протекающие в растворе между электролитами, называются реакциями ионного обмена. Реакции ионного обмена
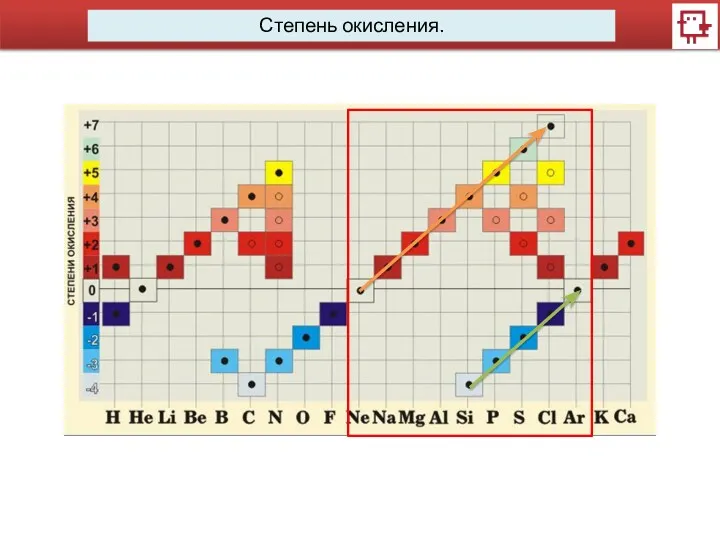
- 7. Степень окисления. Степень окисления –условный заряд атома в молекуле, вычисленный в предположении, что все связи имеют
- 8. Степень окисления. Cu0 Cu+2O-2 Cu+12O-2 Cu+1(O-2H+1) Cu+2(O-2H+1)2
- 9. Степень окисления. Определим степени окисления: Li Li2O Li(OH)
- 10. Степень окисления. Определим степени окисления: Li Li2O Li(OH) степень окисления определяет число электронов, смещенных от атома
- 11. Степень окисления.
- 13. Скачать презентацию









 Основи. Гідроксиди Натрію і Кальцію
Основи. Гідроксиди Натрію і Кальцію Метал конструкциялық материалдар
Метал конструкциялық материалдар Nucleic acids
Nucleic acids Курс Материаловедение. Введение
Курс Материаловедение. Введение Основные электрохимические процессы
Основные электрохимические процессы Изомерия. Виды изомерии
Изомерия. Виды изомерии Кислород, азот, водород и инертные газы. Раздел 3
Кислород, азот, водород и инертные газы. Раздел 3 Скорость химических реакций. Факторы, влияющие на скорость химической реакции
Скорость химических реакций. Факторы, влияющие на скорость химической реакции Стирка по научному
Стирка по научному Гальваникалық элементтер
Гальваникалық элементтер Выращивание кристалла медного купороса CuSO4*5Н2О в разных условиях
Выращивание кристалла медного купороса CuSO4*5Н2О в разных условиях Stirring in liquid media
Stirring in liquid media Химические реакции
Химические реакции Лабораторные исследования состава и физико-химических свойств нефти
Лабораторные исследования состава и физико-химических свойств нефти Физические и химические свойства воды
Физические и химические свойства воды Белки. 9 класс
Белки. 9 класс Количественный анализ. Титриметрический анализ
Количественный анализ. Титриметрический анализ Кристалічні ґратки. Залежність фізичних властивостей речовини від типів кристалічних ґраток
Кристалічні ґратки. Залежність фізичних властивостей речовини від типів кристалічних ґраток Галогены (солеобразующие)
Галогены (солеобразующие) Цветные маталлы и сплавы
Цветные маталлы и сплавы Стратегия органического синтеза
Стратегия органического синтеза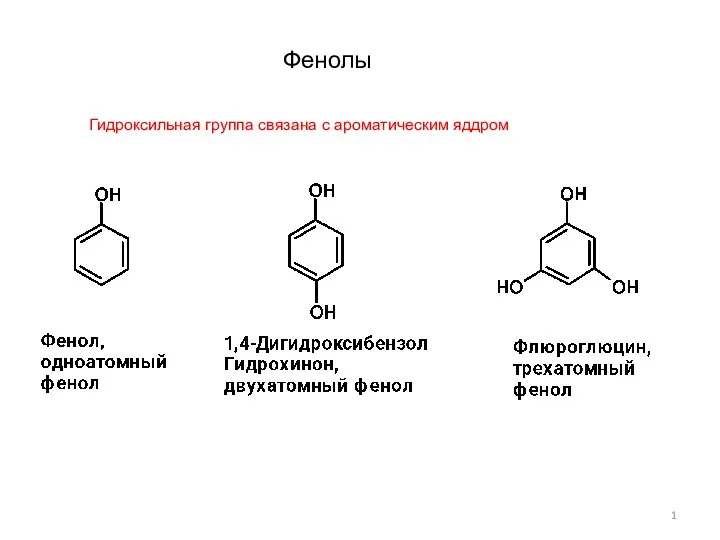 Фенолы-1
Фенолы-1 Курс коллоидной химии
Курс коллоидной химии Амины
Амины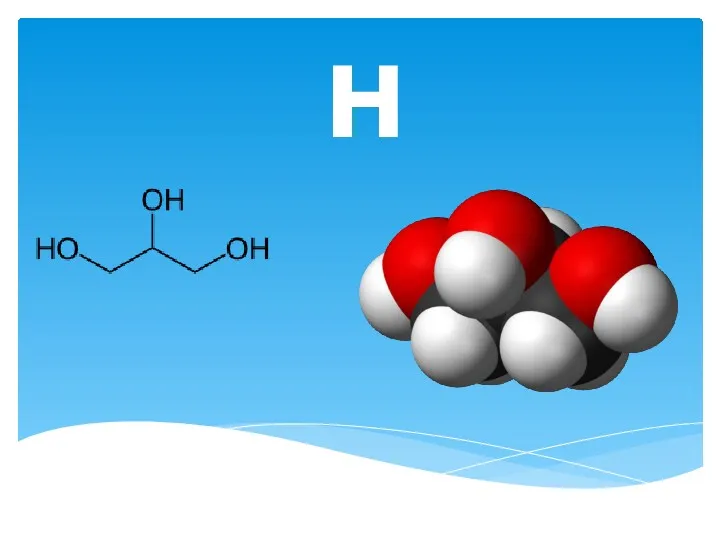 Глицерин. Основные способы получения
Глицерин. Основные способы получения Реакции ионного обмена. Ионное произведение воды. Водородный показатель. Индикаторы
Реакции ионного обмена. Ионное произведение воды. Водородный показатель. Индикаторы Строение и свойства циклоалканов
Строение и свойства циклоалканов Кислотно-основное титрование
Кислотно-основное титрование