Содержание
- 2. Два физико-химических параметра, характеризующие дисперсные системы: 1. сгущение (избыток) свободной энергии на границах раздела фаз 2.
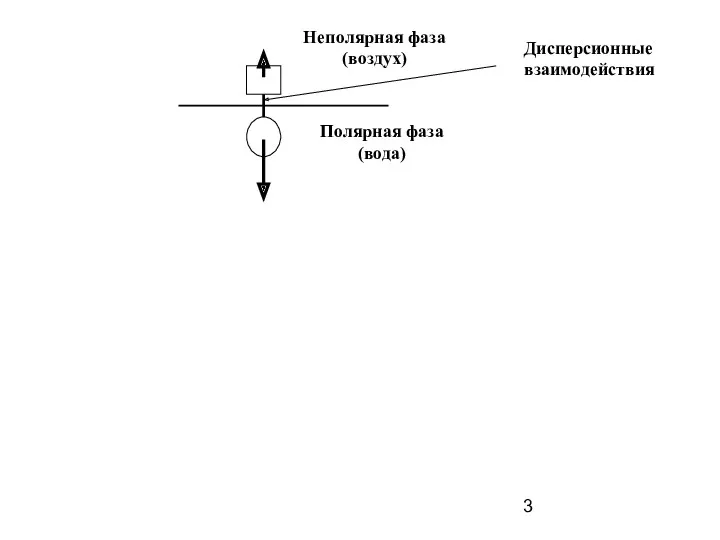
- 3. Неполярная фаза (воздух) Полярная фаза (вода) Дисперсионные взаимодействия
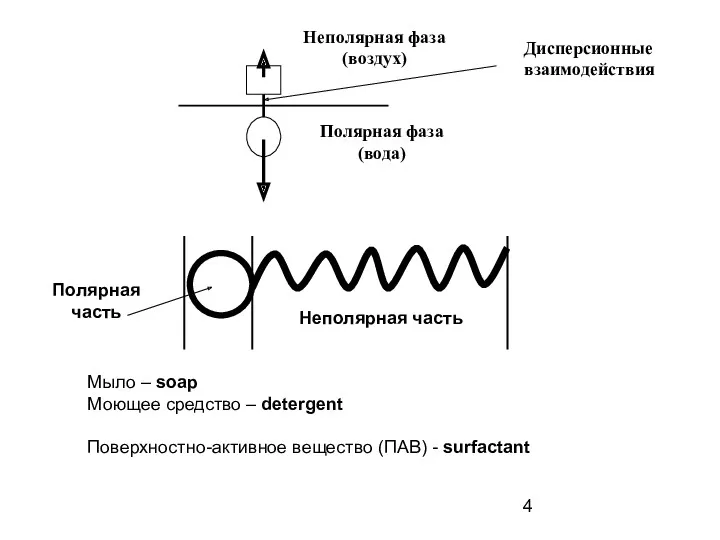
- 4. Неполярная фаза (воздух) Полярная фаза (вода) Дисперсионные взаимодействия Полярная часть Неполярная часть Мыло – soap Моющее
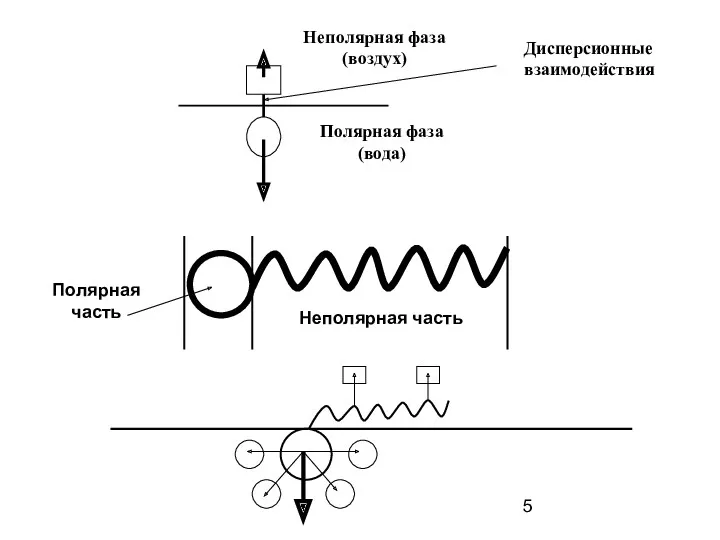
- 5. Неполярная фаза (воздух) Полярная фаза (вода) Дисперсионные взаимодействия Полярная часть Неполярная часть
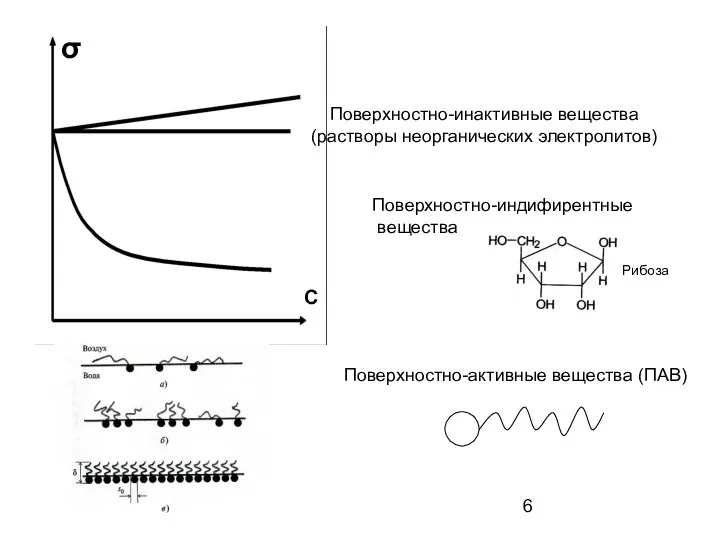
- 6. Поверхностно-инактивные вещества (растворы неорганических электролитов) Поверхностно-индифирентные вещества Поверхностно-активные вещества (ПАВ) σ С Рибоза
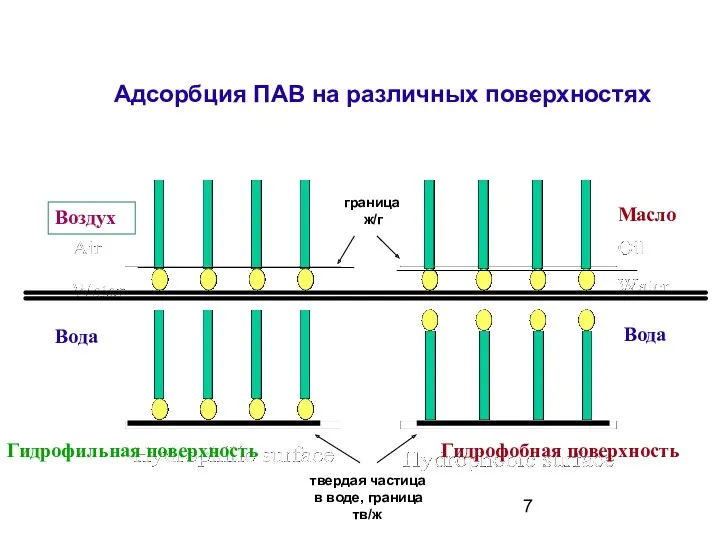
- 7. Адсорбция ПАВ на различных поверхностях Вода Вода Гидрофильная поверхность Гидрофобная поверхность __________________ ____________________ Воздух Масло граница
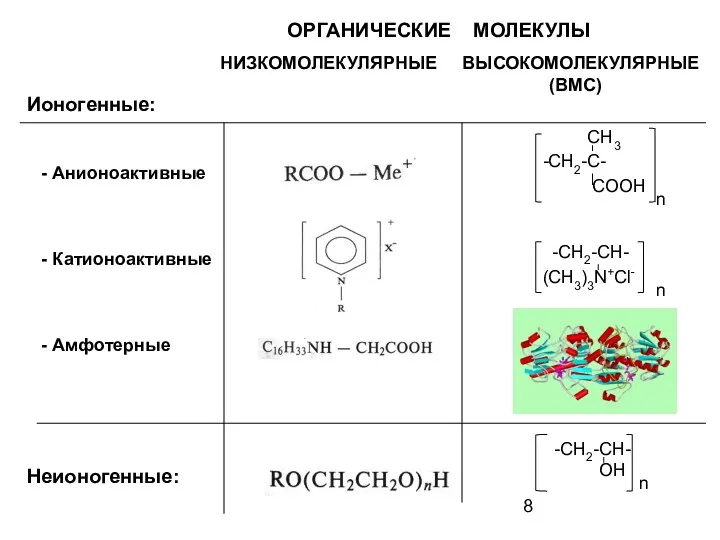
- 8. ОРГАНИЧЕСКИЕ МОЛЕКУЛЫ НИЗКОМОЛЕКУЛЯРНЫЕ ВЫСОКОМОЛЕКУЛЯРНЫЕ (ВМС) CH3 -CH2-C- COOH -CH2-CH- (CH3)3N+Cl- -CH2-CH- OH Ионогенные: - Анионоактивные -
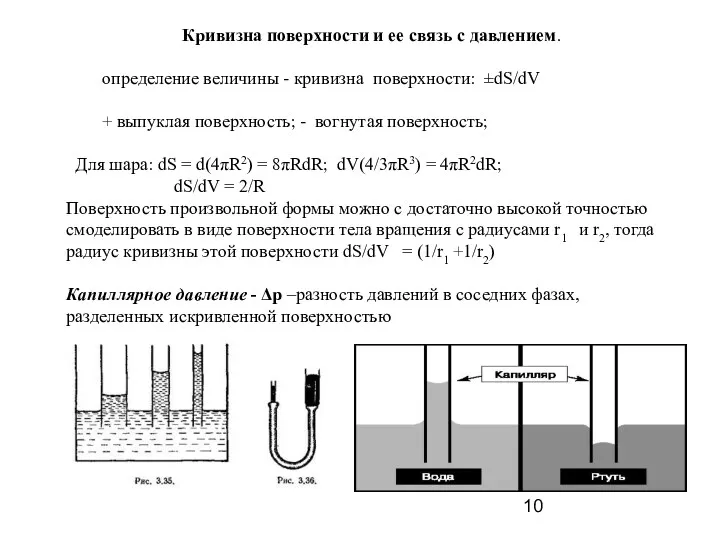
- 9. Кривизна границы раздела фаз является причиной возникновения капиллярных явлений. Капиллярные явления. Уравнение Лапласа для сферических поверхностей,
- 10. Кривизна поверхности и ее связь с давлением. определение величины - кривизна поверхности: ±dS/dV + выпуклая поверхность;
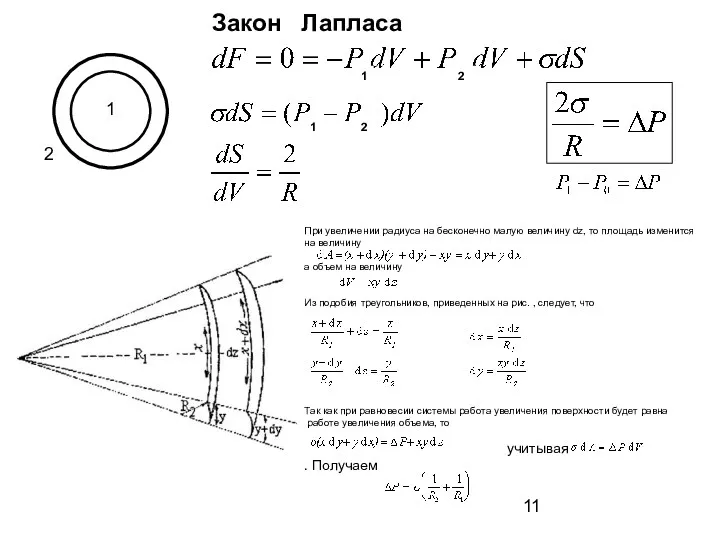
- 11. 1 2 Закон Лапласа При увеличении радиуса на бесконечно малую величину dz, то площадь изменится на
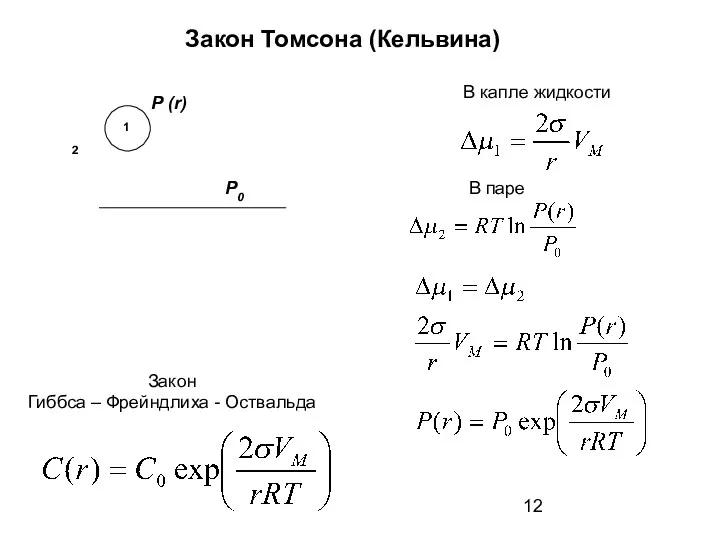
- 12. Закон Томсона (Кельвина) Закон Гиббса – Фрейндлиха - Оствальда P (r) P0 В капле жидкости В
- 13. Изотермическая перегонка вещества – перенос вещества в дисперсных системах от малых частиц к более крупным. Во
- 14. Диспергирование горячей воды при низких температурах воздуха
- 15. Формула Жюрена - высоты поднятия жидкости в капилляре: h = 2σ/(R ∙ ρ ∙ g) Подъем
- 16. Зависимость формы капли от соотношения радиуса капли (R) и капиллярной постоянной воды (а): R > а
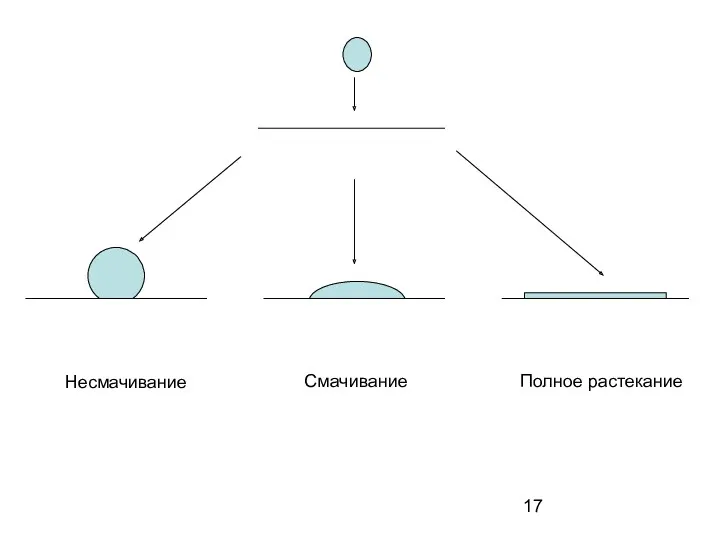
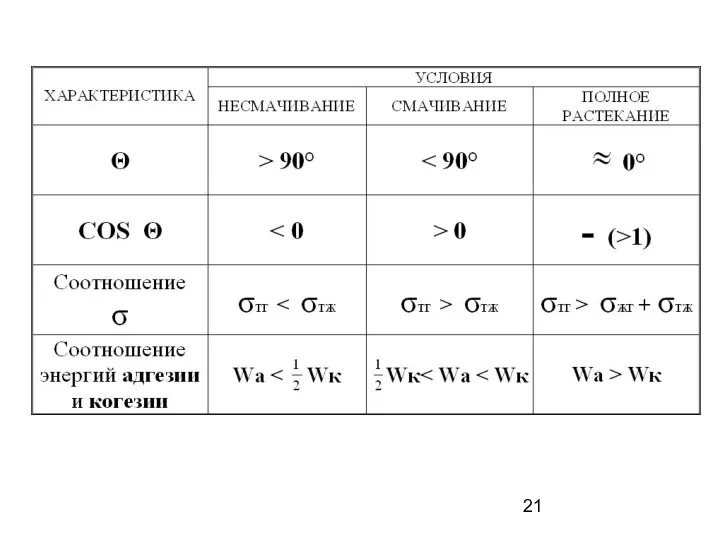
- 17. Несмачивание Смачивание Полное растекание
- 18. Смачивание твердых тел Смачивание. Краевой угол смачивания. Уравнение Юнга. Смачивание водой и углеводородами полярных и неполярных
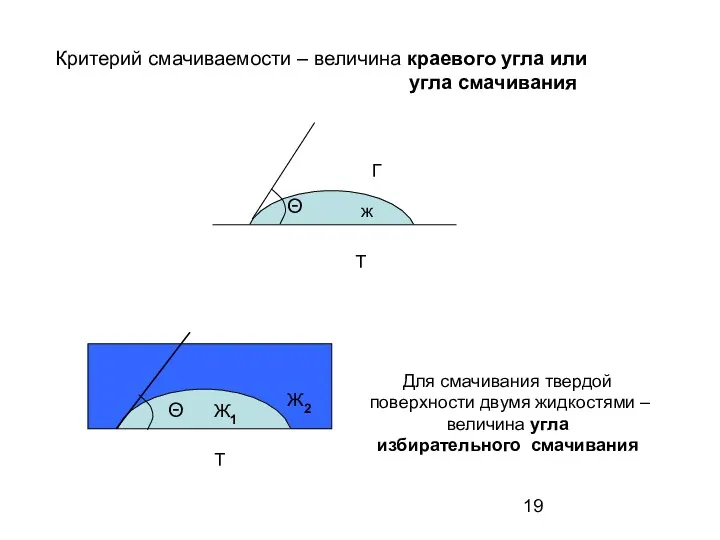
- 19. Критерий смачиваемости – величина краевого угла или угла смачивания Θ ж Т Г Θ Т Ж1
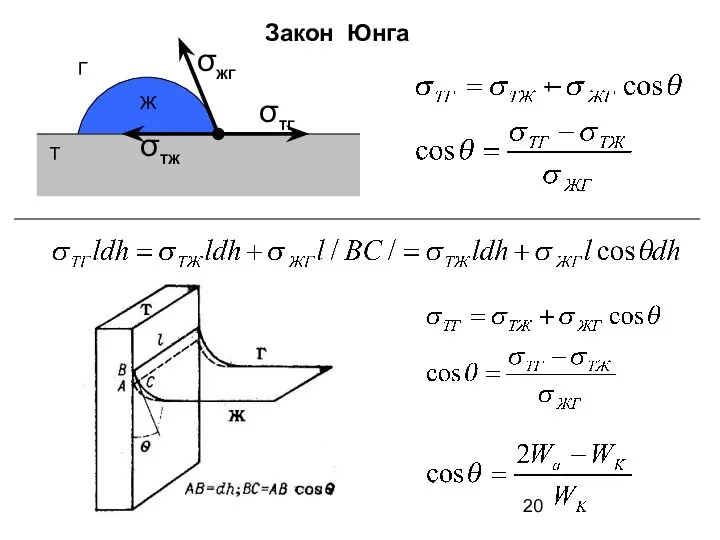
- 20. Закон Юнга σТЖ σТГ σЖГ Т Г Ж +
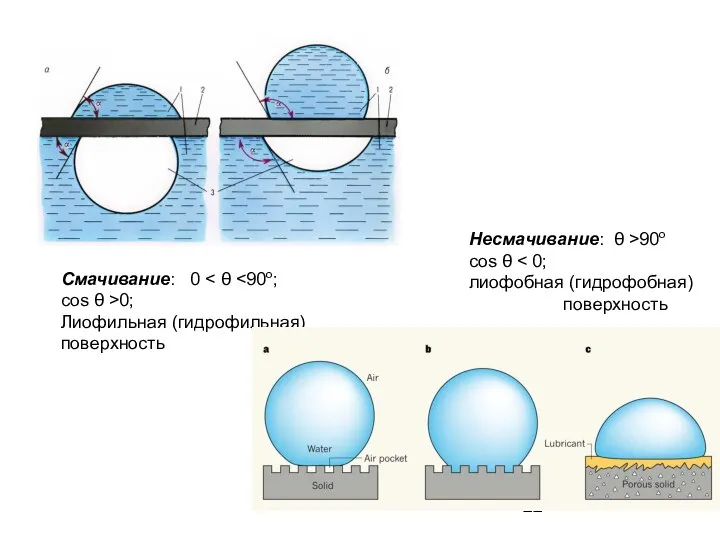
- 22. Смачивание: 0 cos θ >0; Лиофильная (гидрофильная) поверхность Несмачивание: θ >90o cos θ лиофобная (гидрофобная) поверхность
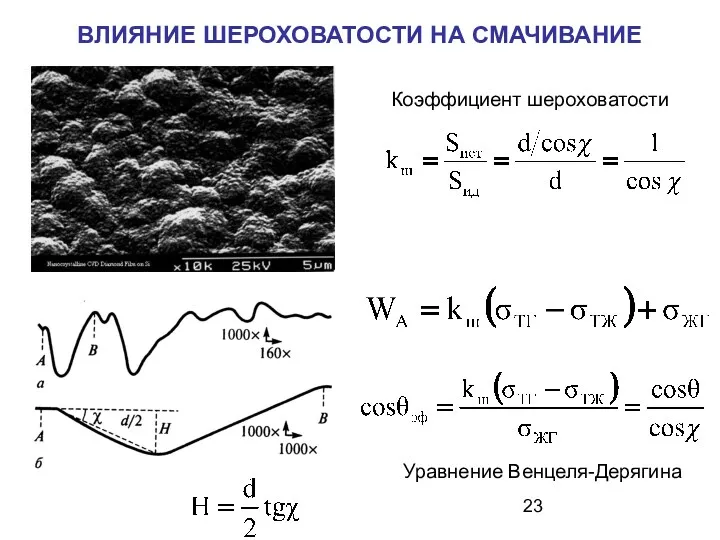
- 23. ВЛИЯНИЕ ШЕРОХОВАТОСТИ НА СМАЧИВАНИЕ Коэффициент шероховатости Уравнение Венцеля-Дерягина
- 24. Смачивание поверхности одной жидкость (с большей плотностью) другой жидкостью с меньшей плотностью уравнение Неймана Растекание происходит
- 25. Уравнение Дюпре (определение работы адгезии жидкости к твердой поверхности Wа): Знаем определения : WК= 2σ Wа
- 26. Методы определения удельной свободной поверхностной энергии легкоподвижных границ раздела фаз (энергетически однородных) и границ твердых тел
- 27. Формула Жюрена для высоты поднятия жидкости в капилляре: h = 2σ cosθ/ (ρ۰g·ro ) Метод капиллярного
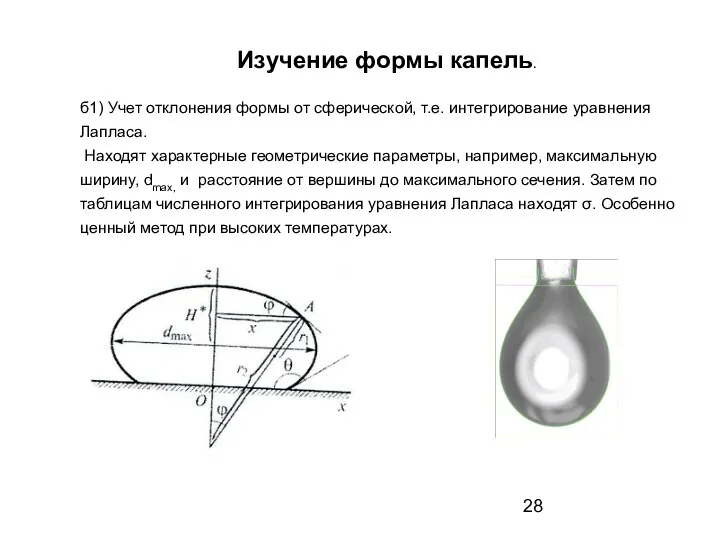
- 28. Изучение формы капель. б1) Учет отклонения формы от сферической, т.е. интегрирование уравнения Лапласа. Находят характерные геометрические
- 29. Метод «вращающейся капли» Капля жидкости плотностью ρ1 помещается в трубку с более тяжелой (плотность ρ2) жидкостью.
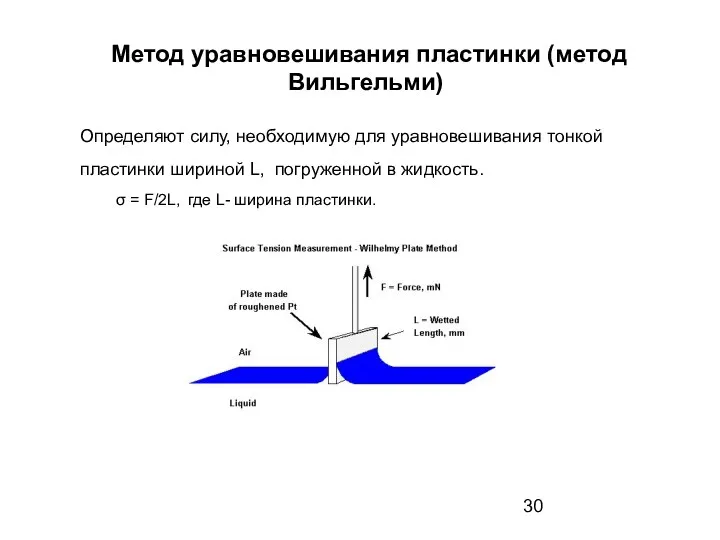
- 30. Метод уравновешивания пластинки (метод Вильгельми) Определяют силу, необходимую для уравновешивания тонкой пластинки шириной L, погруженной в
- 31. Полустатические методы Изучаются условия, при которых система теряет равновесие: Метод наибольшего давления, необходимого для образования в
- 32. считается одним из наиболее точных. Он основан на измерении силы F, необходимой для отрыва от поверхности
- 33. Сталагмометрический метод. Простейшая теория сталагмометрического метода подразумевает, что капля жидкости отрывается от кончика капилляра (трубки), когда
- 34. Динамические методы Применяются, в основном, для изучения неравновесных состояний поверхностей жидкости и скоростей установления равновесных структур
- 35. Метод капиллярных волн Основан на зависимости скорости u распространения волн по поверхности жидкости от ее натяжения:
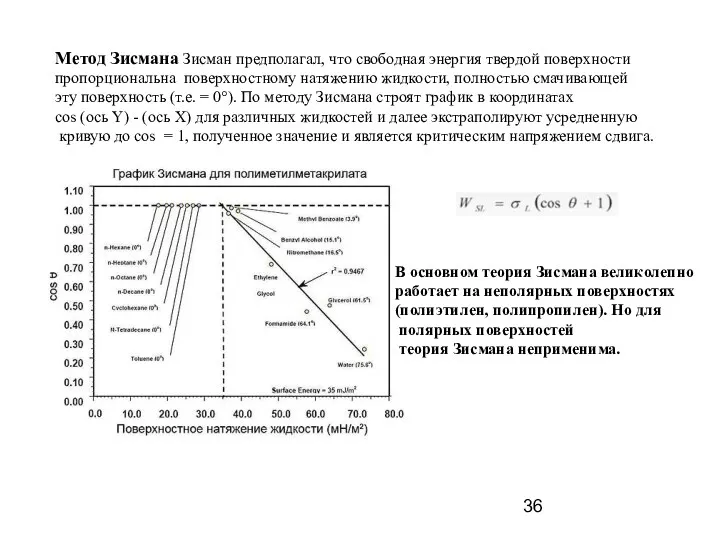
- 36. Метод Зисмана Зисман предполагал, что свободная энергия твердой поверхности пропорциональна поверхностному натяжению жидкости, полностью смачивающей эту
- 38. Скачать презентацию

















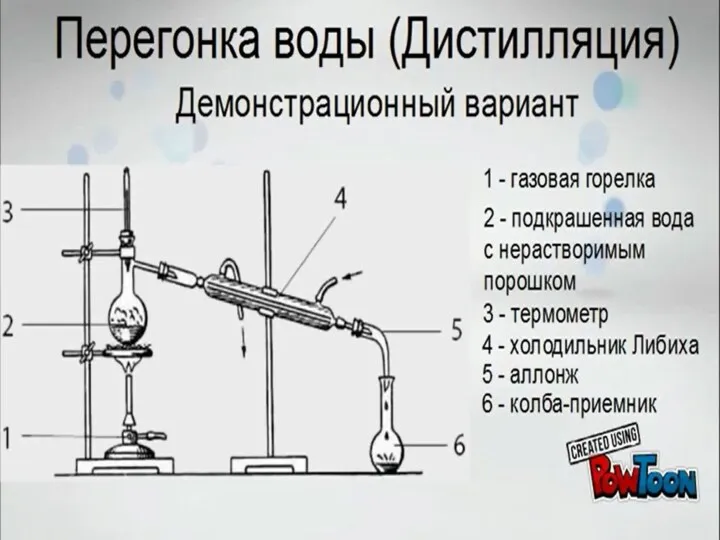 Перегонка воды (дистилляция). Демонстрационный вариант
Перегонка воды (дистилляция). Демонстрационный вариант XXI ғасыр көшбасшысы
XXI ғасыр көшбасшысы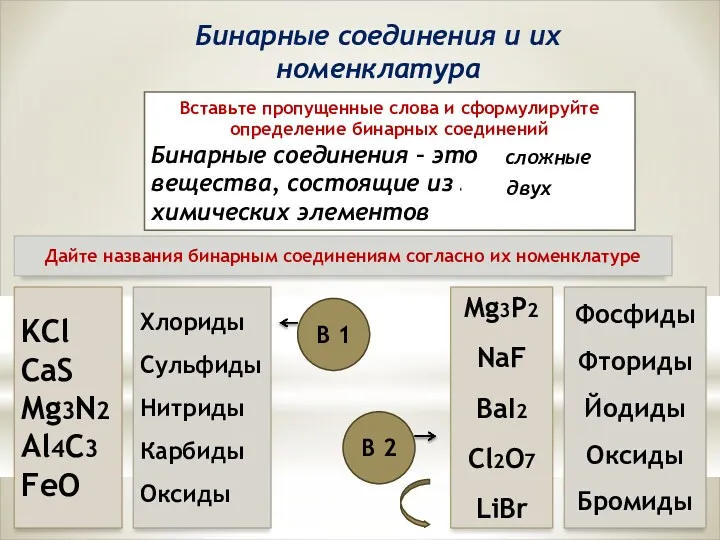 Бинарные соединения и их номенклатура
Бинарные соединения и их номенклатура Поверхностный мембранный потенциал. Равновесие Доннана
Поверхностный мембранный потенциал. Равновесие Доннана Получение и применение спиртов
Получение и применение спиртов Природные источники углеводородов
Природные источники углеводородов Озон
Озон Галогены. Хлор
Галогены. Хлор Химия. Интересные факты. Как Менделеев открыл периодический закон?
Химия. Интересные факты. Как Менделеев открыл периодический закон? Хлороводород..Соляная кислота
Хлороводород..Соляная кислота Химия в быту
Химия в быту Растворы. (Лекция 7)
Растворы. (Лекция 7)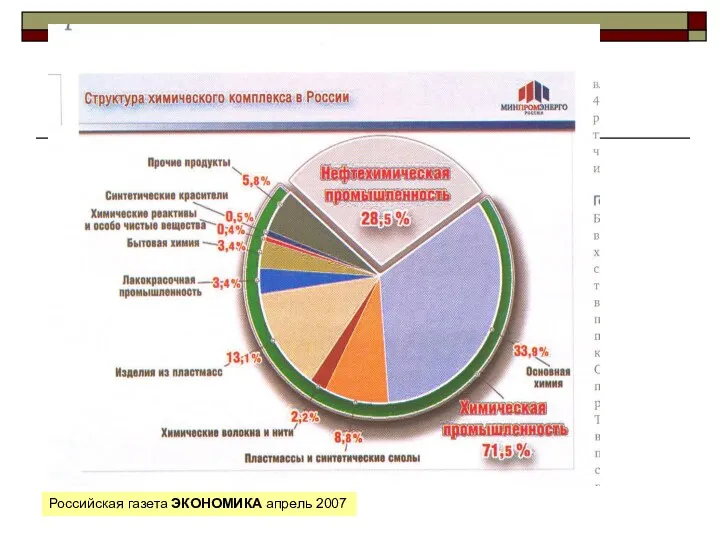 Свойства и классификация нефти
Свойства и классификация нефти Сағыз пайдалы ма, әлде зиян ба?
Сағыз пайдалы ма, әлде зиян ба? Трифенилметановые красители
Трифенилметановые красители Основания. Химические свойства оснований. Сильные и слабые основания
Основания. Химические свойства оснований. Сильные и слабые основания Карбон қышқылдары, жіктелуі, сипаттамалары, таралуы
Карбон қышқылдары, жіктелуі, сипаттамалары, таралуы Химическая связь
Химическая связь Углерод и его соединения. 11 класс
Углерод и его соединения. 11 класс Сложные эфиры. Жиры
Сложные эфиры. Жиры Непредельные углеводороды: этилен
Непредельные углеводороды: этилен Викторина Своя игра. Периодический закон и периодическая система химических элементов Д.И. Менделеева
Викторина Своя игра. Периодический закон и периодическая система химических элементов Д.И. Менделеева Кислород и озон
Кислород и озон Нуклеопротеины
Нуклеопротеины Металлы и сплавы
Металлы и сплавы Сырьевая база парфюмерно-косметической промышленности
Сырьевая база парфюмерно-косметической промышленности 21. Кислоты. Определение кислот
21. Кислоты. Определение кислот Алкены. Общая характеристика, гомологический ряд, номенклатура, изомерия. Методы синтеза алкенов. Лекция 3
Алкены. Общая характеристика, гомологический ряд, номенклатура, изомерия. Методы синтеза алкенов. Лекция 3