Содержание
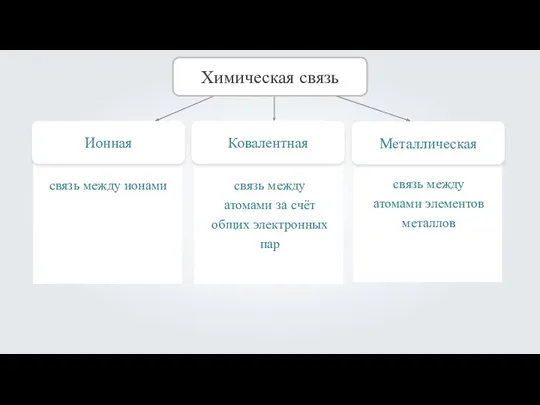
- 2. Ионная Химическая связь Ковалентная Металлическая
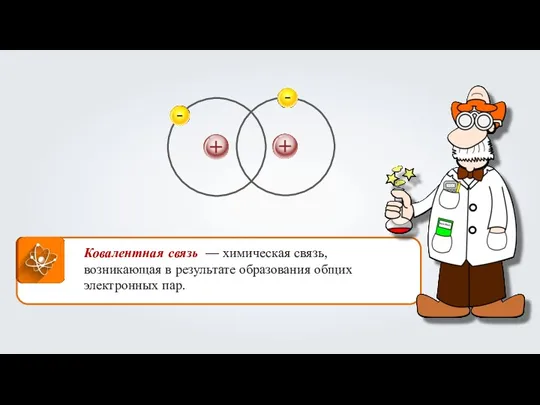
- 3. Ковалентная связь — химическая связь, возникающая в результате образования общих электронных пар.
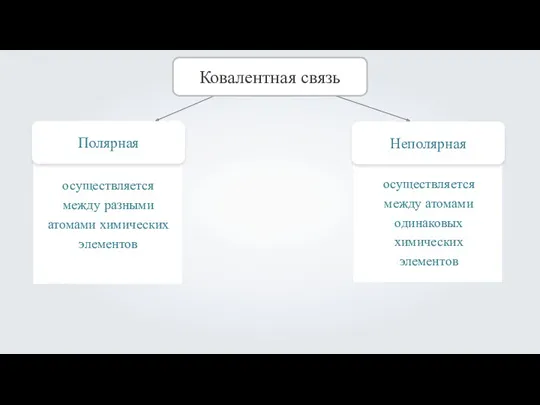
- 4. Полярная Ковалентная связь Неполярная
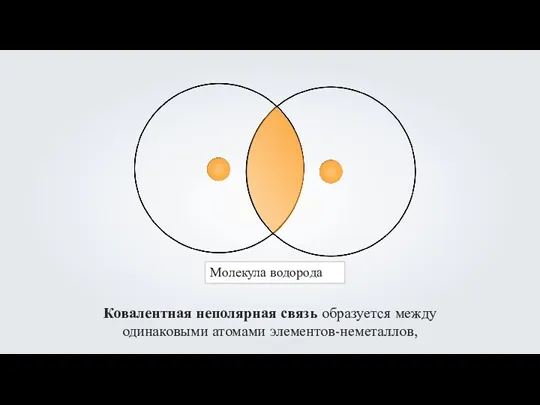
- 5. Молекула водорода Ковалентная неполярная связь образуется между одинаковыми атомами элементов-неметаллов,
- 6. Полярная ковалентная связь может образовываться только между атомами разных элементов-неметаллов. фтороводород НF
- 7. Молекула фторводорода H1 1S1 F9 1S2 / 2S2 2p5 H F Неспаренный электрон Неспаренный электрон
- 8. H F + → H F
- 9. Электроотрицательность — это способность атомов химического элемента смещать к себе общие электронные пары, участвующие в образовании
- 10. F→ O→ N → CI → Br → I → S → C → Si →P
- 11. H F + → H F F→ O→ N → CI → Br → I →
- 12. H F + → H F + - Частичный заряд, приобретаемый атомами, обозначается латинской буквой «дельта»
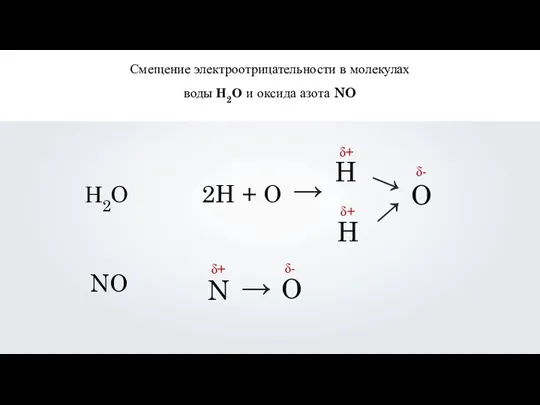
- 13. Смещение электроотрицательности в молекулах воды Н2О и оксида азота NO Н2О NO 2H + O →
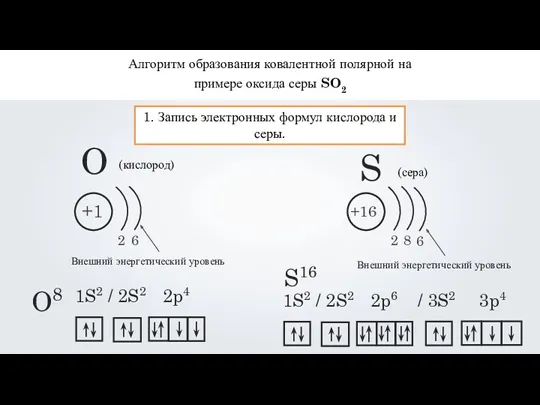
- 14. Алгоритм образования ковалентной полярной на примере оксида серы SO2 1. Запись электронных формул кислорода и серы.
- 15. Алгоритм образования ковалентной полярной на примере оксида серы SO2 2. Изображение расположения внешних электронов у знаков
- 16. Алгоритм образования ковалентной полярной на примере оксида серы SO2 3. Запись электронно-структурной формулы образовавшейся молекулы оксида
- 17. Алгоритм образования ковалентной полярной на примере оксида серы SO2 3. Определение по рассмотренному нами ранее химическому
- 18. Валентность — это число ковалентных связей, которыми атом одного химического элемента связан с атомами этого же
- 19. Аммиак NH3 NIIIHI Вода H2O HIOII Оксид фосфора P2O5 PVOII Запись валентности
- 20. Если валентность обоих элементов кратна какому-нибудь числу, то индексы записываются, уменьшенными на это число. SO3 S2O6
- 21. Al III S II S VI S IV
- 22. По формуле также можно определить валентность одного элемента, если валентность другого известна. SO2 II ? 4
- 24. Скачать презентацию


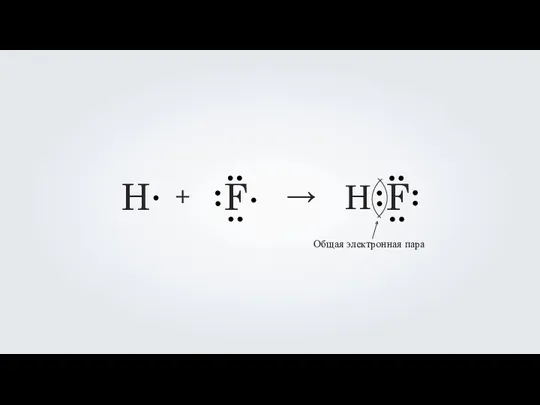


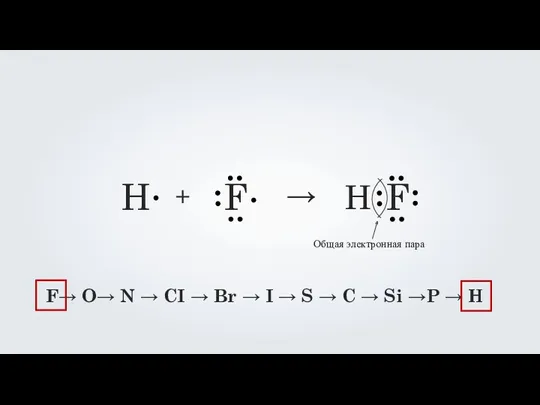









 Минералогия литофильных редких элементов. Цезий и рубидий
Минералогия литофильных редких элементов. Цезий и рубидий Главная подгруппа VIII группы периодической системы. Девятнадцатая лекция
Главная подгруппа VIII группы периодической системы. Девятнадцатая лекция d-элементы
d-элементы Изучение раздела Углеводороды в курсе органической химии в старшей школе
Изучение раздела Углеводороды в курсе органической химии в старшей школе Понятие об алкинах
Понятие об алкинах Азотная кислота и нитраты
Азотная кислота и нитраты Brass
Brass Никель қаптамаларын алу жолдары
Никель қаптамаларын алу жолдары Первая группа периодической системы Менделеева. Щелочные металлы
Первая группа периодической системы Менделеева. Щелочные металлы Маркировка пластиковой посуды
Маркировка пластиковой посуды Номенклатура органических веществ
Номенклатура органических веществ Окисно-відновні реакції. Процеси окиснення, відновлення, окисник та відновник
Окисно-відновні реакції. Процеси окиснення, відновлення, окисник та відновник Обобщающий урок по теме Металлы
Обобщающий урок по теме Металлы Галогены
Галогены Гидроксикислоты (оксикислоты)
Гидроксикислоты (оксикислоты) Растворы электролитов
Растворы электролитов Бытовая химия
Бытовая химия Полимеры. Каучук
Полимеры. Каучук Металлы. Свойства металлов
Металлы. Свойства металлов Кислород
Кислород Горение топлива
Горение топлива Химия и искусство
Химия и искусство 20230419_oksidy
20230419_oksidy Железо. Характеристика химического элемента железа по его положению в ПСХЭ и строению атома
Железо. Характеристика химического элемента железа по его положению в ПСХЭ и строению атома Металлы в природе. Общие способы их получения
Металлы в природе. Общие способы их получения Высокомолекулярные соединения и супрамолекулярные структуры. (Лекция 3)
Высокомолекулярные соединения и супрамолекулярные структуры. (Лекция 3) Аллотропия. Аллотропные модификации
Аллотропия. Аллотропные модификации Получение и химические свойства оснований
Получение и химические свойства оснований