Содержание
- 2. Главная подгруппа VIII группы периодической системы
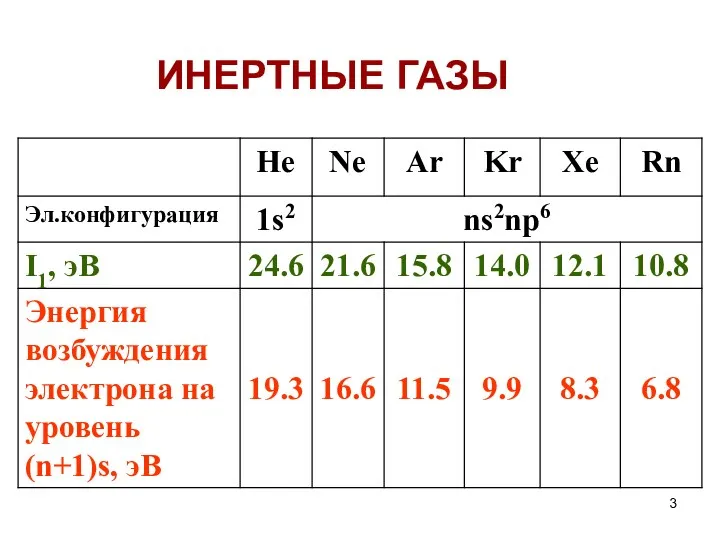
- 3. ИНЕРТНЫЕ ГАЗЫ
- 4. Значения I1 слишком велики, чтобы затраты энергии на образование катиона Э+ были компенсированы энергией, выделяющейся при
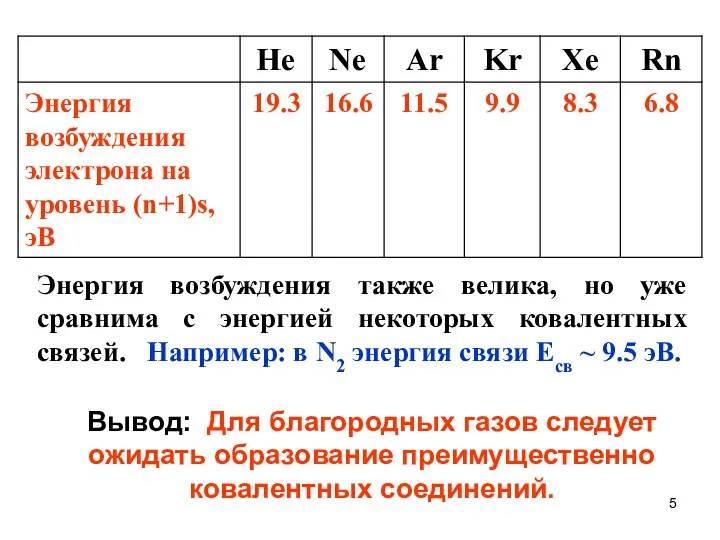
- 5. Энергия возбуждения также велика, но уже сравнима с энергией некоторых ковалентных связей. Например: в N2 энергия
- 6. Нахождение элементов в природе
- 7. В небольших количествах инертные газы присутствуют в природных горючих газах , в горных породах, в растворённом
- 8. В природе инертные газы образуются в результате различных ядерных реакций. Часть инертных газов имеет космогенное происхождение.
- 9. Химия ИНЕРТНЫХ газов
- 10. Соединения включения – клатраты (clatratus - греч. закрытый решеткой) Построены по принципу гость - хозяин. Хозяин
- 11. КЛАТРАТЫ При кристаллизации "хозяина" в атмосфере "гостя" последний занимает эти полости, образуя соединение включения, атомы гостя
- 12. КЛАТРАТЫ Первые клатраты были получены в 1896 г. французским ученым Вийяром. Замораживая воду в присутствии Ar,
- 13. Клатрат гидрохинона с ксеноном
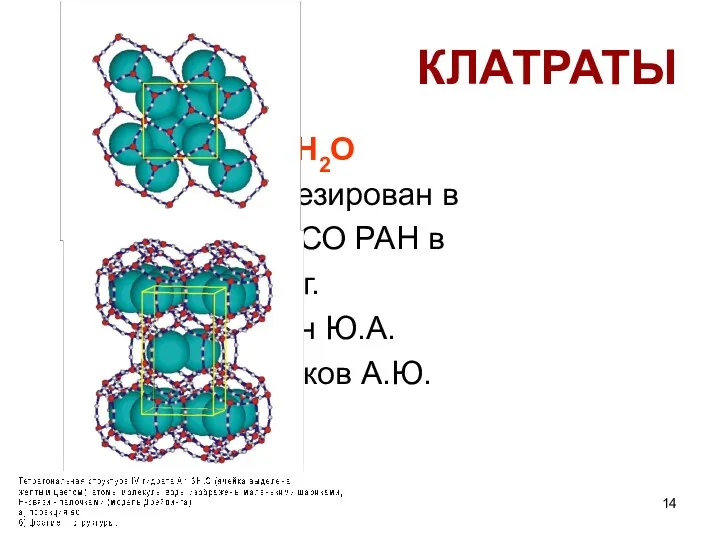
- 14. КЛАТРАТЫ Ar●3H2O Синтезирован в ИНХ СО РАН в 1999 г. Дядин Ю.А. Манаков А.Ю.
- 15. Способность инертных газов к образованию химических соединений открыта сравнительно недавно. В настоящее время лучше изучена химия
- 16. Соединения ксенона Ксенон - первый разрушил миф о химической инертности благородных газов. Первые соединения получены Нилом
- 17. Изучая реакцию O2 + PtF6 Бартлетт установил, что в ней образуется соль катиона диоксигенила O2+: O2
- 18. Далее он обратил внимание на то, что потенциал ионизации дикислорода и ксенона очень близки по значению:
- 19. Позднее были уточнены строение и состав этой соли. на самом деле (в соответствии с нашим начальным
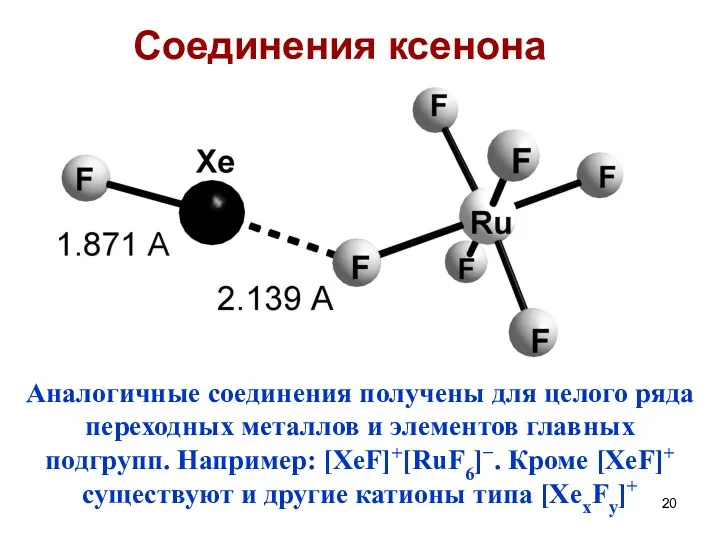
- 20. Аналогичные соединения получены для целого ряда переходных металлов и элементов главных подгрупп. Например: [XeF]+[RuF6]−. Кроме [XeF]+
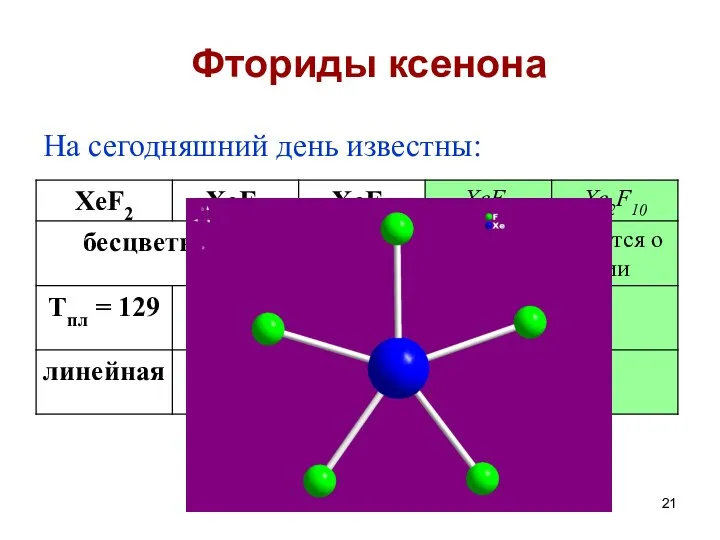
- 21. Фториды ксенона На сегодняшний день известны:
- 22. Xe + F2 = XeF2 (смесь Xe/F2 - 1:2, hν, 25 оС) Xe + 2F2 =
- 23. Химические свойства фторидов ксенона Окислительные свойства: сильные окислители XeF2(aq) + 2H+ + 2e = Xe +
- 24. Растворимость в воде при 0 оС - 0.15 М. Медленно гидролизуется в воде и кислой среде.
- 25. чрезвычайно чувствителен даже к следам воды (например, в воздухе), требуется тщательная защита), гидролиз сопровождается диспропорционированием: 4XeF4
- 26. также очень чувствителен к влаге, но гидролизуется ступенчато без изменения степени окисления: XeF6 + H2O →
- 27. Это метод получения кислородных соединений. Эксплуатируется высокое сродство кремния к фтору: 2XeF6 + SiO2 → 2XeOF4
- 28. XeF2 + 2 SbF5 → [XeF]+[Sb2F11]− XeF4 + BiF5 → [XeF]+[BiF6]− XeF6 + RuF5 → [XeF]+[RuF6]−
- 29. Комплексообразование XeF6 + CsF → Cs[XeF7] - бесцв. крист., разлагаются при ~ 50 оС XeF6 +
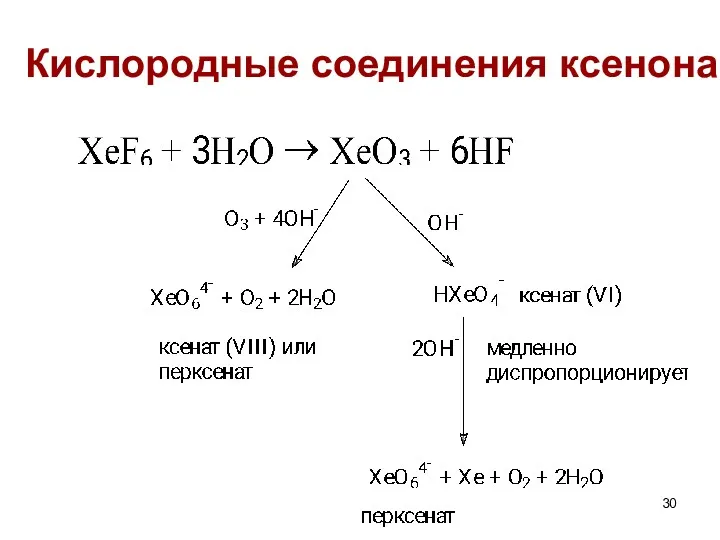
- 30. Кислородные соединения ксенона
- 31. Известные соли: Na4XeO6⋅8H2O, Ba2XeO6⋅nH2O Ba2XeO6 + 8H2SO4 → 2BaSO4 + 2H2O + XeO4 перксенат конц. XeO4
- 32. Кислородные соединения ксенона являются сильными окислителями! Кислые растворы: H4XeO6 XeO3 Xe HXeO63− HXeO4− Xe Щелочные растворы:
- 33. Соединения других благородных газов
- 34. Соединения криптона Соединения криптона менее устойчивы, чем ксенона, например: XeF2 - термод. стабилен ( ). KrF2
- 35. Соединения криптона KrF2 медленно разлагается при комнатной температуре. Это требует особого, нетрадиционного, подхода к синтезу! Для
- 36. Другие фториды криптона Получен ряд солей с катионами [KrxFy]+, например: [KrF]+[SbF6]−, [Kr2F3]+[AsF6]− Интересно, что взаимодействие солей
- 37. Применение инертных газов
- 38. 1) создание инертной атмосферы при проведении химических реакций и технических процессов, требующих отсутствия кислорода (литье из
- 39. 2) фториды ксенона и криптона используются как мягкие фторирующие агенты в неорганическом и органи-ческом синтезе Например:
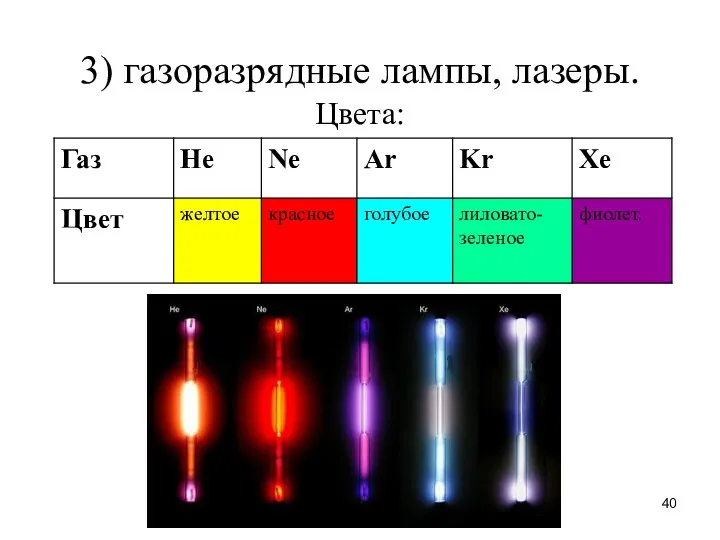
- 40. 3) газоразрядные лампы, лазеры. Цвета:
- 42. Скачать презентацию





















![XeF2 + 2 SbF5 → [XeF]+[Sb2F11]− XeF4 + BiF5 →](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/401295/slide-27.jpg)
![Комплексообразование XeF6 + CsF → Cs[XeF7] - бесцв. крист., разлагаются](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/401295/slide-28.jpg)





![Другие фториды криптона Получен ряд солей с катионами [KrxFy]+, например:](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/401295/slide-35.jpg)



 Углерод. Элемент IV группы
Углерод. Элемент IV группы Электронный помощник по химии 8 класс
Электронный помощник по химии 8 класс Химия переходных элементов IV – V группы
Химия переходных элементов IV – V группы Общая характеристика неметаллов
Общая характеристика неметаллов Ископаемые углеводороды
Ископаемые углеводороды Закон сохранения массы веществ. Химические уравнения
Закон сохранения массы веществ. Химические уравнения Гидролиз солей
Гидролиз солей Неорганическая химия
Неорганическая химия Химический анализ веществ
Химический анализ веществ Альдегиды и кетоны
Альдегиды и кетоны Углеводы. 10 класс
Углеводы. 10 класс Углеводороды. Применение природных источников углеводородов и продуктов их переработки
Углеводороды. Применение природных источников углеводородов и продуктов их переработки Состав, строение и свойства натурального каучука
Состав, строение и свойства натурального каучука Титан және титан қорытпалары. Деформацияланған және кұйма титан қорытпалары
Титан және титан қорытпалары. Деформацияланған және кұйма титан қорытпалары Химическая технология природных энергоносителей и углеродных материалов
Химическая технология природных энергоносителей и углеродных материалов Кислые породы умеренно-щелочного ряда
Кислые породы умеренно-щелочного ряда Классификация химических реакций
Классификация химических реакций Характеристика химического элемента по кислотно-основным свойствам образуемых им соединений. Амфотерные оксиды и гидроксиды
Характеристика химического элемента по кислотно-основным свойствам образуемых им соединений. Амфотерные оксиды и гидроксиды Первые шаги в минералогию: от новичка до знатока
Первые шаги в минералогию: от новичка до знатока Инертные газы
Инертные газы Металлогеническая периодизация истории Земли. Геолого-металлогенические ранги
Металлогеническая периодизация истории Земли. Геолого-металлогенические ранги Диссоциация кислот, оснований, солей
Диссоциация кислот, оснований, солей 20231110_zakon_avogadro
20231110_zakon_avogadro Спирттер мен фенолдар
Спирттер мен фенолдар Аминокислоты и белки
Аминокислоты и белки Карбон
Карбон Класифікація дисперсних систем харчових продуктів. Характеристика колоїдних систем
Класифікація дисперсних систем харчових продуктів. Характеристика колоїдних систем Азотная кислота
Азотная кислота