Содержание
- 2. С точки зрения ТЭД, кислотами называются электролиты, которые в водном растворе диссоциируют на ионы водорода и
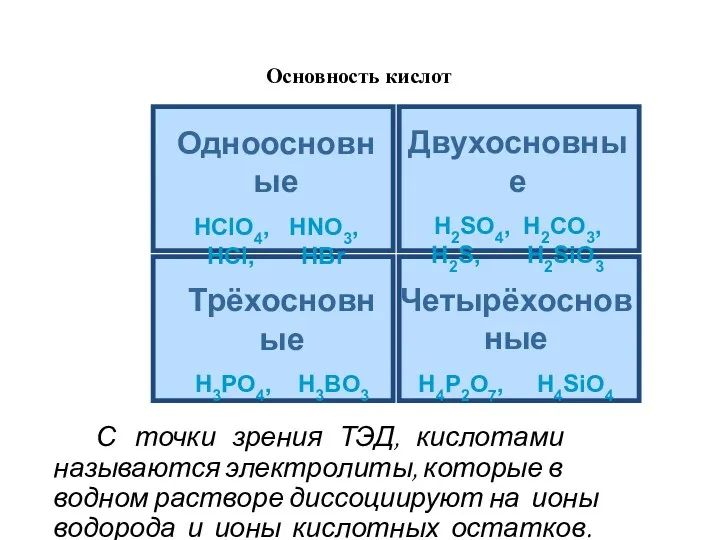
- 3. HCl = H+ + Cl- HNO3 = H+ + NO3- HClO4 = H+ + ClO4- Кислоты
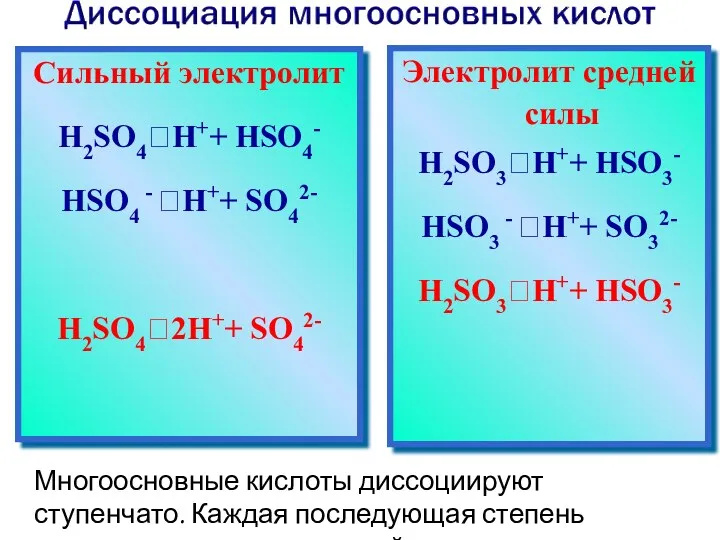
- 4. Многоосновные кислоты диссоциируют ступенчато. Каждая последующая степень протекает хуже предыдущей. Сильный электролит H2SO4⮀H++ HSO4- HSO4 -
- 5. С точки зрения ТЭД, основаниями называются электролиты, которые в водном растворе диссоциируют на ионы металла и
- 6. NaOH = Na+ + OH- Ba(OH)2 = BaOH+ + OH- → Ba2+ + 2OH- KOH =
- 7. Соли – это электролиты, которые диссоциируют на катионы металла или аммония NH4+ и анионы кислотных остатков.
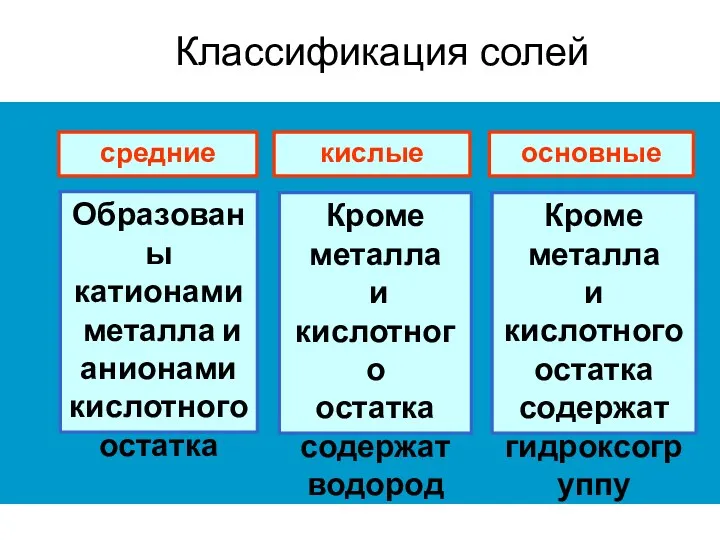
- 8. Классификация солей средние кислые основные Образованы катионами металла и анионами кислотного остатка Кроме металла и кислотного
- 9. Na2SO4 = 2Na+ + SO42- AlCl3 = Al3+ + 3Cl- Fe2(SO4)3 = 2Fe3+ + 3SO42- С
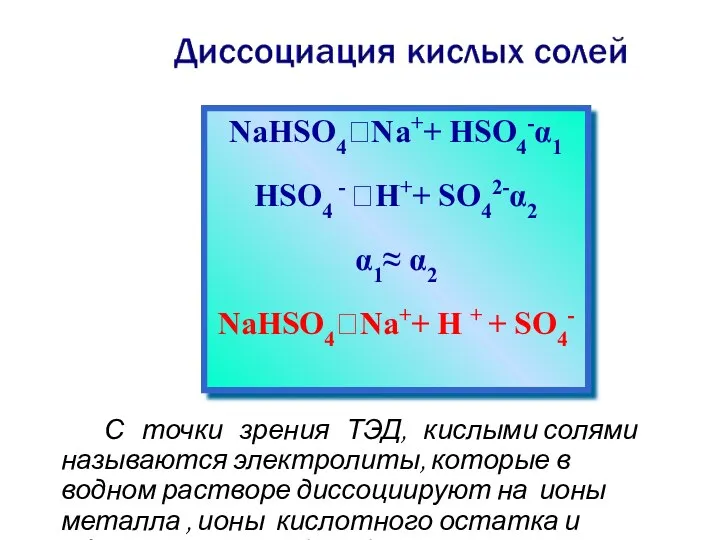
- 10. С точки зрения ТЭД, кислыми солями называются электролиты, которые в водном растворе диссоциируют на ионы металла
- 11. С точки зрения ТЭД, основными солями называются электролиты, которые в водном растворе диссоциируют на ионы металла
- 12. Реакции в растворах электролитов протекают до конца если: Образуется или растворяется осадок; Выделяется газ; Образуется малодиссоциирующее
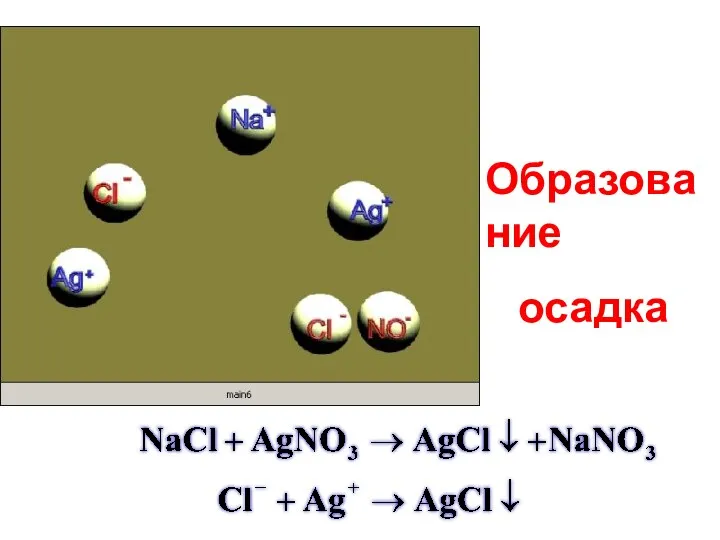
- 13. Образование осадка
- 14. Образование H2O
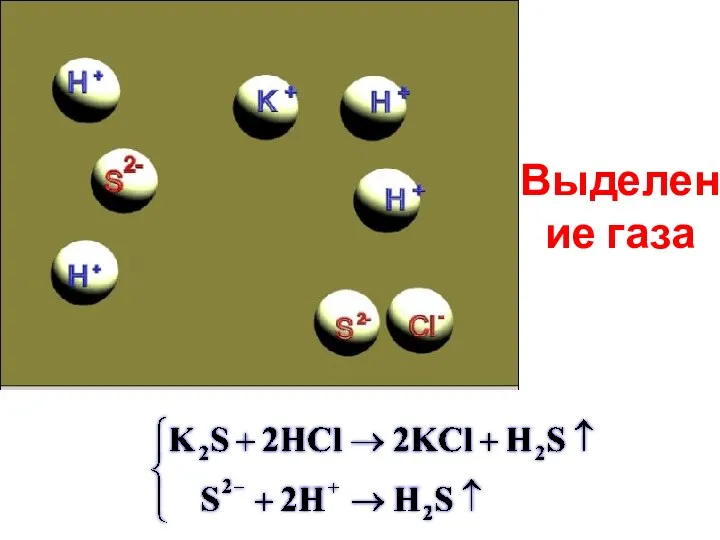
- 15. Выделение газа
- 17. Скачать презентацию








 Основные понятия. Химический язык
Основные понятия. Химический язык Функціональні матеріали для високоенергетичної електроніки. (Лекція 2)
Функціональні матеріали для високоенергетичної електроніки. (Лекція 2) Альдегіди. Склад, будова молекул альдегідів. Альдегідна характеристична (функціональна) група
Альдегіди. Склад, будова молекул альдегідів. Альдегідна характеристична (функціональна) група Оксиди нітрогену
Оксиди нітрогену Алкадиены. Химические свойства алкадиенов
Алкадиены. Химические свойства алкадиенов Цинк в функциональных пищевых и кормовых продуктах
Цинк в функциональных пищевых и кормовых продуктах Классы неорганических веществ (лекция № 4)
Классы неорганических веществ (лекция № 4) Нанотехнологии. Отдельные представители наночастиц
Нанотехнологии. Отдельные представители наночастиц Электронное строение элементов главной подгруппы III группы
Электронное строение элементов главной подгруппы III группы Диазины. Общая характеристика диазинов
Диазины. Общая характеристика диазинов Алкадиены
Алкадиены Энергетическое топливо и его классификация
Энергетическое топливо и его классификация Білки (протеїни)
Білки (протеїни) Строение и свойства материалов
Строение и свойства материалов Алюминий и его соединения. Строение атома
Алюминий и его соединения. Строение атома Неметаллы. Обобщающий урок. 9 класс
Неметаллы. Обобщающий урок. 9 класс Припекание взаимно растворимых твердых тел
Припекание взаимно растворимых твердых тел Технологии получения полимерных нанокомпозитов
Технологии получения полимерных нанокомпозитов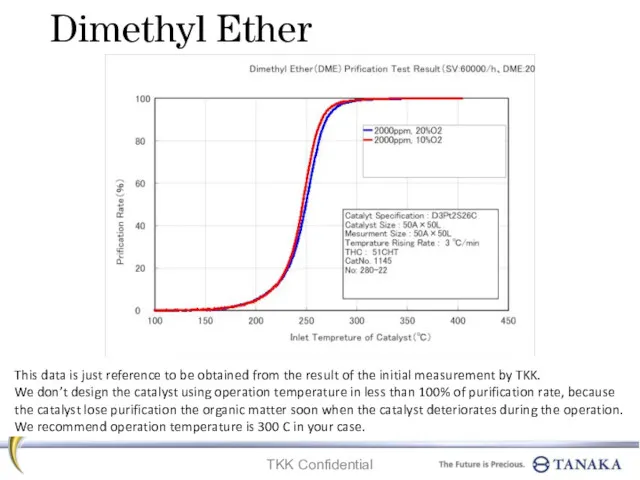 Dimethyl ether. Prification test result
Dimethyl ether. Prification test result Озон. Строние молекулы озона
Озон. Строние молекулы озона Лабораторная работа Исследование состава молока
Лабораторная работа Исследование состава молока История открытия периодической системы химических элементов Д.И. Менделеева
История открытия периодической системы химических элементов Д.И. Менделеева Суды коагуляциялау әдісі. Судың сапасын жақсартудың арнайы әдістері
Суды коагуляциялау әдісі. Судың сапасын жақсартудың арнайы әдістері Растворимость малорастворимого сильного электролита
Растворимость малорастворимого сильного электролита яжелые металлы полезны или вредны?
яжелые металлы полезны или вредны? Товары из пластмасс. Система маркировки пластика
Товары из пластмасс. Система маркировки пластика Свойства кислорода. Получение кислорода методом вытеснения воздуха
Свойства кислорода. Получение кислорода методом вытеснения воздуха Растворы. Основные понятия. Концентрация. Законы Рауля
Растворы. Основные понятия. Концентрация. Законы Рауля