Содержание
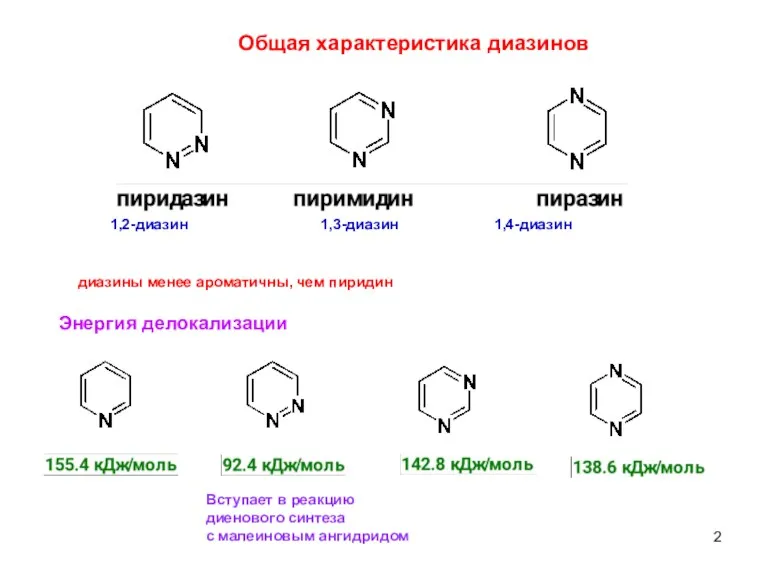
- 2. Общая характеристика диазинов диазины менее ароматичны, чем пиридин Энергия делокализации Вступает в реакцию диенового синтеза с
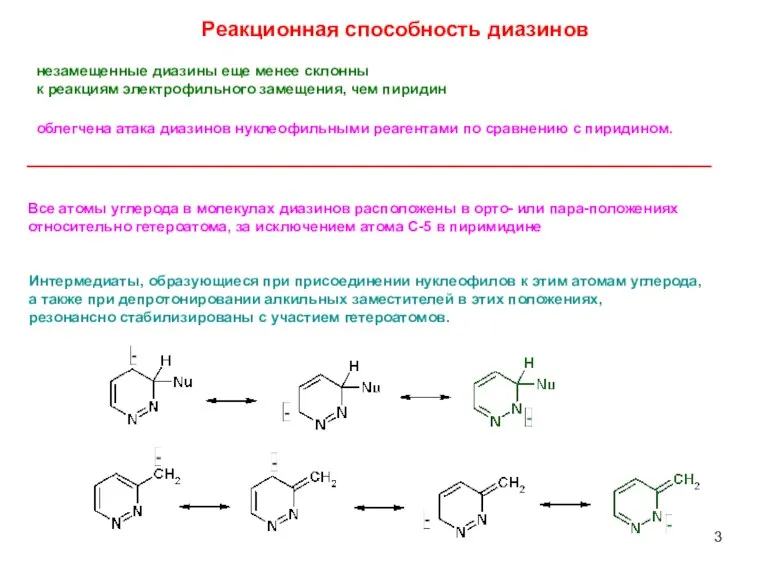
- 3. незамещенные диазины еще менее склонны к реакциям электрофильного замещения, чем пиридин Все атомы углерода в молекулах
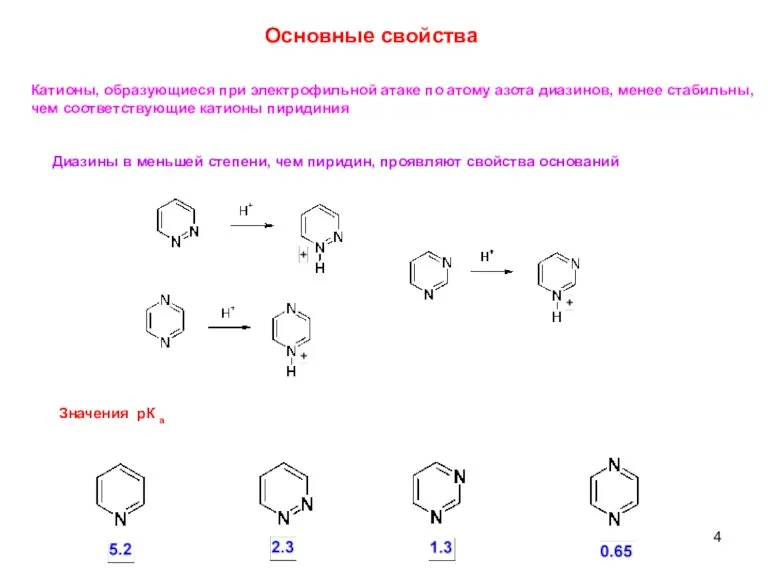
- 4. Диазины в меньшей степени, чем пиридин, проявляют свойства оснований Значения рК а Катионы, образующиеся при электрофильной
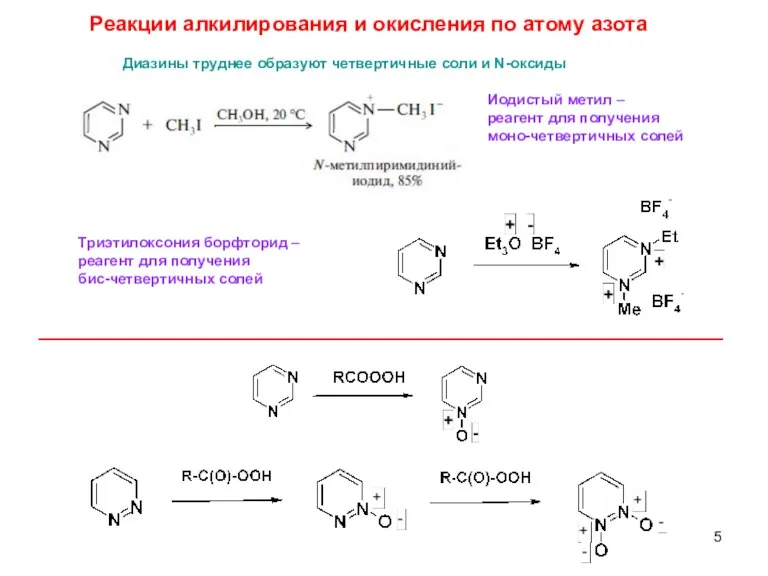
- 5. Диазины труднее образуют четвертичные соли и N-оксиды Реакции алкилирования и окисления по атому азота Триэтилоксония борфторид
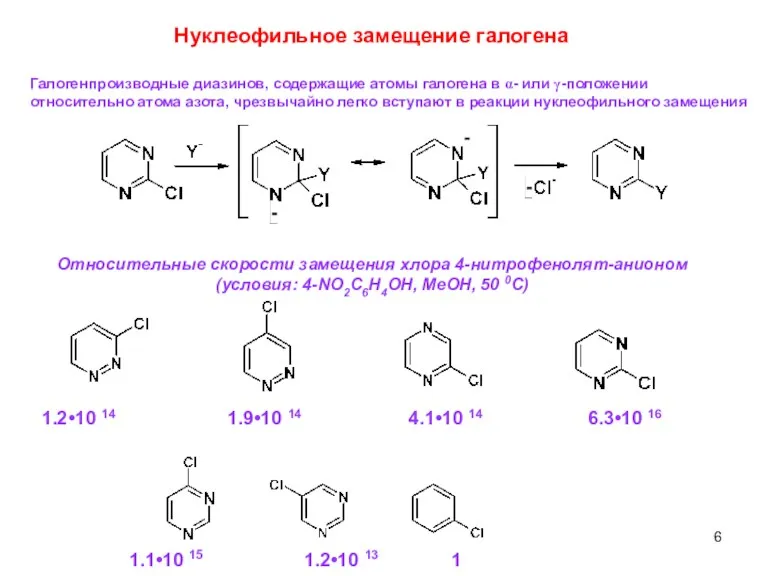
- 6. Относительные скорости замещения хлора 4-нитрофенолят-анионом (условия: 4-NO2C6H4OH, MeOH, 50 0C) 1.2•10 14 1.9•10 14 4.1•10 14
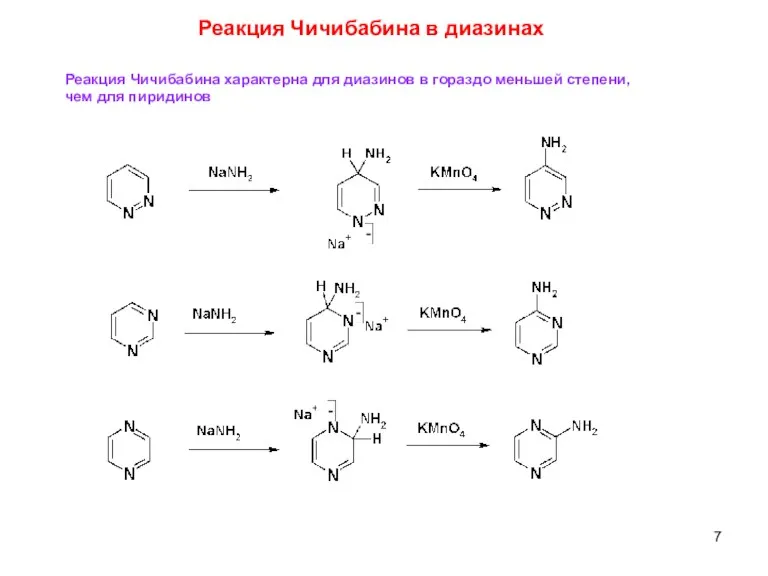
- 7. Реакция Чичибабина в диазинах Реакция Чичибабина характерна для диазинов в гораздо меньшей степени, чем для пиридинов
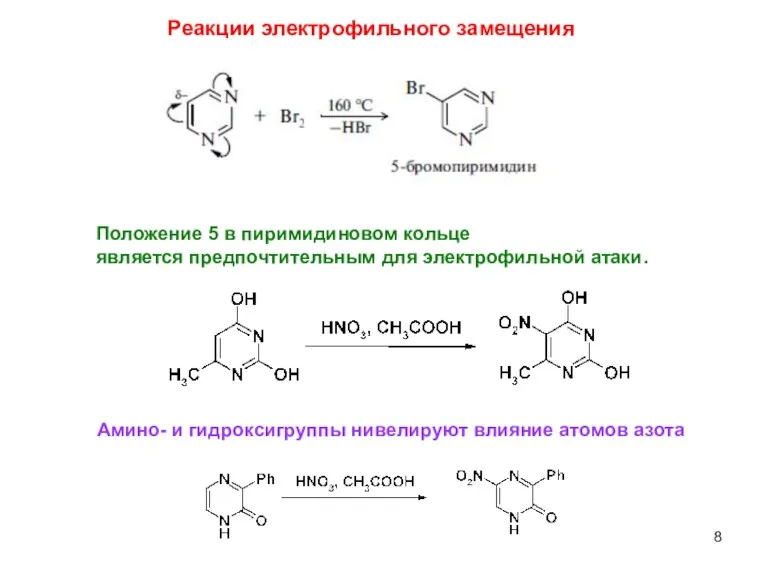
- 8. Положение 5 в пиримидиновом кольце является предпочтительным для электрофильной атаки. Амино- и гидроксигруппы нивелируют влияние атомов
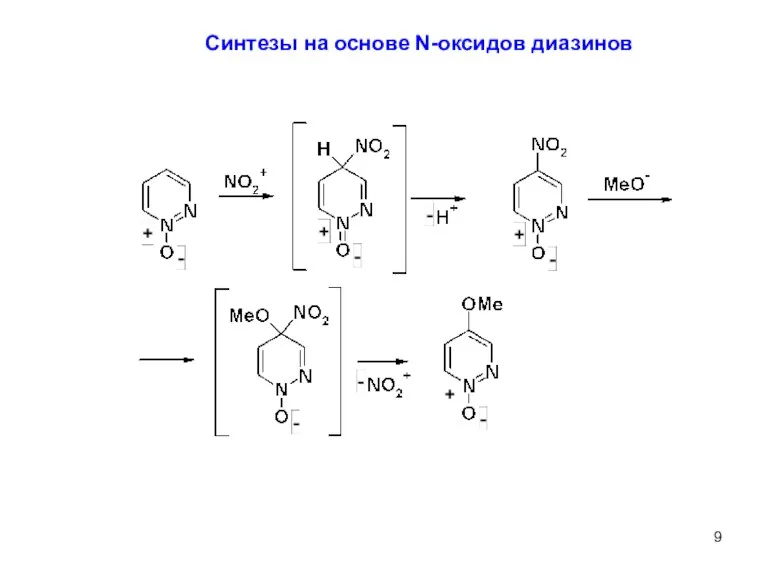
- 9. Синтезы на основе N-оксидов диазинов
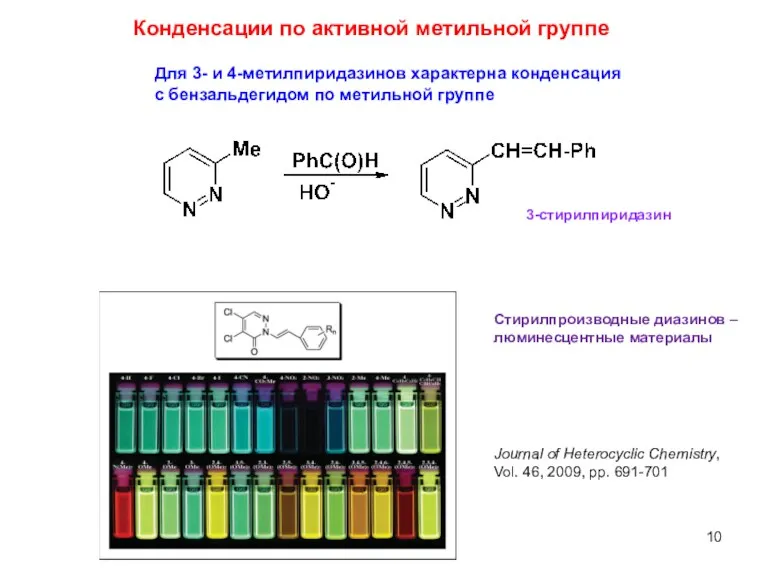
- 10. Для 3- и 4-метилпиридазинов характерна конденсация с бензальдегидом по метильной группе Конденсации по активной метильной группе
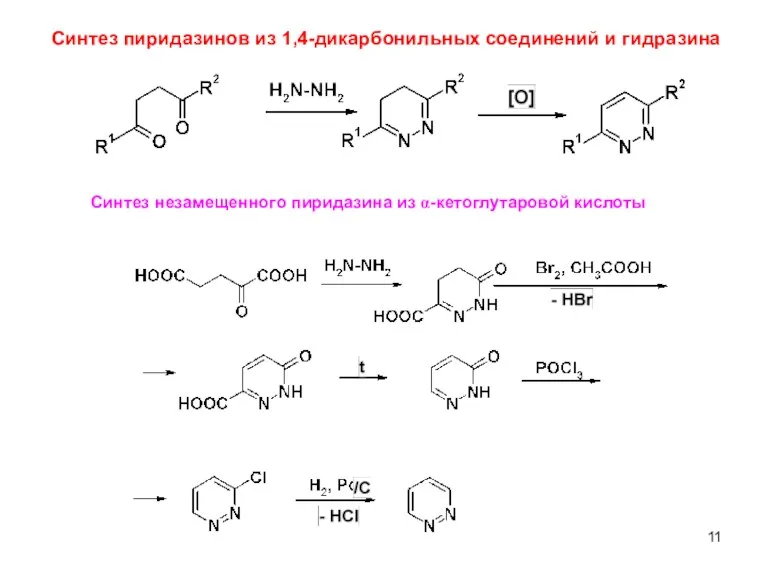
- 11. Синтез пиридазинов из 1,4-дикарбонильных соединений и гидразина Синтез незамещенного пиридазина из α-кетоглутаровой кислоты
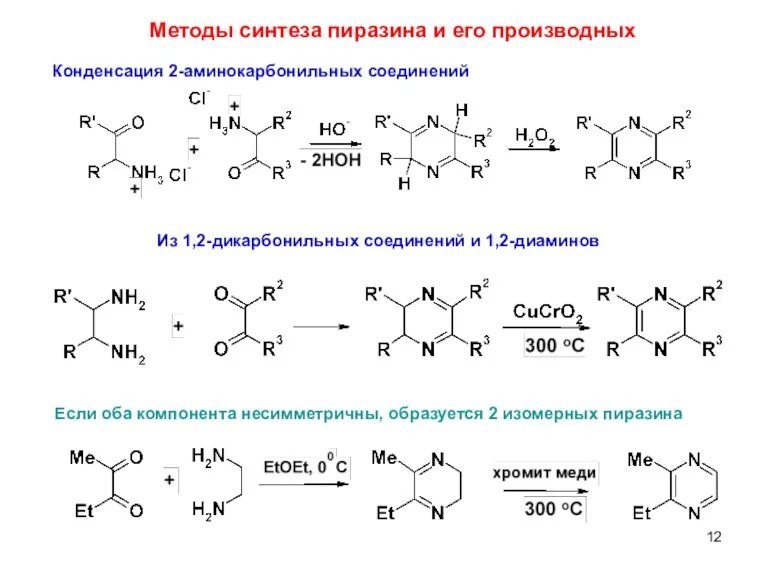
- 12. Методы синтеза пиразина и его производных Конденсация 2-аминокарбонильных соединений Из 1,2-дикарбонильных соединений и 1,2-диаминов Если оба
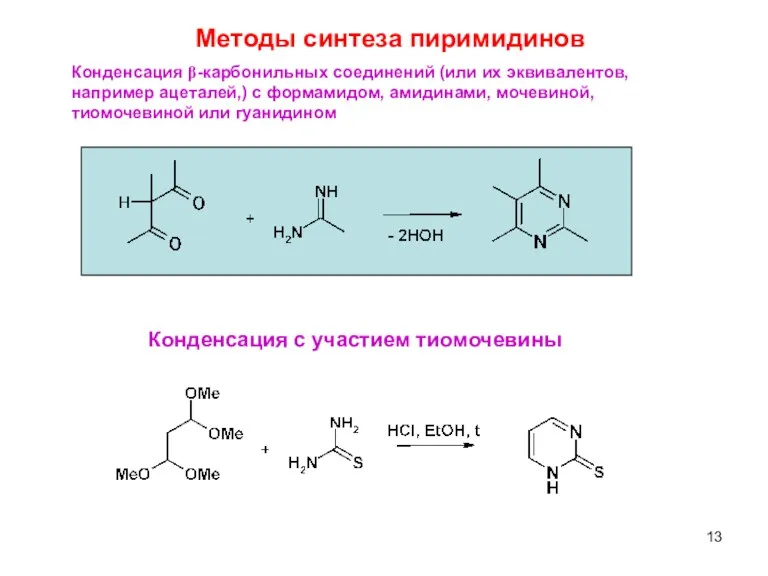
- 13. Конденсация β-карбонильных соединений (или их эквивалентов, например ацеталей,) с формамидом, амидинами, мочевиной, тиомочевиной или гуанидином Методы
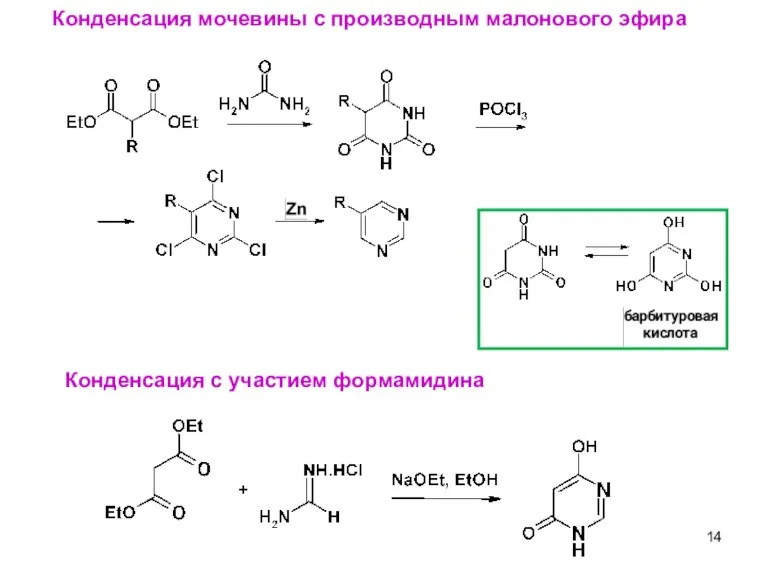
- 14. Конденсация мочевины c производным малонового эфира Конденсация с участием формамидина
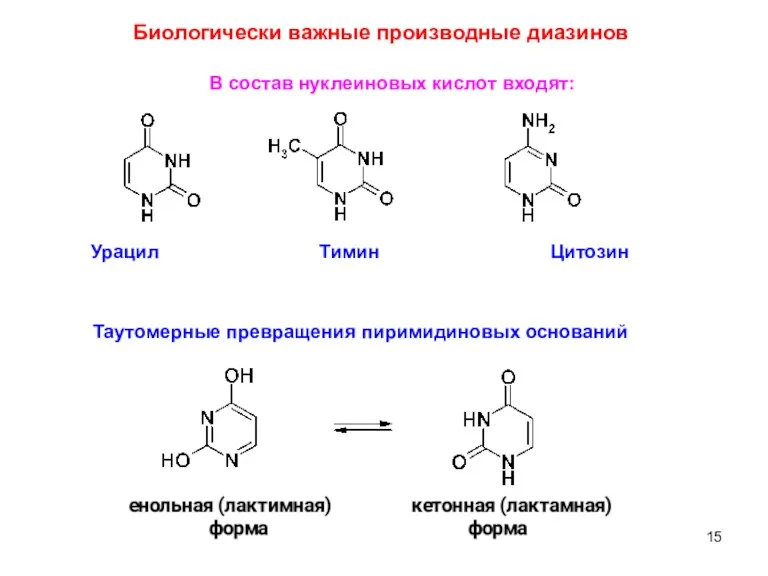
- 15. Биологически важные производные диазинов В состав нуклеиновых кислот входят: Урацил Тимин Цитозин Таутомерные превращения пиримидиновых оснований
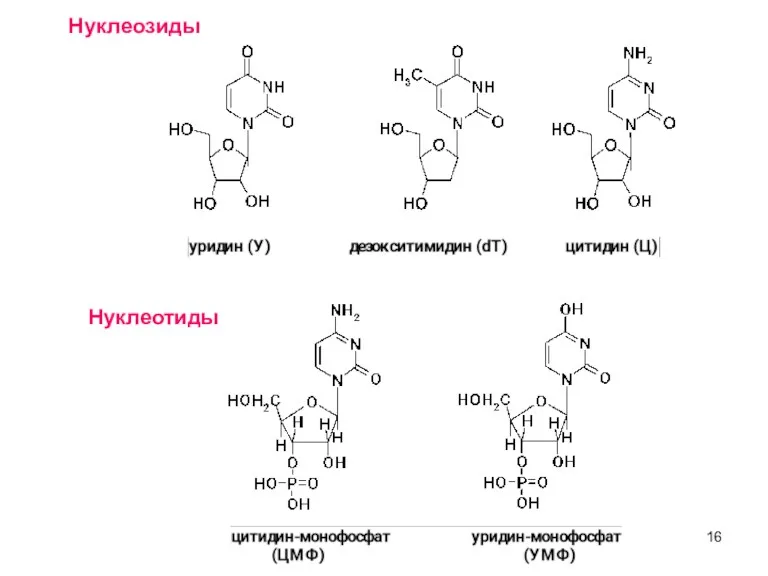
- 16. Нуклеозиды Нуклеотиды
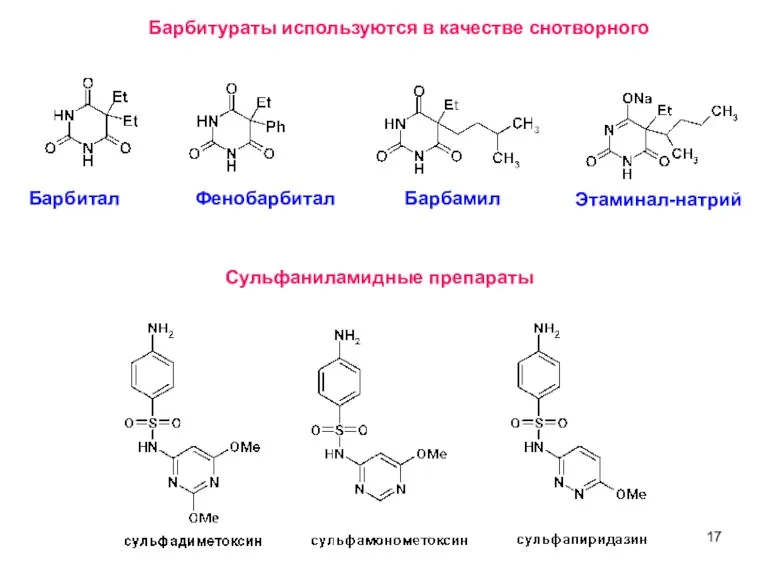
- 17. Барбитураты используются в качестве снотворного Барбитал Фенобарбитал Барбамил Этаминал-натрий Сульфаниламидные препараты
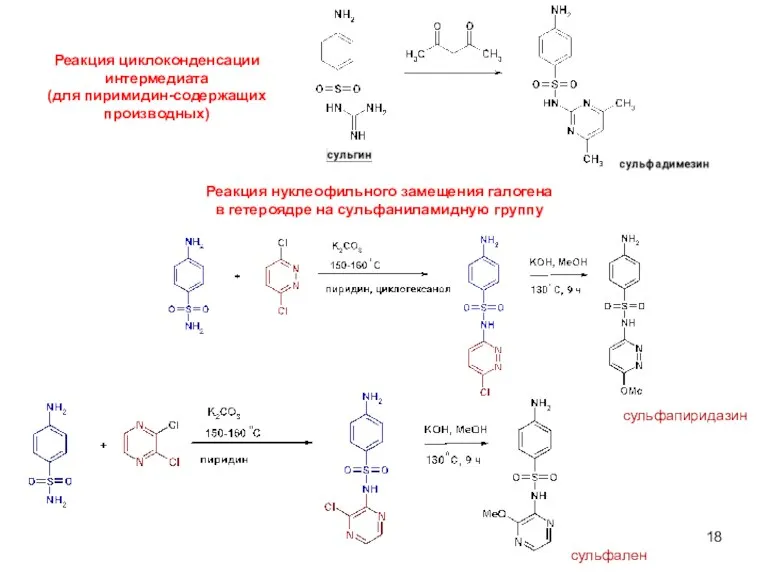
- 18. Реакция циклоконденсации интермедиата (для пиримидин-содержащих производных) Реакция нуклеофильного замещения галогена в гетероядре на сульфаниламидную группу сульфапиридазин
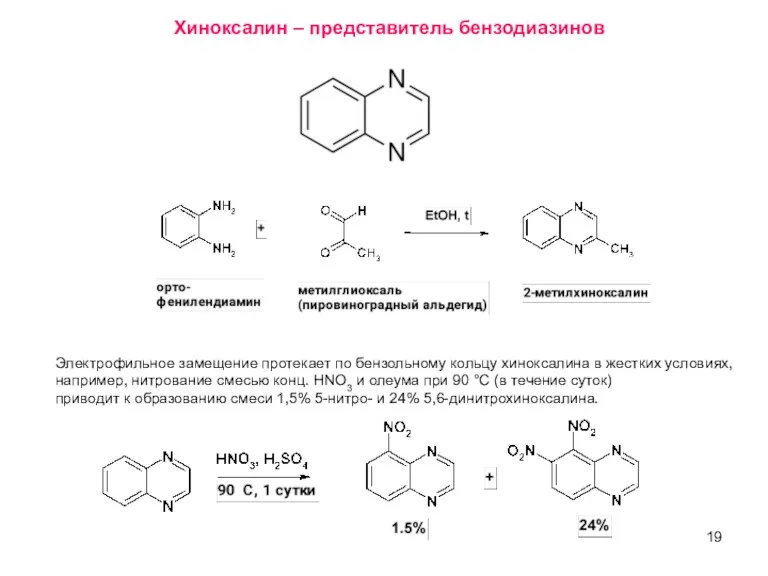
- 19. Электрофильное замещение протекает по бензольному кольцу хиноксалина в жестких условиях, например, нитрование смесью конц. HNO3 и
- 21. Скачать презентацию
 Таза зат және қоспа. Қоспаларды бөлу әдістері. Қосылыс Рure substances and mixtures . Мethods for separating mixtures. Compound
Таза зат және қоспа. Қоспаларды бөлу әдістері. Қосылыс Рure substances and mixtures . Мethods for separating mixtures. Compound Фуллерен С60 и его аналоги
Фуллерен С60 и его аналоги Кристаллические решётки и их виды
Кристаллические решётки и их виды Азотная кислота
Азотная кислота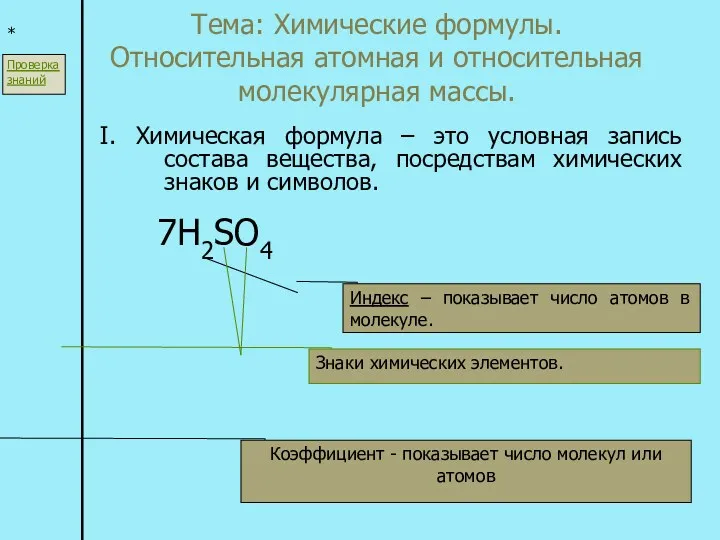 Химические формулы. Относительная атомная и относительная молекулярная массы
Химические формулы. Относительная атомная и относительная молекулярная массы Будова атома: ядро й електронна оболонка. Склад атомних ядер. Протонне та нуклонне число
Будова атома: ядро й електронна оболонка. Склад атомних ядер. Протонне та нуклонне число Получение и приминение этилена
Получение и приминение этилена Конструкционные полимеры: классификация, достижения и проблемы
Конструкционные полимеры: классификация, достижения и проблемы Дисперсные системы
Дисперсные системы Значення хімії у повсякденному житті
Значення хімії у повсякденному житті Получение спиртов. Применение
Получение спиртов. Применение Топливо. Классификация
Топливо. Классификация Лекция 6. Растворы электролитов
Лекция 6. Растворы электролитов Оксиген. Кисень, склад молекули, поширеність у природі. Фізичні властивості кисню
Оксиген. Кисень, склад молекули, поширеність у природі. Фізичні властивості кисню Строение, свойства и применение алкенов
Строение, свойства и применение алкенов Азот – простое вещество. Неметаллы
Азот – простое вещество. Неметаллы Дисперсные системы. Растворы
Дисперсные системы. Растворы Подготовка к ВПР по химии. 11 класс
Подготовка к ВПР по химии. 11 класс Типы расчетных задач, способы их решения. Задания 39-40
Типы расчетных задач, способы их решения. Задания 39-40 Курс хімії за 11 клас
Курс хімії за 11 клас Сера и её соединения
Сера и её соединения Группа веществ, изолируемых из биологического объекта путём минерализации (Металлические яды)
Группа веществ, изолируемых из биологического объекта путём минерализации (Металлические яды) Химические волокна
Химические волокна Сульфаттау және сульфирлеу процестері Сульфохлорлау арқылы алкилсульфонаттарды алу
Сульфаттау және сульфирлеу процестері Сульфохлорлау арқылы алкилсульфонаттарды алу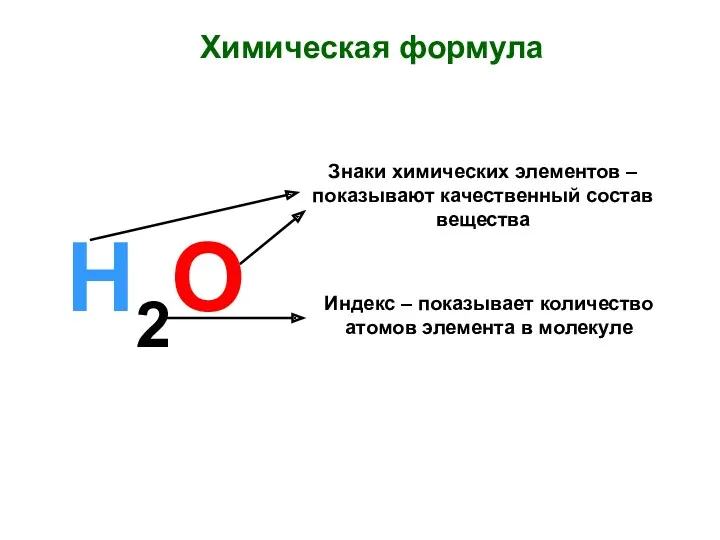 Химическая формула. Знаки химических элементов
Химическая формула. Знаки химических элементов Атом – сложная частица
Атом – сложная частица Основные синтетические полимеры
Основные синтетические полимеры Минерализация, иммобилизация, нитрификация және денитрификация процестері
Минерализация, иммобилизация, нитрификация және денитрификация процестері